参芪蛭龙汤对大鼠膜性肾病的实验研究
薛丕良,张玉昆,袁茵,白茹,刘欣欣,邓思瑶, 黄雅晨,肖洪彬,牛雯颖*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150042;2.黑龙江省中医药科学院,黑龙江 哈尔滨 150036)
膜性肾病(membranous nephropathy,MN)又称膜性肾小球肾炎(membranous glomerulonephritis,MG),是肾病综合征常见的病理类型之一。该病理类型的特点是肾小球上皮细胞下弥漫的免疫复合物沉积伴基底膜弥漫增厚。在临床上约70%~80%的膜性肾病患者以肾病综合征为表现形式,大多数病人肾功能正常或少数轻度受损,临床上该病动静脉血栓发生率较高,尤其以肾静脉血栓最为常见。目前膜性肾病发病呈上升趋势,严重危害人类的健康,临床上使用参芪蛭龙汤取得较好的治疗作用。本实验旨在观察参芪蛭龙汤对阳离子牛血清白蛋白致大鼠膜性肾病的药效学作用,为临床应用提供实验依据。
1 实验材料
1.1 实验动物
清洁级Wistar大鼠40只,雌雄各半,体质量(228±19)g。由黑龙江中医药大学实验动物中心提供,动物合格证号 SCXK(黑)2008004。
1.2 受试药物
参芪蛭龙汤中药饮片由黑龙江中医药大学附属第一医院中药房提供。
1.3 仪器
C2000-A全自动血凝仪(北京普利生仪器有限公司),LBY-N7500B全自动血液流变仪(北京普利生仪器有限公司),XS-500i全自动血液分析仪(希森美康医用电子上海有限公司),魅力2000型全自动生化分析仪(美国百昂集团仪器公司)。
1.4 试剂
纤维蛋白原(FIB)、凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)测定试剂盒(上海长岛生物技术有限公司,批号分别为1804041、1807016、1805062、1801008);白蛋白(Alb) 、总蛋白(TP)、肌酐(CRE)、尿素氮(VREA)、葡萄糖(GLU)、胆固醇(CHO)、甘油三脂(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT/GPT)、天冬氨酸氨基转移酶(AST/GOT)测定试剂盒(中生北控生物科技股份有限公司,批号分别为171419、171341、183531、183537、183642、182011、167651、170641、170541、182661、171351)。
2 方法
2.1 制备阳离子化牛血清白蛋白(C-BSA)
参照Border法[1-2],取67 mL无水乙二胺(EDA)液,加入500 mL双蒸水,再加入6 mol/L盐酸350 mL,调整pH值到4.75,冷却至25℃,进行搅拌,再加入天然牛血清白蛋白(N-BSA)5 g溶于25 mL重蒸馏水的溶液,搅拌完全后再加1.8 g炭化二亚胺盐酸盐(EDCHCL)维持25℃,持续搅拌2 h,保持pH值4.75,最后加4 mol/L(pH值4.75)的醋酸缓冲液30 mL,终止反应,即得到等电点提高的C-BSA溶液。将C-BSA溶液置于透析袋中,用4℃的双蒸水透析72 h(3~5 h换水1次),冷冻干燥后,即得BSA干粉。用聚丙烯酰胺等测定其等电点(PI),PI>8.5即可。C-BSA保存于-40℃备用。
2.2 模型制作
取Wistar大鼠40只,在实验前置于实验室(环境温度26℃,相对湿度60%)适应环境,一周后,将大鼠分别置代谢笼中,接24 h尿测尿蛋白;眼眶静脉采血,分离血清,测白蛋白、血清总胆固醇、甘油三酯、肌酐和尿素氮。
预免疫:对尿蛋白阴性的大鼠,留出10只作空白对照,对其余大鼠进行预免疫。将80 mg C-BSA溶于15 mL PBS中,与等量弗氏不完全佐剂混合,超声乳化完全后进行预免疫。除空白对照组外,于每只大鼠腹股沟、腋窝等处进行多点皮下注射,每只0.3 mL的乳化物,每点注射不超过0.05 mL。正常对照组则以PBS与弗氏不完全佐剂按上述比例乳化后进行皮下注射。一周后,进行正式免疫(制作模型):每次将C-BSA溶于1 mLPBS中进行尾静脉注射,首次C-BSA尾静脉注射量为3.5 mg/只,隔日1次,每周3次,6周内缓慢将注射量递增至5 mg/只,正常对照组注射同体积的PBS。6周后留取动物24 h尿,测血清白蛋白、血清总胆固醇、甘油三酯确定动物模型成功[1-2]。
2.3 中药制备
参芪蛭龙汤处方组成:党参20 g,黄芪30 g,当归15 g,川芎15 g,水蛭5 g(研末冲服),地龙20 g,白僵蚕15 g,虎杖15 g,淫羊藿30 g,凤尾草15 g。制法:以上10味,加12倍量水浸泡1 h,煎煮1 h,滤过,再加10倍量水煎煮1 h,滤过,滤液合并,浓缩成1∶1 4℃储存备用。
2.4 分组和给药
尿蛋白阴性未进行模型制作的10只大鼠分为空白组,其余制作膜性肾病模型大鼠30只,随机分为3组,即模型组、中药低剂量组和中药高剂量组。空白组:给予与参芪蛭龙汤组同等量的生理盐水;模型组:给予与参芪蛭龙汤组同等量的生理盐水;中药低剂量组:根据人(70 kg)的给药量换算成大鼠给药剂量约为4 g生药/kg,灌胃;中药高剂量组:根据人(70 kg)换算成大鼠给药剂量约为8 g生药/kg,灌胃。在造模2周后开始给予中药汤剂早晚各1次,连续给药4周。
2.5 检测指标
各组大鼠于治疗4周结束时先留取24 h尿,之后用5%水合氯醛腹腔注射麻醉,腹主动脉取血。
2.5.1 检查生化指标
取枸橼酸钠抗凝血离心(3 000 r·min-1,10 min)取血浆,全自动生化分析仪对血清总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血清肌酐(Scr)、血清尿素氮(BUN)、谷丙转氨酶(AlT)、谷草转氨酶(AST)、葡萄糖(GLU)测定。
2.5.2 检查血常规
取EDTA-K2抗凝血对白细胞(WBC)、红细胞(RBC)、血小板(PLT)计数测定。
2.5.3 全血黏度和血浆黏度的测定
取肝素抗凝血1 mL离心(3 000 r·min-1,10 min),取血浆用于全血黏度和血浆黏度测定。
2.5.4 凝血4项的测定
取枸橼酸钠抗凝血的血浆按照试剂盒说明书测定。FIB、PT、TT和APTT。
2.5.5 24 h尿蛋白定量(24 h-UTP)测定
留取大鼠24 h尿液,采用双缩脲法测定24-UTP。
2.6 统计学处理
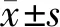
3 结果
3.1 生化指标的测定
3.1.1 肝功指标
与空白组比较,模型组TP、ALB含量显著下降(P<0.01)。与模型组比较,中药低剂量组TP、ALB含量呈上升趋势(P>0.05);中药高剂量组TP、ALB含量显著上升(P<0.05)。与模型组比较,3组AST、ALT均无显著变化(P>0.05)。结果见表1。

表1 中药高低剂量组对大鼠肝功的影响
注:与模型组比较,*P<0.05;与空白组比较,△△P<0.01
3.1.2 血脂含量的测定
与空白组比较,模型组TC、HDL-C含量显著上升(P<0.05),TG含量显著上升(P<0.01)。与模型组比较,中药高低剂量组TC含量均显著下降(P<0.05);中药低剂量组TG含量呈下降趋势(P>0.05),中药高剂量组TG含量显著下降(P<0.05);中药高低剂量组HDL-C含量无明显变化(P>0.05);3组LDL-C含量均无显著变化(P>0.05)。结果见表2。
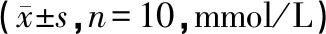
表2 中药高低剂量组对大鼠血脂含量的影响
注:与模型组比较,*P<0.05;与空白组比较,△P<0.05,△△P<0.01
3.1.3 血糖、尿素氮和肌酐的测定
与空白组比较,模型组GLU含量无明显变化(P>0.05)。与模型组比较,中药低剂量组GLU含量升高(P>0.05),中药高剂量组GLU含量明显升高(P<0.05);与模型组比较,3组BUN、Scr含量均无明显变化(P>0.05)。结果见表3。

表3 中药高低剂量组对大鼠GLU、BUN、Scr含量的影响
注:与模型组比较,*P<0.05
3.2 血常规测定
与空白组比较,模型组RBC计数下降明显(P<0.01);PTL计数升高明显(P<0.01)。与模型组比较,中药低剂量组RBC计数上升(P>0.05);中药高剂量组明显升高(P<0.05);中药高低剂量组PTL计数明显下降(P<0.05);3组WBC含量均无明显变化(P>0.05)。结果见表4。
3.3 凝血四项的测定
与空白组比较,模型组FIB含量明显升高(P<0.01)。与模型组比较,中药低剂量组FIB含量下降(P>0.05);中药高剂量组FIB含量明显下降(P<0.01);3组TT、APTT、PT含量均无明显变化(P>0.05)。结果见表5。

表4 中药高低剂量组对大鼠WBC、RBC、PLT计数的影响
注:与模型组比较,*P<0.05;与空白组比较,△△P<0.01

表5 中药高低剂量组对大鼠凝血四项含量的影响
注:与模型组比较,*P<0.05;与空白组比较,△△P<0.01
3.4 全血黏度和血浆黏度的测定
与空白组比较,全血黏度高切200 s-1模型组全血黏度明显下降(P<0.01)。与模型组比较,中药高低剂量组全血黏度呈上升趋势(P>0.05);3组血浆黏度和全血黏度低切3 s-1、中切60 s-1无明显变化(P>0.05)。结果见表6。
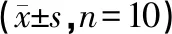
表6 中药高低剂量组对全血黏度和血浆黏度的影响
注:与空白组比较,△△P<0.01
3.5 尿蛋白定量测定
与空白组比较,模型组尿蛋白定量明显升高(P<0.01)。与模型组比较,中药低剂量组尿蛋白定量呈下降趋势(P>0.05);中药高剂量组尿蛋白定量明显下降(P<0.05)。结果见表7。

表7 中药高低剂量组对大鼠尿蛋白定量的影响
注:与模型组比较,*P<0.05;与空白组比较,△△P<0.01
4 讨论
近年来,膜性肾病的发病率呈现逐年上升的趋势。当前该病的西医治疗手段主要是糖皮质激素、免疫抑制剂和生物制剂等。2012年KDIGO指南提出,不推荐单独使用糖皮质激素作为治疗原发性膜性肾病(IMN)的首选治疗方案[3],推荐激素联合免疫抑制剂有一定的临床价值。目前糖皮质激素常常联合的免疫抑制剂为烷化剂、钙调磷酸酶抑制剂、吗替麦考酚酯和来氟米特等。常用的烷化剂为环磷酰胺和苯丁酸氮芥,研究表明环磷酰胺更有效且毒性更小。环磷酰胺的免疫抑制作用,主要是通过降低T淋巴细胞和B淋巴细胞的数量,尤其对B淋巴细胞的作用更为明显。临床研究显示:口服泼尼松第1个月1 mg/(kg·d)、在第2、3个月左右逐渐开始减量;同时每月使用环磷酰胺冲击,冲击方案为0.6 g/d,连用2 d,静脉滴注,该方案治疗IMN,不良反应较小,安全性相对较高[4]。临床上烷化剂治疗IMN取得不错的疗效,但是由于其短期和长期的毒副作用限制了该药在临床上的广泛使用[5],尤其是长期使用所引起的不可逆的性腺毒性和癌症[6]。钙调磷酸酶抑制剂(CNI)主要通过抑制钙调磷酸酶,从而阻止T淋巴细胞核因子的信号激活,抑制T淋巴细胞活化,此类的代表性药物有环孢素A(CSA)和他克莫司(FK506)。文献研究报道,IMN患者使用小剂量的环孢素A 6个月以上,能够有效地控制病情,达到完全缓解,且不容易复发[7]。最近几年,FK506广泛应用于肾脏病领域,尤其在膜性肾病的治疗中取得较好的疗效,具有起效快、副作用少的优势。国内外多项研究也进一步证实,FK506与环磷酰胺和骁悉相比,能更快缓解膜性肾病患者蛋白尿,同时升高血浆白蛋白,因此临床上FK506可作为膜性肾病的首选药物。国外一项研究显示,FK506与环磷酰胺在治疗IMN上,临床缓解率分别为85%和65%[8]。文献报道CNI治疗IMN患者,复发率较高,即使疗程延长至18或24月后停药,复发率仍然在50%左右,提示延长用药时间或许并不能减少该类药物停药后的复发率。如果患者病情复发重新使用初始的治疗方案也有效[2]。目前膜性肾病常用的治疗方案是小剂量激素联合FK506,但是停药后复发率比较高。
综上所述,虽然西医对该病治疗有一定的疗效,但也有明显的副作用,停药后容易复发。中药对该病的治疗取得较好的疗效,没有明显的毒副作用,参芪蛭龙汤是在广泛查阅文献,总结历代医家经验的基础上,反复遴选,精简药味,并应用临床多年的经验方,疗效确切。膜性肾病基本病机以脾肾亏虚为本,湿浊瘀血为标,方中党参、黄芪补益脾气,淫羊藿补益肾阳,鼓舞肾气,为君药;当归、川芎活血化瘀,水蛭、地龙、白僵蚕虫类入络,化瘀消癥为臣药;虎杖、凤尾草活血化瘀,利水消肿为佐药;全方共凑补益脾肾,化瘀利湿之效。现代药理研究证实[9]黄芪具有降低蛋白尿、提高血浆白蛋白、调节脂代谢、改善高凝状态、增强机体的免疫功能。水蛭具有抑制血小板活化、抗血栓、改善血液粘稠度、降低血脂等药理作用[10]。动物实验证实,川芎嗪能够减少膜性肾病大鼠肾小球免疫复合物的沉积,抑制基底膜增厚,降低血肌酐及尿素氮水平[11-12]。地龙类药物能使阳离子牛血清白蛋白诱导的肾炎大鼠尿蛋白减少,血浆白蛋白升高,肾脏病理损害减轻[13]。当归可以降低血小板聚集、降低血脂、改善肾组织的血液灌注,减轻肾脏组织的缺氧性损伤[14-15]。
实验结果表明,参芪蛭龙汤明显降低尿蛋白、升高血清总蛋白和白蛋白的作用;参芪蛭龙汤改善膜性肾病大鼠高脂高凝状态,升高血糖,无明显肝肾毒副作用。

