高迁移率族蛋白1在蛛网膜下腔出血脑血管痉挛病人外周血中的表达及临床意义
,,,
脑血管痉挛(cerebral vasospasm,CVS)是自发性蛛网膜下腔出血(aneurysmalsubarachnoid hemorrhage,SAH)最常见、最严重的并发症之一,其最常见于动脉瘤破裂后3 d~10 d,可导致痉挛动脉供血区域脑血流(cerebral blood flow,CBF)减少,造成脑迟发缺血性神经功能恶化当其不能有效控制,或持续时间较长,最终会导致脑梗死的发生,所以CVS是蛛网膜下腔出血病人致残、致死的重要原因[1-2]。研究发现,SAH后的CVS发病机制与炎症反应密切相关[3],而高迁移率族蛋白1(high-mobility group box 1,HMGB-1)作为新发现的一种晚期炎症介质及致炎因子,广泛参与了关节炎、脓毒血症、失血性休克、缺血再灌注损伤等多种炎症病理过程[4]。本研究通过检测HMGB-1的表达情况,初步探讨HMGB-1在SAH后CVS中的临床意义,进而为其生理病理机制的研究提供新的思路及依据。
1 资料与方法
1.1 一般资料 收集我科2014年1月—2017年6月收治的经诊断证实的自发性蛛网膜下腔出血,并且Hunt-Hess分级为Ⅰ~Ⅲ级的病人,SAH的诊断与治疗依据美国心脏学会/美国卒中学会诊疗指南进行。CVS的诊断标准[5]:①SAH发病后5~14 d内出现局灶性神经功能缺损或者意识能力下降;②CT平扫排除颅内再出血或者脑积水;③排除导致神经功能下降的其他因素;④经颅多普勒超声(TCD)检测血流速度:大脑中动脉(MCA)>200 cm/s,大脑前动脉(ACA)≥120 cm/s,大脑后动脉(PCA)>90 cm/s。此外,排除免疫系统疾病,严重感染,血液疾病,恶性肿瘤及严重肝、肾功能不全病人。本研究经山西医科大学第一医院伦理委员会批准,所有纳入病人均签署知情同意书。
1.2 HMGB-1的检测
1.2.1 主要仪器与试剂 超净台购自苏洁净化设备公司;酶标仪购自美国Bio-Rad 公司;离心机(Eppendorf Centrifuge 5417 R)购自德国Eppendorf公司;HMGB-1 ELISA检测试剂盒购自武汉博士德生物工程有限公司。
1.2.2 ELISA法检测血清HMGB-1水平 蛛网膜下腔出血病人均于入院12 h之内留取外周血3 mL,同时收集病人1 d~10 d的新鲜外周血,3 000 r/min离心10 min,收集上清液,于-80 ℃冰箱保存备用。按照ELISA检测试剂盒说明书检测病人血清HMGB-1的水平。操作完成后用酶标仪在450 nm波长处检测待测样品的吸光度值(OD值),绘制标准曲线,依照标准曲线测量样品数值从而得出样品含量。

2 结 果
2.1 一般资料比较 按照纳入排除标准,共纳入病人65例。根据其随后是否发生脑血管痉挛分为CVS组(20例)及Non-CVS组(45例),两组病人年龄、性别、吸烟史、高血压病史、发病至治疗时间等差异均无统计学意义(P>0.05)。详见表1。
2.2 不同蛛网膜下腔出血病人血清HMGB-1表达的动态变化情况 分别隔天监测了Non-CVS及CVS组病人入院后第1天~第11天外周血HMGB-1的表达水平,结果显示不同组病人HMGB-1水平均在第5天~第7天达到高峰,随后开始下降,且CVS组病人外周血HMGB-1表达高峰时间长于Non-CVS组。详见图1。

表1 自发性蛛网膜下腔出血病人
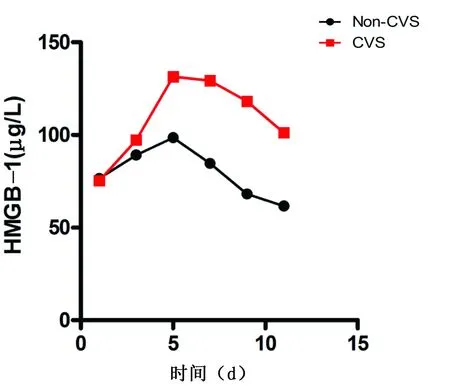
图1不同组别蛛网膜下腔出血病人外周血HMGB-1表达的动态变化情况
2.3 蛛网膜下腔出血病人血清HMGB-1表达与Hunt-Hess分级的关系 蛛网膜下腔出血病人血清中HMGB-1表达水平与Hunt-Hess分级呈明显正相关(r=0.670 7,P<0.00 01)。
2.4 蛛网膜下腔出血病人血清HMGB-1表达与Fisher分级的关系 蛛网膜下腔出血病人血清中HMGB-1表达水平与Fisher分级呈显著正相关(r=0.740 7,P<0.00 01)。
3 讨 论
近年来,大量的研究发现SAH以及CVS很大程度上是由于炎症因子的致炎作用。SAH后蛛网膜下腔产生多种炎性介质,如细胞因子、黏附分子、补体等。此外,在对CVS血管壁的研究中发现,在管壁中层有大量免疫球蛋白IgG和补体C3沉积,且沉积量与CVS的严重程度呈显著正相关[6]。随后的临床及动物实验中均发现相比正常脑脊液(cerebrospinal fluid,CSF),SAH后CSF中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)及肿瘤坏死因子α(TNF-α)等多种重要的炎症因子均有所升高,且水平越高预后越差[7]。
HMGB是一类存在于哺乳动物的核蛋白家族,包括HMGB-1、HMGB-2及HMGB-3 ,其中HMGB-1广泛分布于真核细胞内。通常当机体内环境处于稳态时,HMGB-1存在于细胞核中,当受到外界刺激打破平衡时,HMGB-1 的赖氨酸残基乙酰化后释放到胞外,再通过一系列下游的作用开始发挥致炎作用[8],是参与整个炎症过程的关键介质。研究发现,HMGB-1能够促进内皮细胞释放细胞间黏附分子及TNF-α、白细胞介素-8(IL-8)等多种细胞因子表达[9]。在炎症过程中,HMGB-1与RAGE、TLR2或TLR4结合,再通过MAPK及Erk1/2等信号通路激活核转录因子(NF-κB),从而能够调控下游基因的转录过程,释放大量趋化因子和细胞因子,诱导炎症反应,同时释放的细胞因子又可导致HMGB-1的进一步释放,形成正反馈通路,最终产生炎症的“级联瀑布”效应[10]。
本研究发现,相比没有发生CVS的SAH病人,CVS病人血清HMGB-1表达明显升高,而通过对HMGB-1的动态监测发现,CVS组病人外周血HMGB-1表达高峰时间长于Non-CVS组,进一步研究发现,SAH病人HMGB1的表达与Hunt-Hess分级及Fisher分级均呈显著正相关关系。以上研究结果表明,HMGB-1的过表达不仅可能导致SAH病人出现CVS,且HMGB-1的表达过高与SAH病人的严重程度密切相关。与本研究结果相似,Murakami等[11]通过兔SAH实验模型发现,与假手术组比较,SAH组脑干组织在造模第5天 HMGB-1的基因水平增加5倍以上,表明SAH可以明显上调促炎因子HMGB-1的表达,从而造成脑损伤。Nakahara等[12]研究发现,发病3 d、7 d、14 d SAH病人CSF中HMGB-1水平是影响SAH病人发生脑血管痉挛及预后的一个重要的独立危险因素。
综上所述,SAH后发生CVS的病人HMGB-1表达升高,且与病情的严重程度相关,提示HMGB-1可作为判断SAH预后及CVS发生率的特异性生物学标志物。此外,HMGB-1作为一种重要的炎症介质,参与脑损伤及脑血管痉挛的病理生理过程。因此,可以通过抗体或药物抑制HMGB-1,减轻炎症反应,降低脑血管痉挛的发生率,从而改善SAH病人的预后,为SAH的治疗提供了新的思路。

