幕上高血压脑出血患者神经内镜微创手术与开颅手术的疗效对比研究
肖涛 万娟 蒋文武
我国高血压脑出血的患病率占所有卒中患者的18.8%~47.6%,3个月病死率为20%~30%[1],再出血率约为24%[2]。脑出血的治疗方法主要有外科手术和内科保守治疗,外科手术治疗包括血肿穿刺、开颅手术、神经内镜微创手术等,但缺乏一致性意见[3-4]。近年来,越来越多的研究表明,使用神经内镜微创手术清除血肿的创伤更小,效果更好[5-6]。本研究拟通过对比神经内镜微创手术及传统开颅手术清除血肿的安全性和疗效,为临床医师对高血压脑出血患者治疗策略的选择提供参考。
1 对象及方法
1.1 对象
回顾性连续纳入2016年6月至2018年4月南华大学附属第一医院神经外科收治的高血压脑出血患者85例,其中男54例,女31例;年龄29~75岁,平均(54±12)岁;发病至手术时间3~36 h,平均(14±7) h;均为幕上脑出血,其中基底节区出血42例,丘脑出血28例,皮质出血15例;出血位于左侧44例,右侧41例;破入脑室38例;出血量32~82 ml,平均(52±11) ml;术前格拉斯哥昏迷量表(GCS)评分6~12分,平均(8.2±1.5)分;既往高血压病史60例。根据治疗方式的不同,将85例患者分为开颅手术组(51例)和内镜治疗组(34例)。开颅手术组男36例,女15例;年龄29~75岁,平均(53±12)岁;出血量32~82 ml,平均(52±4) ml;术前GCS评分6~12分,平均(8.2±1.3)分。内镜治疗组男18例,女16例;年龄32~74岁,平均(55±12)岁;出血量35~75 ml,平均(53±4) ml;术前GCS评分6~11 分,平均(8.2±1.2)分。两组患者年龄、性别、出血量、术前GCS评分的差异均无统计学意义(均P>0.05),具有可比性。患者或其家属签署了诊疗知情同意书。
1.2 纳入与排除标准
纳入标准:(1)高血压脑出血的诊断符合文献[1]标准,并经头部CT证实为单侧幕上脑出血,可伴血肿破入脑室;(2)基底节区出血>30 ml且伴意识丧失;(3)皮质下出血>30 ml,且中线结构移位>5 mm;(4)对服用华法林等抗凝药物但血小板计数及凝血功能均正常者,术前给予维生素K及新鲜冰冻血浆。排除标准:(1)年龄>75岁;(2)幕下脑出血;(3)颅内血管畸形、动脉瘤、脑外伤或脑肿瘤所致的脑出血;(4)脑疝形成;(5)有严重全身系统疾病或凝血机制障碍不能耐受手术及中枢循环衰竭等生命体征不平稳;(6)GCS评分<6 分;(7)患者或其家属未签署诊疗知情同意书。
1.3 研究方法及评价标准
记录并对比分析两组患者的基线资料、手术及其相关并发症情况,基线资料包括性别、年龄、高血压病史、出血量、出血部位等;手术及其相关并发症包括血肿清除率、手术时间、术后再出血率、颅内感染率。对两组患者术后3个月疗效进行评价。高血压病的诊断符合文献[7]标准。术前出血量及术后残余血肿体积均采用多田公式进行计算,即出血量或残余血肿体积(ml)=长(cm)×宽(cm)×层厚(cm)/2[8]。血肿清除率(%)=(术前血肿体积-术后残余血肿体积)/术前血肿体积×100%[9]。颅内感染的诊断参照文献[10]标准,包括临床症状(发热、头痛、呕吐)、体征(体温>38 ℃、脑膜刺激征阳性)、实验室检查结果异常[脑脊液:白细胞计数>10×106/L,葡萄糖<2.25 mmol/L,蛋白含量>0.45 g/L和(或)脑脊液细菌培养阳性]。手术时间的计算为从切开头皮至完成头皮缝合的耗时。
1.4 手术方式
1.4.1传统开颅手术:对于基底节区和丘脑出血常规使用“大问号”切口,皮质血肿则采用临近血肿区域行“马蹄形”切口。切开头皮及取下骨瓣后剪开硬脑膜。手术通道选择从颞(额)上回或中回皮质进入,显微镜下清除血肿;对于伴脑室出血者必要时行脑室外引流。血肿清除满意后,缝合或减张缝合硬脑膜并保留或去除骨瓣。
1.4.2神经内镜微创手术:在全身麻醉下,患者取仰卧位,头高脚底,不常规使用Mayfield头架。患者在神经导航下定位穿刺方向及深度(图1a)。常规采取中线旁开3 cm,根据术前设计的计划,导航棒确定穿刺点及穿刺方向。以穿刺点为中心,做平行中线方向长4~5 cm直切口(图1b),铣刀铣成直径约为3 cm的骨窗,十字状剪开硬脑膜。采用双极电凝,避开皮质血管,电凝局部皮质数毫米并稍切开。对于表浅血肿,通过导航定位后行4~5 cm直切口。沿术前设计的穿刺方向及深度进行穿刺,当微创手术扩展器进入血肿后可有明显突破感,常规穿刺至血肿底部,透明神经内镜(Karl Storz 0°或30°观察镜,德国)工作鞘沿扩张器置入预设深度(穿刺靶点为血肿最远端前5 mm),拔除穿刺扩展器并留置透明工作鞘,后者可作为神经内镜微创手术操作的通道[11]。利用透明工作鞘底部的倾斜平面,旋转及后退工作鞘使血液流入工作鞘内,予以清除,并使用双极电凝止血。神经内镜在血肿腔内操作时,腔壁小血肿不强行清除,以免引发新的出血及脑实质破坏。血肿清除以后,缓慢旋转拔出工作鞘,覆盖明胶海绵止血,缝合硬脑膜,连接片固定颅骨,缝合头皮各层。
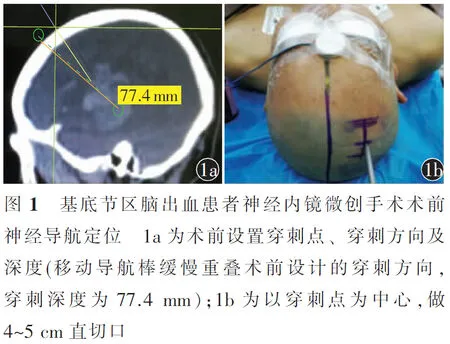
两组患者分别于术后1、2、3、5和7 d行头部CT检查,以术后1 d结果评估残余血肿体积、再出血及周围水肿等,并观察颅内感染等手术相关并发症。对术后再出血可行二次手术。
1.5 疗效及随访
通过门诊或电话的方式进行随访。随访3个月时,格拉斯哥预后量表(GOS)评分4~5分为预后良好,以1~3分为预后不良[12-13]。
1.6 统计学分析
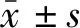
2 结果
2.1 基线资料比较
两组患者男性、高血压病史、年龄、术前GCS评分、出血量和出血部位的差异均无统计学意义(均P>0.05)。见表1。

表1 两组高血压脑出血患者基线资料比较
注:GCS格拉斯哥昏迷量表;a为χ2值,b为t值
2.2 手术及其相关并发症情况比较
开颅手术组有2例患者因再出血行二次手术;内镜治疗组有1例患者术后10 h复查头部CT提示再次出血,因家属放弃治疗最终死亡。内镜治疗组血肿清除率高于开颅手术组,手术时间少于开颅手术组,组间差异均有统计学意义(均P<0.01);两组患者术后再出血率及颅内感染发生率的差异均无统计学意义(均P>0.05)。见表2。

表2 两组高血压脑出血患者手术及并发症情况比较
注:a为t值,b为Fisher确切概率法,“-”表示无数据
2.3 随访结果
内镜治疗组预后良好率高于开颅手术组,组间差异有统计学意义[82.4%(28/34)比60.8%(31/51),χ2=4.470,P=0.034]。
3 讨论
随着颅内血肿微创治疗技术的进步,神经内镜下治疗脑出血受到重视[14]。Auer等[15]首次报道了脑出血的神经内镜治疗,结果显示,内科保守治疗者病死率为70%,而神经内镜微创手术治疗者病死率为30%。
脑出血后脑组织损伤可因血液的毒性作用和机械压迫所致[16],手术的目的主要是通过清除血肿以解除血肿的占位效应,从而减轻毒性反应及周围脑组织水肿[11]。既往研究认为,手术疗效并不受血肿清除率的影响[17-18]。然而,新近的研究表明,血肿清除率与预后明显相关,神经内镜微创手术的血肿清除率高于传统开颅手术,其预后优于传统开颅手术[19]。本研究内镜治疗组血肿清除率高于开颅手术组,组间差异有统计学意义(P<0.01),与文献报道一致。
脑出血部位主要发生于丘脑、基底节区,且血肿多数为纵轴,传统手术一般选择距离血肿最近的位置,手术过程中医源性白质纤维束损伤可能较大[20]。神经内镜微创手术相比开颅手术,沿白质纤维束及血肿纵轴,可对白质纤维束进行保护,减少二次脑组织损伤[5]。此外,大多脑出血患者年龄大且合并多种并发症,手术时间对患者预后亦至关重要,手术时间延长可增加并发症发生率及病死率,预后亦更差[21]。本研究结果显示,内镜治疗组手术时间少于开颅手术组,组间差异有统计学意义(P<0.01),且预后良好率高于开颅手术组[82.4%(28/34)比60.8%(31/51),χ2=4.470,P=0.034)],与其他中心报道一致[22]。
透明神经内镜工作鞘运用于内镜器械系列,在手术过程中,可通过旋转工作鞘,周边血肿通过重力作用可自行挤入术野,能最大限度地清除血肿及减少脑组织牵拉损伤[15,23]。内镜虽有一个很明显的优势是能够观察到更小的出血点及能够防止对实质结构的损伤[6],但难以像传统开颅手术一样将吸引器及双极电凝同时深入血肿腔内止血。Nagasaka等[24]研究报道,可将吸引管通入单极电凝的电流进行凝固止血,或将吸引器拿出,再把双极深入工作鞘内进行电凝止血。笔者在治疗过程中的体会:(1)在手术过程中,勿只顾清除血肿,术中一旦发现责任动脉,先予以电凝后再清除血肿;(2)对于无法判断出血点或出血较多者,可先用吸引器吸住明胶海绵及棉片压迫出血,待其出血减少后拿出明胶海绵及棉片,明确相关责任血管再予以双极电凝止血。
张源等[25]对行神经内镜微创手术的54例脑疝患者进行了报道,均为一侧瞳孔散大的脑出血患者,其中23例行内镜治疗,31例行开颅手术。结果显示,神经内镜治疗在手术时间、术中出血量方面均优于开颅手术,而两种治疗方式在术后3个月 GOS 评分的差异无统计学意义,但内镜治疗组植物生存状态率与重残率较开颅手术组有下降,而轻残率明显增加。笔者认为,脑疝患者脑组织水肿严重,建议行血肿清除+标准大骨瓣减压术。
综上,对于幕上自发性脑出血,在安全性和疗效方面微创内镜下血肿清除术是一种较好的手术方法。本研究样本量较小,且为单中心回顾性分析,研究结果存在一定的局限性,未来需大样本数据进一步验证。

