弓背青鳉3种雌激素受体基因的克隆及其表达分析
黄顺楷,郭昱嵩,汪 淳,张海瑞,王淑如,董忠典
(广东海洋大学水产学院,广东 湛江,524088)
雌激素是性类固醇激素的一员,其他还包括雄激素和孕激素[1]。雌激素在所有脊椎动物及一些昆虫体内均有发现[2-3]。动物含有3种内源性雌激素:雌酮(Estrone)、雌二醇(Estradiol,E2)和雌三醇(Estriol)。其中,雌二醇雌激素效力最强,且最为普遍。除在许多器官中起调节作用外,雌激素还参与生殖细胞发生和促性腺激素调节等方面的调控[4]。虽然在雄性动物体内雌激素水平明显低于雌性,但雌激素对雄性动物也同样具有重要生理作用[5]。
雌激素受体(Estrogen Receptor, ER)是核受体超家族的一员,具有介导雌激素调节转录的作用。雌激素一旦进入细胞,很快与 ER结合,并激活 ER二聚化,使其与靶基因结合调控相关基因转录[6]。在大多脊椎动物中,er家族包括2种亚型erα和erβ。在鱼类中,由于特有的基因组复制事件,使得众多的er亚型被发现[7-11]。一些系统发育上较为古老的鱼类,只发现2种er亚型[12]。
雌激素受体功能的差异性表现在同一组织中er有不同表达水平。在小鼠卵泡细胞中发现,颗粒细胞增加与er表达量有关,其中erβ显著高于erα,可能表明erβ参与颗粒细胞增殖和分化[13]。雌激素受体敲除模型构建,为研究雌激素受体功能提供了极大便利。分别对雌性[14]和雄性[15]小鼠(Mus musculus)进行er敲除,发现雌鼠不育,卵巢在排卵前停止发育;而雄鼠则出现睾丸萎缩等生殖能力降低现象。在大黄鱼(Larimichthys crocea)中,Chen等[16]发现erα和erβ2在肝中有明显高表达,推测其在肝中起介导雌激素效应作用;同时,在不同卵泡细胞、滤泡细胞和不同精子发育阶段中,er各亚型有差异的表达特征,Chen等[16]认为不同er受体类型可能在参与性腺发育和排卵过程中起不同作用。研究鱼类雌激素受体功能,将有助于进一步了解受体介导雌激素机制,为完善雌激素调控理论提供基础。
弓背青鳉(Oryzias curvinotus)又称海南青鳉,具有繁殖力强、世代周期短、广盐性等特点,具有开发为模式生物的潜力[17]。弓背青鳉与日本青鳉(Oryzias latipes)发育非常相似,胚胎呈透明状,且每个发育阶段均有其明显特征,在出膜前各器官已发育完全。对弓背青鳉的资源普查方面已有报道[18],廖健等[19]以弓背青鳉作为模型,探究了鱼类对壬基酚等环境内分泌干扰物的响应。
本研究克隆弓背青鳉3种ocuer亚型,并对其介导雌激素调控机制和参与机体功能进行初步探究,旨在进一步为雌激素作用机理及对生物体调节功能的研究提供基础理论资料。
1 材料与方法
1.1 实验用鱼培育、水体暴露与材料采集
实验用弓背青鳉 F3代为本实验室所繁育,亲本采自广东省湛江市高桥红树林保护区。成鱼饲养于循环水养殖系统,养殖温度条件为:(26 ± 2)℃,昼夜光照比为14 h∶10 h。
取性成熟雄、雌弓背青鳉各6尾,分别解剖取眼、肌肉、脑、肝脏、性腺和鳃组织,液氮速冻,用于RNA提取。
收集亲本弓背青鳉所产的已受精鱼卵,胚胎发育温度条件为(26 ± 2) ℃,昼夜光照比为14 h∶10 h,过程中每日更换水。弓背青鳉的胚胎发育分期参考日本青鳉胚胎发育分期划分[20],选取胚胎发育的10个阶段:1细胞期、卵裂期、囊胚期、原肠胚期、16肌节期、发眼期、脊索空泡化完成期、心包腔完成期、脾发育期、孵化期。每阶段设置3组平行,16~20枚胚胎作为一个取样组,用于RNA提取。
将 β-雌二醇(E2)(Macklin)溶于无水乙醇中,母液浓度为 10 mg/mL,4 ℃下保存备用。取同批次出膜时间小于6 h的弓背青鳉健康仔鱼576尾,进行 E2暴露实验。实验分为:溶剂对照组(VAbsoluteethanol∶Vwater=1∶5 000)和 E2暴露组(2 μg/L、20 μg/L、200 μg/L)。每个浓度组设3个平行,每平行组 48尾仔鱼,整个暴露实验过程不饲喂仔鱼,暴露24 h后将各组存活仔鱼提取RNA。
1.2 RNA提取和基因克隆
用Trizol(Invitrogen) 法提取胚胎、仔鱼及成鱼各组织总 RNA,并检测其浓度和完整性。用PrimeScriptRT reagent Kit with gDNA Eraser(Takara)合成第一链cDNA,所得cDNA模板于-20 ℃保存备用。
参考本实验室已有的弓背青鳉肝脏转录组中ocuer序列进行引物设计(表1)。以肝cDNA为模板扩增ocuer基因片段,产物电泳检测合格后纯化连接到 pMD18-T(Takara)载体,转化大肠杆菌感受态细胞(DH5α),取阳性克隆送上海生工生物工程技术服务有限公司测序。
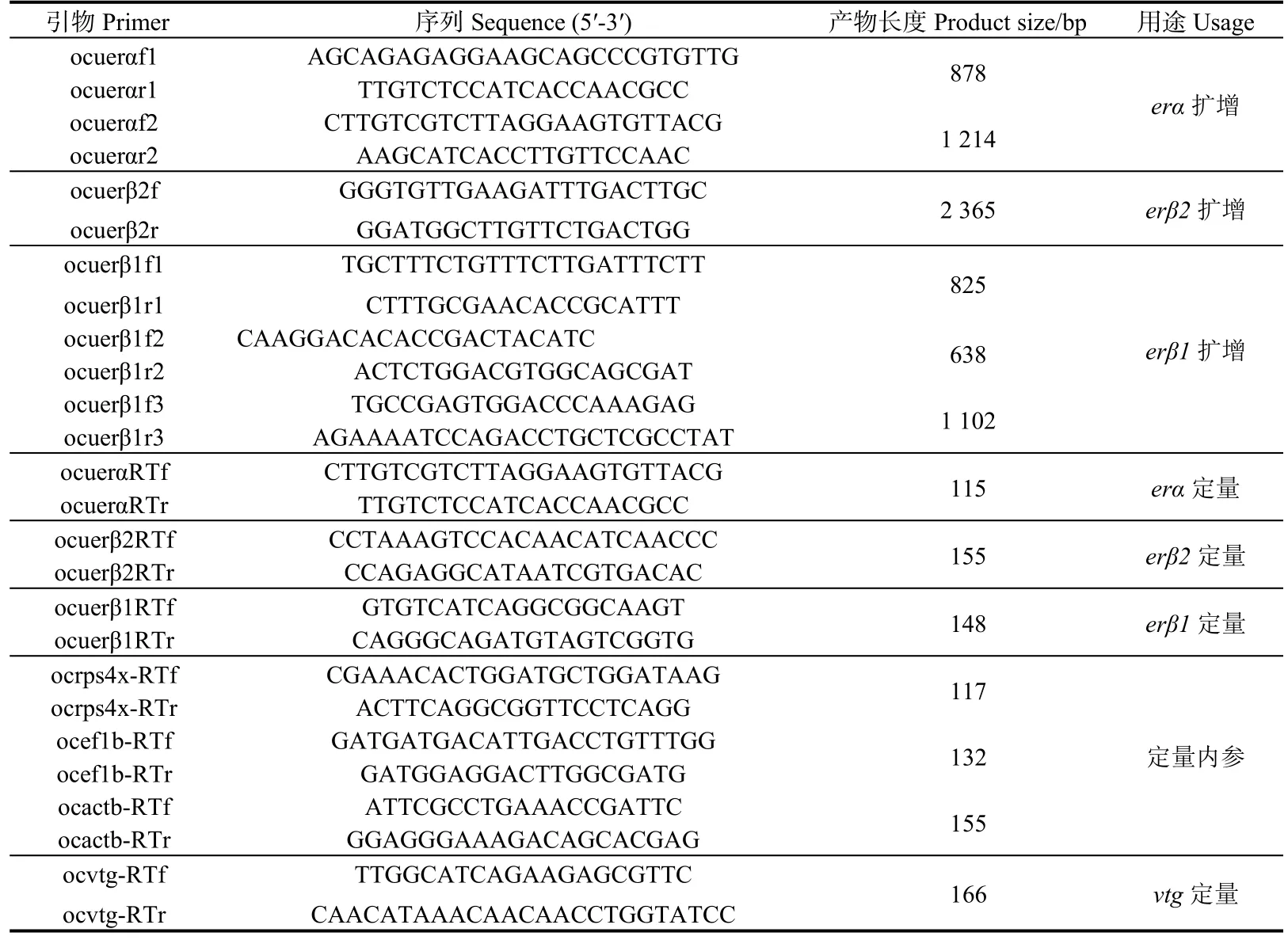
表1 引物序列Table 1 Primer sequences
1.3 生物信息学分析
检查峰型图确定测序质量合格,去接头并于MEGA7.0拼接,经 BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)确定序列准确后,Clustal W进行氨基酸比对。进一步采用邻位连接法(Neighbor-Joining, NJ)构建系统进化树,各节点置信度采用bootst重抽样1 000次获得。
1.4 实时荧光定量PCR
根据克隆测序结果设计荧光定量PCR引物(表1),检测ocuer3种亚型在不同组织与不同胚胎发育时期的表达量,雌二醇暴露后各浓度组ocuer3种亚型表达量和ocuvtg表达量。内参基因选择参考Dong等[21]方法。定量 PCR仪为 LightCycler® 96 PCR system (Roche, Basel, Switzerland),反应程序为94 ℃预变性 3 min;94 ℃,5 s;60 ℃,退火 5 s;72 ℃,延伸10 s,循环数为 40。根据结果显示的Ct值,用 2-ΔΔCt计算出ocuer的相对表达量。利用SPSS17.0进行单因素方差分析统计显著性。
2 结果与分析
2.1 弓背青鳉雌激素受体基因的克隆及序列分析
本研究克隆得到弓背青鳉的3个雌激素受体亚型基因(图1-3),分别为ocuerα、ocuerβ1、ocuerβ2。3个基因的编码区序列长分别为1 971、2 006、2 365 bp,最长开放阅读框(ORF)序列分别为1 860、1 689、2 007 bp,编码的氨基酸个数相应为619、562和688,预测蛋白分子质量分别为67 715.32、62 321.47、73 342.92 u。
ocuErα/Erβ1/Erβ2 蛋白序列有 6 个基本功能域(图4),分别为A/B区(转录激活区)、C区(DNA结合区,DBD)、D区(铰链区)、E区(配体结合区,LBD)和F区。弓背青鳉3种受体的A/B区中均含MAPK激酶磷酸化位点(AF-1);C区长度也较一致,均含有8个半胱氨酸残基构成的2个锌指结 构 Znf1(Cys-X2-Cys-X13-Cys-X2-Cys)和Znf2(Cys-X4-Cys-X9-Cys-X2-Cys);D区含有核受体家族所保守的P-box(EGCKA)和D-box(PATNQ/A);E区含有转录激活区AF-2(DLLLEMLDA)。
2.2 弓背青鳉雌激素受体编码氨基酸系统进化分析
系统进化树显示 ERβ亚型聚为一类(图5),ocuErα亚型与哺乳类、鸟类和两栖类ER聚为一类;斑马鱼(Danio rario)Erγ亚型分为一支。无论是哪种亚型,弓背青鳉雌激素受体与日本青鳉和海水青鳉(Oryzias melastigma)的具有最高亲缘性,与底鳉(Fundulus heteroclitus)、食蚊鱼(Gambusia affinis)、尼罗罗非鱼(Oreochromis niloticus)和波纹绒须石首鱼(Micropogonias undulatus)的有较高亲缘性。

图1 弓背青鳉erα的cDNA序列及预测氨基酸序列Fig.1 cDNA sequences and deduced amino acid sequences in erα genes in Oryzias curvinotus

图2 弓背青鳉erβ1的cDNA序列及预测氨基酸序列Fig.2 cDNA sequences and deduced amino acid sequences in erβ1 genes in Oryzias curvinotus

图3 弓背青鳉erβ2的cDNA序列及预测氨基酸序列Fig.3 cDNA sequences and deduced amino acid sequences in erβ2 genes in Oryzias curvinotus

图4 弓背青鳉3种雌激素受体氨基酸序列与不同物种雌激素受体序列比较Fig.4 Amino acid sequences of three ocuEr aligement with ER sequences of other species

续图4(Continued)
2.3 弓背青鳉雌激素受体基因表达特性分析
图6表明,ocuerα在弓背青鳉雌性的肝脏中表达量最高,但在雄性肝脏中表达量较低,雌、雄肝脏间有显著性差异(P<0.05);其次在精巢和卵巢中有较高表达,在雌、雄的眼、肌肉、脑、鳃等其他组织中也有表达,但在眼、肌肉和鳃中表达量相对较低,且各组织间差异不显著(P>0.05)。ocuerβ1在卵巢、雄性肝脏中表达量相对较高且具有性别差异,在其他组织中也有表达,在眼、脑和雄鳃中表达量较低。ocuerβ2在青鳉的肝脏、精巢和卵巢中高表达,且肝脏中的表达量显著高于性腺(P<0.05),且肝脏的表达量具有雌雄差异,其他组织中的表达量相对较低,且各组织间差异不显著(P>0.05)。

图5 弓背青鳉与其他物种的ER氨基酸序列系统进化树Fig.5 Phylogenetic analysis of ER amino acid sequence with some other species by neighbor-joining

图6 荧光定量PCR检测弓背青鳉组织中erα、erβ1和erβ2表达量Fig.6 The expression of ocuer in various tissues of adult Oryzias curvinotus by RT-qPCR
从图7可以看出,ocuerα在胚胎发育早期(1细胞期、卵裂期和囊胚期)表达量较低,原肠胚开始表达量逐渐升高,在脾发育期达到最高(P<0.05),在器官发育阶段维持一个相对较高的表达水平。在早期胚胎发育阶段,ocuerβ1保持较高表达水平,在原肠胚阶段出现峰值(P<0.05),随后表达水平降低,在后期器官发育阶段缓慢上升。ocuerβ2在 1细胞期和卵裂期维持在一个较高水平,随后表达量逐渐下降,从脊索空泡化完成后,表达量逐渐上升,且保持一个较高表达水平至孵化。

图7 荧光定量PCR检测弓背青鳉胚胎发育各时期中erα、erβ1和erβ2表达量Fig.7 The expression of ocuer in embryonic development stage of Oryzias curvinotus by RT- qPCR
2.4 E2暴露下弓背青鳉仔鱼雌激素受体基因的表达特性

图8 荧光定量PCR检测不同浓度的雌激素E2暴露后基因表达量Fig.8 The expression of relative gene in larva of Oryzias curvinotus by RT- qPCR
对刚出膜的弓背青鳉仔鱼进行不同浓度的 E2暴露处理,结果如图8显示。相对于对照组,经过不同浓度下的E2暴露处理,ocuerα在20 μg/L组中显著上调6.7倍(P<0.001),且呈现出低浓度强诱导,高浓度较弱诱导的表达上调趋势;ocuerβ1仅在20 μg/L 组中显著上调(P<0.05);ocuerβ2表达受到抑制,在高浓度组中表达量显著下调(P<0.01);雌激素效应分子标记物ocuvtg表达量也呈上调趋势,应答模式为中低浓度强上调,高浓度受到较弱的诱导表达。
3 讨论
3.1 弓背青鳉雌激素受体序列分析
本研究克隆弓背青鳉 3种雌激素受体基因(ocuerα/erβ1/erβ2),3 种亚型分别与各自的 ER 亚型聚为一类,提示雌激素受体基因在物种进化上具有较高的保守性。序列分析显示,弓背青鳉雌激素受体与日本青鳉、海水青鳉、斑马鱼、智人(Homo sapiens)及小鼠氨基酸序列相似,属于典型的核受体超家族的一员。在ocuEr氨基酸序列的A/B区中,同时含有潜在的MAPK磷酸化位点,但序列比对显示差异性较大,在转录激活功能上,三种亚型可能具有较大差异[22]。C区含有P-box和D-box,E区含有依赖配体的转录激活区域AF-2,且氨基酸序列高度相似,这与以往文献报道结果符合[23]。F区比对显示差异性较大,可能在促进 ERα/Sp1激活过程[24],控制基因转录大小[25],与E区相互作用抑制受体二聚化[26]上有较大差异性。
3.2 弓背青鳉雌激素受体组织表达特征
组织分布显示,弓背青鳉雌激素受体在眼、肌肉、脑、肝脏、性腺和鳃均有不同程度的表达,与以往研究类似(表2)。各亚型在不同性别或不同组织间表达丰度不同,表明其在不同组织可能参与不同的生理功能。在斑马鱼肝脏中,依赖于E2的卵黄生成素基因的转录调控可能与Erα和Erβ2的协同作用有关[30]。ER受体与E2结合,诱导肝脏合成卵黄蛋白原[39],合成的卵黄蛋白原被释放到血液中,转运到发育中的卵母细胞。在大菱鲆卵黄蛋白基因的转录调控中,erα起重要作用,因为外源的E2暴露可上调肝erα的表达,但erα并不是唯一调节卵黄蛋白基因表达的er亚型;erβ亚型的介导也被认为是E2促进卵黄蛋白合成的重要因素[9]。基于金鱼研究,Nelson等[40]提出这3种ER在肝脏的功能假设:17β-雌二醇诱导卵黄原蛋白在包括金鱼在内的卵生动物肝脏中产生,erα上调是由雌二醇通过激活erβ亚型而诱导的,这种诱导使雌二醇对肝脏刺激进一步放大,增加肝脏对雌二醇的敏感性;erα的上调能促进细胞生长、生殖发育和卵黄发生,erβ1和erβ2参与维持Erα的正常水平。弓背青鳉3种er亚型在肝脏的表达特征,推测3种亚型在肝脏中可能共同行使着介导合成卵黄蛋白原功能,这为Nelson的假说添加佐证。

表2 不同物种的雌激素受体组织分布特征Table 2 The tissue distribution of er genes in different species
除在肝脏中参与卵黄蛋白合成外,在鱼类中ER有着介导卵母细胞生长和成熟相关信号通路的功能[37,41]。日本青鳉卵母细胞生长过程中卵泡颗粒细胞erα表达水平较高[10]。大菱鲆卵巢中er3种亚型均表现出高表达水平,以调节卵泡卵黄发生成熟[9]。弓背青鳉3种亚型在卵巢的高表达情况符合前人报道,然而ocuerα和ocuerβ2在精巢中也表现出较高表达。以往认为雌激素是雌性特有的内源性激素,然而越来越多的研究揭示雌激素在雄性动物的生长发育与性成熟中起重要调节作用[42]。在哺乳类中,雌激素对雄性小鼠的肝脏再生和器官对胰岛素敏感性有正向调节作用[43-45];通过让介导雌激素转导的Er突变,突变小鼠表现出更低的攻击行为[46],雄性突变体由于睾丸体细胞和外生导管系统的雌激素作用中断而不育,影响雄性生殖能力[47]。
在鱼类中,已有多个研究发现至少有1种雌激素受体存在精巢中[45,48],并有相对较高的表达[10,28,35,49]。Senarat等发现在短体羽鳃鲐(Rastrelliger brachysoma)的精巢和精子发生中存在Gnrh、Gths和 Erα[50]。对虹鳟精子研究发现,er介导雌激素调控与早期精子发生、成熟和排出[51]。弓背青鳉er在精巢的表达特征与众多的研究相似,提示在精子发生、成熟等方面,可能er起着重要介导作用,并且这种现象在脊椎动物中具有较高保守性[52]。
3.3 弓背青鳉胚胎发育雌激素受体的表达特征
雌激素通过雌激素受体的介导,参与胚胎的生长调控。弓背青鳉胚胎中,er不同发育时期表达量结果显示,ocuerα早期表达量较低,经囊胚发育后随着细胞数目增多、各部位器官发育表达量逐渐上升,这与李丹丹等[53]报道的小鼠胚胎发育中,erα表达特征相似。推测弓背青鳉胚胎发育的早期是先由母源mRNAs和蛋白质调控,随着卵裂进行,细胞数目增多,需要新的合子型 RNA和蛋白质调控后续的发育过程,但合子型基因需要时间激活,所以囊胚后才检测到erα表达。对斑马鱼胚胎发育研究发现[29],3种亚型在胚胎发育的早期有强烈表达变化,erα和erβ1随着胚胎发育表达量逐渐上升;erβ2表现为早期高表达,随后显著降低,后期又逐渐上升。斑马鱼胚胎在24 hpf前,erα无明显表达;erβ1和erβ2由于从母源继承,表达量高,随后被消耗或降解表达量下降;48 hpf时,erβ1表达量高于erβ2[54]。Feist等人[55]测量了虹鳟胚胎中包括雌激素在内的类固醇浓度,发现在整个孵化周期中类固醇浓度呈双峰型,随着母源的类固醇消耗,类固醇浓度在发育的早期逐渐下降;随后在孵化前浓度增加。ocuerβ亚型在胚胎发育中显示出前期高水平,随后表达降低,而后水平逐渐升高,这可能是ocuerβ亚型在胚胎发育中,起着与其他物种类似功能,且表达量变化可能与雌激素水平有关。
3.4 E2暴露对弓背青鳉仔鱼雌激素受体的表达影响
卵黄蛋白(Vitellogenin,vtg)是卵黄的前体蛋白,通常存在于雌性动物的血液中,常被用作脊椎动物中环境雌激素暴露的生物标记物[56]。鱼类er对于雌激素的响应,不同的er亚型具有不同的表达特征,这取决于物种、组织、性别、繁殖状态和发育阶段[22,57-59]。Marlatt等[60]对虹鳟研究发现,对刚孵化的仔鱼进行1 μg/L的E2暴露,相对于对照组,erβ1和erβ2表达量均下降。也有研究报道[61],在外源 E2作用下,erα和vtg水平同时升高,但erβ亚型则呈现减少或没有变化。弓背青鳉仔鱼er在E2暴露后表现出不同的变化情况,可能如 Nelson等[62]所推测,各亚型雌激素受体组成调控整体,彼此之间相互调节,使其在介导雌激素转导和调控机体生长发育中能发挥充分的作用。
4 结语
本研究克隆出弓背青鳉3种亚型er序列,定量结果表明3种er亚型主要在成鱼的肝脏和雌雄性腺表达,且ocuerα和ocuerβ1存在肝脏的表达呈性别二态性,支持er在两性生殖中的重要性和雌雄分化。在仔鱼早期发育阶段E2暴露会抑制ocuerβ1、ocuerβ2表达,揭示ocuerβ亚型的表达在介导鱼类对E2敏感性中具有重要作用。此外,弓背青鳉雌激素受体间调节功能尚需通过基因定位、过表达和敲除等技术进一步研究。

