microRNA-31通过靶向调控Dock1抑制乳腺癌的上皮-间质转化①
曾国栋 陈智凯 林祥博 尹崇高 李洪利
(山东省潍坊医学院生物科学与技术学院,潍坊261053)
乳腺癌是女性最常见的恶性肿瘤,近年的发病率逐年上升,严重危害全球女性生命健康[1]。原位乳腺癌并不致命,90%以上患者死亡的主要原因是癌细胞的侵袭与转移[2]。近年来,临床上对于乳腺癌的治疗已有很大的进展,但乳腺癌的发病率及死亡率仍呈现不断上升的趋势[3]。因此,研究乳腺癌侵袭与转移相关的分子机制可以为治疗乳腺癌提供新的依据。microRNA(miRNA)是一种内源性非编码单链RNA,长度约为22 个核苷酸[4,5]。它不编码蛋白质,却可以通过与目标 mRNA 的互补结合,下调靶基因的表达或翻译,从而调控细胞的增殖、凋亡、侵袭、转移等行为[6,7]。研究发现miR-31在多种恶性肿瘤的侵袭转移中起重要作用,包括肝癌、肺癌、胃癌、神经性胶质瘤、前列腺癌、乳腺癌等,且多数肿瘤的侵袭和转移与上皮-间质转化(Epithelial-mesenchymal transition,EMT)有关[8-13]。本课题组前期研究发现miR-31可以靶向调控Dock1,通过此机制抑制神经性胶质瘤的侵袭转移[14],但是其能否在乳腺癌中起相同作用尚未见报道,因此本文通过对乳腺癌中miR-31及Dock1的研究,为乳腺癌的临床治疗及预防其侵袭和转移提供新的靶点和途径。
1 材料与方法
1.1材料 胎牛血清、RPMI1640购自美国Hyclone公司,Lipofectamine 2000 转染试剂购自美国Invitrogen公司,反转录试剂盒Prime Script®RT reagent Kit和SYBR®Prime Script®miRNA RT-PCR Kit 购自大连TaKaRa公司,Transwell小室购于Corning公司,Matrigel购于BD公司,抗体试剂均购于Abcam公司。
1.2方法
1.2.1细胞培养 人正常上皮乳腺细胞MCF-10A培养于含血清、氢化可的松(Hydrocortisone)、霍乱毒素(Cholera toxin)、胰岛素(Insulin)、表皮生长因子(EGF)的DMEM/F12培养基中,乳腺癌细胞MDA-MB-231培养在含10%胎牛血清的RPMI1640培养基中,MCF-7细胞使用MEM培养基加10%胎牛血清培养。所有细胞均置于37℃、5%CO2的环境中培养。
1.2.2逆转录及荧光定量PCR(Quantitative Real-time PCR,qRT-PCR) 茎环法 逆转录及qRT-PCR具体实验步骤见本课题组先前实验结果[15]。 PCR条件为95℃ 5 s、63℃ 30 s、72℃ 30 s进行35个循环,采用 U6作为内参。 miR-31上游引物:GCGAGGCAAGATGCTGGC,下游引物:AGTGCAGGGTCCGAGGTATT,茎环序列:GTCGTATCCAGTGCAG-GGTCCGAGGTATTCGCACTGGATACGACAGCTAT。
1.2.3Western blot 实验过程见本课题组先前实验过程[16],所用抗体浓度如下:β-actin(1∶1 000)、Dock1(1∶1 000)、E-cadherin(1∶500)、Vimentin(1∶1 000)。 β-actin作为内参。
1.2.4Transwell侵袭实验 将转染后的150 μl(4×105cells/ml)细胞悬液添加到Transwell小室上层中,下层加入20%胎牛血清的培养基500 μl,置于细胞培养箱中培养,24 h后4%多聚甲醛固定20 min,使用Giemsa染色35 min,PBS清洗3次,于显微镜下随机选取10个视野拍照计数,取平均值为实验的最终结果。所有实验均重复3次。
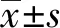
2 结果
2.1miR-31及Dock1在人正常乳腺上皮细胞与乳腺癌细胞中的表达情况 qRT-PCR、Western blot分别检测人正常乳腺上皮细胞MCF-10A、乳腺癌细胞MDA-MB-231和MCF-7中miR-31、Dock1的表达情况。结果显示,miR-31在MCF-7细胞中的表达水平高于MDA-MB-231细胞,但都明显低于正常肺上皮细胞MCF-10A细胞中的表达水平;MDA-MB-231细胞中Dock1的表达水平高于MCF-7细胞,Dock1在MCF-10A细胞中表达水平最低(见图1)。结果提示,miR-31在乳腺癌中为抑癌基因,Dock1为癌基因。
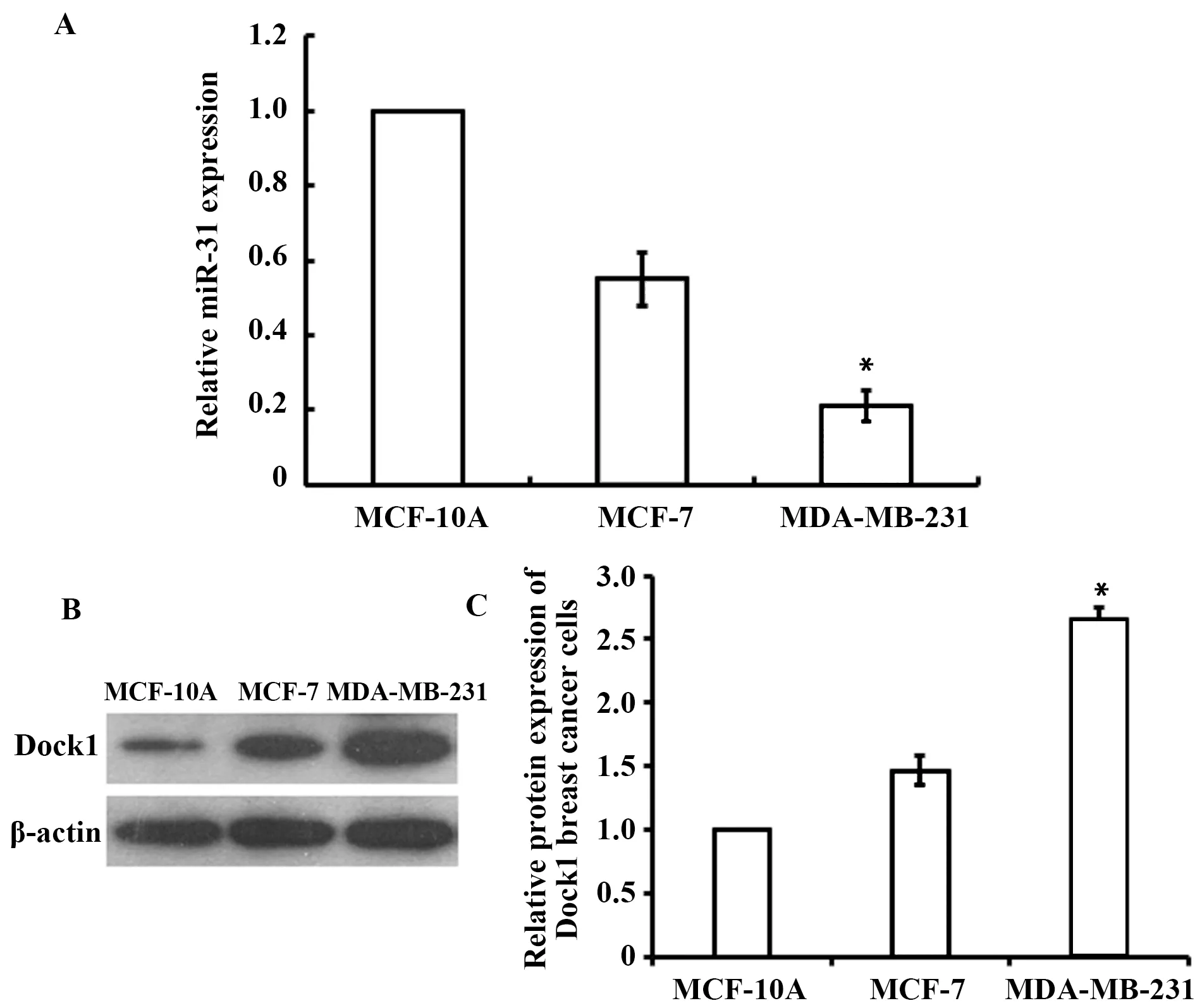
图1 miR-31及Dock1在人正常乳腺上皮细胞与乳腺癌细胞中的表达Fig.1 Expression of miR-31 and Dock1 in human normal mammary epithelial cells and breast cancer cellsNote: A.Expression level of miR-31 in the cells of each group ;B.Expression level of Dock1 in the cells of each group;C.Gray value of B diagram;*.P<0.05.
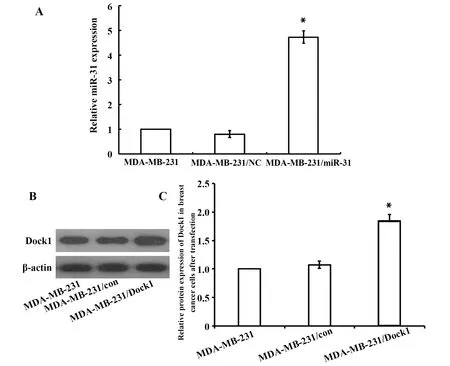
图2 MDA-MB-231细胞miR-31及Dock1的转染效率Fig.2 Transfection efficiency of miR-31 and Dock1 in MDA-MB-231 cellsNote: A.Transfection efficiency of miR-31 in MDA-MB-231 cells;B.Transfection efficiency of Dock1 in MDA-MB-231 cells;C.Gray value of B diagram;*.P<0.05.
2.2转染后miR-31和Dock1在各组乳腺癌细胞中的表达情况 qRT-PCR、Western blot检测转染不同质粒后各组乳腺癌细胞中miR-31、Dock1的表达情况,结果显示,MDA-MB-231细胞在转染对照质粒后miR-31的表达水平与正常组相比无明显差距,但在转染过表达质粒后miR-31的表达水平明显升高。Western blot检测转染后各组乳腺癌细胞中Dock1的表达情况,MDA-MB-231对照组与正常组比较Dock1表达水平几乎无差距,转染敲除质粒后Dock1的表达水平明显下调(见图2)。结果提示转染成功。
2.3转染后各组乳腺癌细胞中Dock1蛋白的表达变化 为了检测转染过后各组细胞中Dock1蛋白的表达变化情况而采用Western blot实验。结果显示MDA-MB-231/miR-31细胞相比于MDA-MB-231/NC细胞中Dock1的表达水平明显下调(见图3),结果提示,miR-31可以负向调控Dock1蛋白的表达。

图3 转染后各组乳腺癌细胞中Dock1蛋白的表达变化Fig.3 Expression of Dock1 protein in breast cancer cells after transfectionNote: A.Expression of Dock1 protein in breast cancer cells after transfection;B.Gray value of A diagram;*.P<0.05.

图4 miR-31靶向调控Dock1对乳腺癌细胞侵袭转移的影响Fig.4 Effect of miR-31 targeting Dock1 on invasion and metastasis of breast cancer cellsNote: A.Changes in cell invasion and metastasis of cells in each group;B.Counting the cells of each cell group in the A diagram;*.P<0.05.

图5 miR-31靶向调控Dock1对乳腺癌EMT的影响Fig.5 Effect of miR-31 targeting Dock1 on EMT in breast cancerNote: A.Changes of EMT markers in the each group cells;B.Gray value of A diagram;*.P<0.05.
2.4miR-31靶向调控Dock1对乳腺癌细胞侵袭转移的影响 为了验证miR-31靶向调控Dock1在乳腺癌中的具体作用,利用Transwell侵袭实验检测miR-31对乳腺癌细胞侵袭能力的影响。结果显示MDA-MB-231/miR-31组相比于MDA-MB-231/NC组穿过基底膜的细胞数明显减少,而与MDA-MB-231/miR-31+con组相比无明显差距;MDA-MB-231/miR-31+Dock1组与MDA-MB-231/miR-31+con组相比穿过基底膜的细胞数明显增多(见图4),差异具有统计学意义。结果提示,miR-31可以通过调控Dock1表达来抑制乳腺癌的侵袭转移。
2.5miR-31靶向调控Dock1对乳腺癌EMT的影响 用Western blot检测EMT标志分子的表达变化来验证miR-31和Dock1与乳腺癌EMT的联系。结果显示,MDA-MB-231/NC细胞与MDA-MB-231细胞E-cadherin、Vimentin表达水平相比无明显变化,MDA-MB-231/miR-31和MDA-MB-231/miR-31+con细胞相比于MDA-MB-231/NC细胞中E-cadherin表达水平显著上调,在MDA-MB-231/miR-31+Dock1细胞中E-cadherin的表达水平与对照组相比无统计学意义;与MDA-MB-231/NC细胞相比,MDA-MB-231/miR-31和MDA-MB-231/miR-31+con细胞中Vimentin表达水平明显下调,MDA-MB-231/miR-31+Dock1细胞中Vimentin的表达水平几乎无变化(见图5)。结果提示,miR-31通过靶向调控Dock1蛋白的表达,进而调节乳腺癌EMT的发生。
3 讨论
乳腺癌细胞常在特定生理或病理状态下发生EMT,即丧失正常上皮细胞的特性,获得间质细胞的形态及迁移运动能力[17],黏附性降低的癌细胞可以浸润转移至其他组织或随血液播散至全身,形成转移,危及生命。EMT的标志物有很多,如E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)等,E-cadherin是上皮组织中的一类依赖Ca2+的细胞间黏附分子,可以维持细胞间黏附性和极性,Vimentin是间质细胞标志分子,E-cadherin表达下调、Vimentin的表达异常上调是EMT发生的重要特征[18]。 众多研究发现miR-31可协调抑制多种靶基因,从而调控恶性肿瘤的侵袭转移及EMT的发生[19]。Gao等[20]研究发现miR-31通过负向调控LATS2可以调节食管癌的EMT;Cottonham等[21]发现,miR-31通过聚集TIAM1来调节结肠癌侵袭和转移。本实验结果显示miR-31在乳腺癌细胞中表达相对较低,改变乳腺癌细胞中miR-31的表达会影响乳腺癌的侵袭能力及EMT的发生。本课题组前期研究发现miR-31通过靶向调控Dock1对胶质瘤EMT的发生起抑制作用,提示miR-31可能通过调控Dock1来发挥作用。
Dock1(Dedicator of cytokinesis 1)属于Dock 家族蛋白之一,亦是整合素信号通路的重要组分[22]。Wang等[23]发现Dock1的蛋白结构域DHR2 (Dock homology regions 2)与Crk蛋白结合,可激活Rac1并发挥促进细胞迁移等作用。此外,Dock1还在乳腺癌、肺癌等诸多恶性肿瘤中发挥重要作用[24,25],本研究采用Western blot检测转染后的乳腺癌细胞中Dock1表达水平的变化,证实miR-31参与调节Dock1的表达。
综上所述,本研究证实miR-31可以调控Dock1的表达来抑制乳腺癌细胞EMT的发生,进而抑制乳腺癌的侵袭与转移,这一发现将为乳腺癌的治疗提供新的思路与途径。但miR-31是否会结合其他靶基因共同调控乳腺癌的侵袭与转移目前尚不清楚,需要我们进行更加深入的研究。

