Tim-3/Galectin-9在原发性肝癌中的表达变化及临床意义探讨
兰勇 陈明 邢人伟


[摘要] 目的 探讨T细胞免疫球蛋白粘蛋白-3(T cell immunoglobulin mucin-3,Tim-3)/半乳糖凝集素-9(Galectin-9)在原发性肝癌(primary liver cancer,PLC)中的表达变化及临床意义。 方法 回顾性分析2014年6月~2016年6月收治的110例接受根治性切除术的PLC患者的临床资料。检测并对比肝癌组织及癌旁组织中Tim-3、Galectin-9表达情况,统计Tim-3、Galectin-9不同表达情况时患者病理参数、随访1年内复发和死亡情况。 结果 肝癌组织中Tim-3阳性表达率显著高于癌旁组织(P<0.05),肝癌组织中Galectin-9阳性表达率显著低于癌旁组织(P<0.05);Tim-3、Galectin-9阳性组与阴性组性别、年龄、肝硬化、血清甲胎蛋白(alpha-fetoprotein,AFP)、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、病理分型、TNM分期患者构成比比较差异不显著(P>0.05),Tim-3阳性组肿瘤直径≥5 cm、多發病灶、血管侵犯、无肿瘤包膜患者构成比显著高于阴性组(P<0.05),Galectin-9阳性组肿瘤直径≥5 cm、多发病灶、血管侵犯、无肿瘤包膜患者构成比显著低于阴性组(P<0.05);术后1年内复发和死亡患者中Tim-3阳性表达率显著高于未复发和存活患者(P<0.05);复发和死亡患者中Galectin-9表达率显著低于未复发和存活患者(P<0.05)。 结论 Tim-3的高表达、Galectin-9低表达与PLC多种病理学特征有关,且复发与未复发、死亡与存活患者中Tim-3、Galectin-9蛋白表达存在差异,可能成为临床中评估PLC患者预后的重要指标之一。
[关键词] T细胞免疫球蛋白粘蛋白-3;半乳糖凝集素-9;原发性肝癌;复发;死亡
[中图分类号] R735.7 [文献标识码] B [文章编号] 1673-9701(2019)04-0049-05
[Abstract] Objective To investigate the expression changes and clinical significance of T cell immunoglobulin mucin-3(Tim-3)/Galectin-9 in primary liver cancer(PLC). Methods The clinical data of 110 PLC patients who underwent radical resection from June 2014 to June 2016 were retrospectively analyzed. The expressions of Tim-3 and Galectin-9 in liver cancer tissues and adjacent tissues were detected and compared. The pathological parameters, the recurrence and death within 1 year of follow-up of patients with different expressions of Tim-3 and Galectin-9 were analyzed. Results The positive expression rate of Tim-3 in liver cancer tissue was significantly higher than that in adjacent tissues(P<0.05). The positive expression rate of Galectin-9 in liver cancer tissue was significantly lower than that in adjacent tissue(P<0.05). There was no significant difference in gender, age, liver cirrhosis, serum alpha-fetoprotein(AFP), hepatitis B surface antigen(HBsAg), pathological type, and the composition ratios of TNM staging in Tim-3 and Galectin- 9 positive and negative groups(P>0.05). The composition ratio of tumor diameter ≥5 cm, multiple lesions, vascular invasion, no tumor capsules in Tim-3 positive group was significantly higher than that in the negative group(P<0.05). The composition ratio of tumor diameter ≥5 cm, multiple lesions, vascular invasion, and tumor-free capsule was significantly lower than that of the negative group(P<0.05). The positive rate of Tim-3 expression in patients with recurrence and death within 1 year after surgery was significantly higher than that in patients without recurrence and survival(P<0.05). The expression rate of Galectin-9 was significantly lower in patients with relapse and death than that in patients without recurrence and survival(P<0.05). Conclusion The high expression of Tim-3 and the low expression of Galectin-9 are related to various pathological features of PLC, and there are differences in the expression of Tim-3 and Galectin-9 in patients with recurrence and non-recurrence, and in death and survival patients. They may become one of the important indicators for evaluating the prognosis of PLC patients.
[Key words] T cell immunoglobulin mucin-3; Galectin-9; Primary liver cancer; Recurrence; Death
原发性肝癌(primary liver cancer,PLC)是我国最常见的恶性肿瘤之一,发病率和死亡率均较高[1]。由于早期无症状或症状不明显,确诊时多数患者已至局部晚期或远端转移,治疗难度增加且预后差,术后1年复发率超过30%,而术后5年生存率不足10%,给人们的健康和生命造成严重威胁[2]。随着分子生物学研究逐渐深入,人们发现机体免疫系统失衡在肿瘤进展过程中起重要作用。T细胞免疫球蛋白粘蛋白-3(T cell immunoglobulin mucin-3,Tim-3)是一种优势表达于Ⅰ型辅助性T淋巴细胞(type Ⅰ helper T lymphocyte,Th1)表面的特异性表面标志物,通过Tim-3/半乳糖凝集素-9(Galectin-9)信號通路调节Th1/Th2免疫平衡,进而参与肿瘤进展[3-4]。但Tim-3、Galectin-9在PLC中的表达及其对预后的影响鲜有报道。鉴于此,本研究回顾性分析我院收治的PLC患者的临床资料,通过分析Tim-3、Galectin-9在癌组织及癌旁组织中的表达情况,并分析其与临床病理特征及预后的关系,探讨其临床意义。
1 资料与方法
1.1一般资料
回顾性分析2014年6月~2016年6月收治的110例接受根治性切除术的PLC患者的临床资料,其中男72例,女38例,年龄38~72岁,平均(51.35±6.80)岁,肝硬化91例,乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)阳性98例,肿瘤直径<5 cm者73例、≥5 cm者37例,病理分型[5]:肝细胞癌99例、胆管细胞癌9例、混合癌2例,美国癌症联合委员会TNM分期[6]:Ⅰ~Ⅱ期者82例、Ⅲ~Ⅳ期者28例,单发病灶76例、多发病灶34例。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)病理学确诊为PLC;(2)行根治性切除术,术后组合考虑接受辅助放化疗;(3)随访时间≥1年者;(4)临床资料完整者。
1.2.2 排除标准 (1)合并其他原发性肿瘤者;(2)严重贫血、感染或合并严重凝血功能障碍及心血管疾病者;(3)妊娠期或哺乳期妇女。
1.3 方法
1.3.1 资料收集 统计患者就诊时间、性别、年龄、术前血清甲胎蛋白(alpha-fetoprotein,AFP)水平、HBsAg、病理类型及TNM分期、肿瘤直径、病灶是否单发、是否肝硬化、肿瘤是否有包膜覆盖、是否发生血管侵犯等基本资料。统计患者术后1年内复发或死亡情况。复发诊断:经穿刺活检证实术后复发情况。
1.3.2 Tim-3、Galectin-9阳性表达检测 应用免疫组织化学法检测肝癌组织及癌旁组织中Tim-3、Galectin-9表达情况。A切片:取肝癌组织及癌旁组织常规制作石蜡切片,切片机制作4 μm连续切片;B脱蜡及水化:切片经二甲苯脱蜡后,依次放入二甲苯Ⅰ 5 min、二甲苯Ⅱ 5 min、二甲苯Ⅲ 5 min,并利用不同浓度梯度酒精(100%→95%→85%→70%→50%)水化;C抗原热修复:将预处理的柠檬酸盐抗原修复液放置于压力锅中,加热至沸腾后将切片放入压力锅中,当压力阀喷气后继续加热2 min停止加热,自然冷却,取出切片用自来水冲洗,并将其浸泡于磷酸盐缓冲液(phosphate buffered saline,PBS)缓冲液中;D染色前处理:用免疫组化专用笔在组织周围画圈标注,再用PBS洗涤3次,每次5 min,玻片自然晾干,加入3%的过氧化氢孵育20 min,PBS洗涤3次,每次5 min;E滴加抗原:每张切片分别加入50 μL一抗(鼠抗人Tim-3、Galectin-9单抗,Thermo公司),尽可能覆盖组织,4 ℃孵育过夜,PBS洗涤3次每次5 min,然后加入二抗(山羊抗鼠Tim-3、Galectin-9 免疫球蛋白G,Thermo公司),室温孵育30 min,PBS洗涤3次,每次5 min;F显色:辣根过氧化物酶显色试剂盒(R&D公司)显色,光镜下观察控制反应时间,显色满意后自来水冲洗,中性树胶封片;G光镜下观察:在200倍光镜下随机选取5个不重复的视野,以细胞呈现黄色或棕黄色判定为阳性细胞,计算阳性细胞率,并进行蛋白表达程度判定[7]:阳性细胞率<10%记为阴性,阳性细胞率≥10%记为阳性。
1.4观察指标
①对比Tim-3、Galectin-9不同部位表达率;②Tim-3、Galectin-9表达与病理参数的关系;③复发与未复发患者Tim-3、Galectin-9表达差异;④死亡与存活患者Tim-3、Galectin-9表达差异。
1.5统计学分析
采用SPSS17.0统计学软件对数据分析处理,计数资料以[n(%)]表示,理论频数≥0且≤5时组间计数资料进行校正检验,理论频数>5组间计数资料进行χ2检验;采用秩和检验分析等级计数资料。P<0.05为差异有统计学意义。
2 结果
2.1 Tim-3、Galectin-9不同部位表达率比较
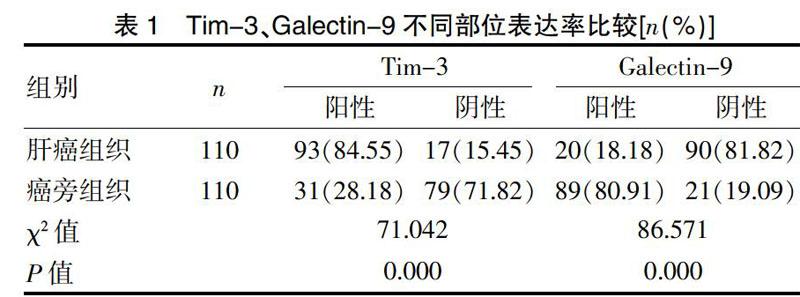
肝癌组织中Tim-3阳性表达率显著高于癌旁组织(P<0.05),肝癌组织中Galectin-9阳性表达率显著低于癌旁组织(P<0.05)。见表1、封三图8。
2.2 Tim-3、Galectin-9表达与病理参数的关系
Tim-3阳性组与阴性组性别、年龄、肝硬化、AFP水平、HBsAg、病理分型、TNM分期患者构成比比较,差异均无统计学意义(P>0.05),Tim-3阳性组肿瘤直径≥5 cm、多发病灶、血管侵犯、无肿瘤包膜患者构成比显著高于阴性组(P<0.05);Galectin-9阳性组与阴性组性别、年龄、肝硬化、AFP水平、HBsAg、TNM分期、病理分型患者构成比比较,差异均无统计学意义(P>0.05),Galectin-9阳性组肿瘤直径≥5 cm、多发病灶、血管侵犯、无肿瘤包膜患者构成比显著低于阴性组(P<0.05)。见表2。
2.3复发与未复发患者Tim-3、Galectin-9表达差异
术后1年内复发患者中Tim-3阳性表达率明显高于未复发患者,差异有统计学意义(P<0.05);复发患者中Galectin-9表达率明显低于未复发患者,差异有统计学意义(P<0.05)。见表3。
2.4 死亡与存活患者Tim-3、Galectin-9表达差异
术后1年内死亡患者中Tim-3阳性表达率明显高于存活患者,差异有统计学意义(P<0.05);死亡患者中Galectin-9表达率明显低于存活患者,差异有统计学意义(P<0.05)。见表4。
3讨论
PLC是一种高发恶性肿瘤,主要包括肝细胞癌、肝内胆管细胞癌及混合性癌等多种病理类型,肝炎病毒感染、家族疾病史、嗜酒及黄曲霉毒素长期暴露等均是导致PLC发病的危险因素[8-9]。随着医疗技术的飞速发展,癌症的治疗取得了较大进步,但PLC患者的预后仍然较差,中位生存期不足1.5年[10]。因此,亟需寻找早期预测复发和转移的标志物,以及时制定并实施有效治疗措施,对改善PLC患者预后、延长生存期有重要意义。
本研究发现,肝癌组织中Tim-3阳性表达率显著高于癌旁组织(P<0.05),肝癌组织中Galectin-9阳性表达率显著低于癌旁组织(P<0.05),提示肝癌组织中Tim-3异常高表达、Galectin-9异常低表达。Tim-3是一种优势表达于CD4+、CD8+细胞表面的一种抑制性分子,可调节Th1细胞免疫功能,且抑制干扰素-γ(interferon-γ,IFN-γ)的生成[11]。高表达的Tim-3可影响肿瘤微环境中的IFN-γ生成及Th1细胞功能,下调免疫系统功能,利于肝癌细胞的免疫逃避[12]。Galectin-9是β-半乳糖苷结合蛋白家族重要成员之一,在T细胞及胸腺细胞的发育、肿瘤细胞的分化、转移方面发挥重要作用[13]。Galectin-9是Tim-3的特异性配体,二者结合可介导T细胞免疫耐受[14]。既往研究发现[15-16],多种肿瘤组织如黑色素瘤、乳腺癌组织中,Galectin-9呈阴性表达,而在正常组织中高表达,与本研究结果一致。由此,PLC患者癌组织中Tim-3异常高表达与Galectin-9的异常低表达,利于肝癌细胞增殖。
此外,本研究中,Tim-3阳性组肿瘤直径≥5 cm、多发病灶、血管侵犯、无肿瘤包膜患者构成比显著高于阴性组(P<0.05),Galectin-9阳性组上述指标显著低于阴性组(P<0.05);术后1年内复发和死亡患者中Tim-3阳性表达率显著高于未复发和存活患者(P<0.05);复发和死亡患者中Galectin-9表达率显著低于未复发和存活患者(P<0.05),提示Tim-3、Galectin-9与PLC多种病理学特征有关,且复发与未复发、死亡与存活患者中Tim-3、Galectin-9蛋白表达存在差异。癌组织中浸润的大部分CD8+ T淋巴细胞表面Tim-3大量表达,但该表型中的T细胞增殖及分泌炎症细胞因子的功能基本丧失,且与肿瘤恶性程度密切相关[17]。Tim-3参与肿瘤浸润及转移与血管形成、肿瘤微环境缺氧、免疫逃逸等多种调节机制,可能是导致不同临床表现患者Tim-3表达差异的原因[18]。既往研究证实,多种肿瘤组织中Galectin-9呈强阳性表达,并与患者预后有关,如在乳腺癌组织中,伴远端转移的Galectin-9阳性患者无复发生存率为95%,显著高于阴性表达者的44%,有淋巴结转移的阳性患者生存率达90%,显著高于阴性表达者的25%[19-20]。癌组织中Galectin-9高表达者有效抑制肿瘤进展,可能是高表达Galectin-9与高表达Tim-3的Th1细胞结合,重新调节Th1/Th2平衡状态,利于肿瘤微环境的免疫监视作用,改善PLC患者的预后[21]。因此,Tim-3、Galectin-9表达情况与PLC患者的多种病理特征有关,并且可影响患者预后。
综上所述,Tim-3的高表达、Galectin-9低表达与PLC多种病理学特征有关,且复发与未复发、死亡与存活患者中Tim-3、Galectin-9蛋白表达存在差异,提示临床中可通过检测此二种蛋白在肝癌组织中的表达评估预后,并可通过积极控制Tim-3、Galectin-9的表达,干扰PLC进展,进而改善预后。
[参考文献]
[1] 张玥,曲春枫,任建松,等. 中国肝癌发病与死亡数据集[J]. 中华肿瘤杂志,2015,35(9):705-720.
[2] Liu W,Liu Q,Huang Q,et al. Time trend analysis of primary liver cancer incidence in Sihui county of Guangdong Province,China(1987-2011)[J]. BMC Cancer,2016, 16(1):796-801.
[3] Kikushige Y,Miyamoto T,Yuda J,et al. A TIM-3/Gal-9 Autocrine Stimulatory Loop Drives Self-Renewal of Human Myeloid Leukemia Stem Cells and Leukemic Progression[J]. Cell Stem Cell,2015,17(3):341-352.
[4] 趙慧,张峰波,庞楠楠,等. Tim-3/Galectin-9与 Th1/Th2相关因子在人细粒棘球蚴感染中的表达研究[J]. 新疆医科大学学报,2016,39(3):312-315.
[5] 李伟道. 原发性肝癌诊断,分型,分期标准的探讨[J]. 中华肝脏病杂志,1997,5(3):129-130.
[6] 吴志全. 原发性肝癌和肝内胆管细胞癌的TNM分期(二)[J]. 中华肝胆外科杂志,2001,7(4):238.
[7] Gilmore HL,Collins LC,Connolly JL,et al. Impact of the new American Society of Clinical Oncology(ASCO)/College of American Pathologists(CAP)guidelines on the determination of breast cancer HER2 status[J]. Lab Invest,2008,88(7):632.
[8] 林子博,祁永芬,周新凤,等. 广东顺德地区原发性肝癌发病危险因素研究[J]. 中华疾病控制杂志,2017,21(10):993-996.
[9] 郑传芬,曾惠,王佳,等. 重庆地区黄曲霉毒素暴露与原发性肝癌关联的病例-对照研究[J]. 中华预防医学杂志,2017,51(6):87-89.
[10] 翁柠娜,李肖. 经肝动脉化疗栓塞术联合干扰素治疗中晚期原发性肝癌疗效的Meta分析[J]. 临床肝胆病杂志,2016,32(1):76-79.
[11] Kang CW,Dutta A,Chang LY,et al. Apoptosis of tumor infiltrating effector TIM-3+CD8+ T cells in colon cancer[J].Sci Rep,2015,5(123):156-159.
[12] 方艳,张朝玉,应小平,等. 山仙颗粒对Lewis肺癌荷瘤小鼠抗肿瘤免疫力及外周血中IFN-γ、TNF-β、IL-10的影响[J]. 中国免疫学杂志,2017,33(10):1487-1492.
[13] 伍婧,招丽蓉,邓伟英,等. 结肠癌患者血清中E-钙粘蛋白和半乳糖凝集素-9的表达水平及临床意义[J]. 實用癌症杂志,2017,32(7):1091-1093.
[14] 庞盼,李明,段亚楠,等. 布鲁氏菌病患者血清中可溶性Tim-3/Galectin-9与相关细胞因子的变化[J]. 免疫学杂志,2017,35(1):54-58.
[15] Liang Y,Chen J,Zhang Y,et al. Expression of galectin-9 mRNA in hepatocellular carcinoma[J]. Int J Clin Exp Pathol,2015,8(11):15100-15105.
[16] Tallerico R,Cristiani CM,Staaf E,et al. IL-15,TIM-3 and NK cells subsets predict responsiveness to anti-CTLA-4 treatment in melanoma patients[J]. Oncoimmunology,2016,6(2):124-128.
[17] Lee KA,Shin KS,Kim GY,et al. Characterization of age-associated exhausted CD8+ T cells defined by increased expression of Tim-3 and PD-1[J]. Aging Cell,2016,15(2):291-300.
[18] 陶景莲,李丽娟,邵宗鸿. TIM3在肿瘤微环境中作用的研究进展[J]. 中国免疫学杂志,2016,32(7):1070-1073.
[19] 董超,徐正丰,邱涵,等. Galectin-9在乳腺癌组织中的表达及其对癌细胞侵袭转移的影响[J]. 山东医药,2016, 56(41):81-83.
[20] 黄福海, 潘丽英, 徐楚燕. 半乳糖凝集素-9在卵巢癌组织中的表达及其临床意义[J]. 安徽医药,2016,20(6):1158-1160.
[21] Langhans B,Nischalke HD,Kr?覿mer B,et al. Increased peripheral CD4+ regulatory T cells persist after successful direct-acting antiviral treatment of chronic hepatitis C[J]. J Hepatol,2017,66(5):888-896.
(收稿日期:2018-07-13)

