DCE-MRI在软组织肿瘤中的应用
张雨 郝大鹏* 陈月芹
人体的软组织由肌肉、肌腱、韧带等组成,其内穿行血管和神经,结构较为复杂。软组织肿瘤起源于间叶组织,肿瘤来源多样,发病率较低,且病种繁多,临床表现不典型,影像诊断正确率一直不高[1]。软组织肿瘤的传统影像检查方法主要采用CT和MRI[2-3]。CT为断面成像,可以避免各种解剖结构的重叠,且具有较高的密度分辨力,但缺点是仅能提供组织的密度信息,对于肿瘤边缘及瘤周水肿的判断能力较弱。MRI可以直接进行任何方位倾斜面成像,可以更好地显示组织结构间的解剖关系。MRI还具有较高的组织分辨力,对肿瘤周围水肿范围及周围结构侵犯的判断方面尤为敏感。增强MRI可以通过观察肿瘤的强化程度来协助诊断,但仅能提供肿瘤的总体血供情况,不能对病变组织进行动态观察。
动态增强 MRI(DCE-MRI)在获得肿瘤形态学信息的同时,还可以动态监测病变的强化方式,获得肿瘤组织的生理性变化情况[2,4]。更为重要的是,可以通过分析DCE-MRI所获得的定量指标来减少诊断医师的主观影响。
1 DCE-MRI技术
1.1 成像原理 DCE-MRI的基本成像方法为静脉注射对比剂后,利用快速T1WI序列对兴趣区(ROI)进行连续快速扫描,获得ROI内所有像素点的时间-信号强度曲线(TIC),通过对TIC曲线的直接分析或运用假定的药代动力学模型进行分析,获得一系列定性或定量参数[5]。
1.2 扫描方法 因软组织肿瘤发生部位多变,对不同部位的病变进行DCE-MRI扫描,所采用的线圈及扫描方法也不完全相同。目前软组织肿瘤的扫描方法主要参考北美放射学会定量影像生物标志协会对DCE-MRI扫描的标准化流程提出的建议:①对比剂注射前获取组织T1mapping参数;②采集T1mapping时,确保每次角度采集时系统增益设置相同;③DCE-MRI的时间分辨率在10 s内;④上肢注射对比剂可能导致动脉输入函数形态改变,建议在肘窝留置静脉留置导管。DCE-MRI扫描序列多选用扫描速度较快的梯度回波序列,如GE公司的3D LAVA序列,西门子公司的3DVIBE序列。DCE-MRI多选用小分子对比剂,如钆双胺(欧乃影)或钆喷酸葡胺(马根维显),并使用高压注射器注射,以保证稳定的注射速度。在注射完成后追注20~40 mL生理盐水冲洗管道。
1.3 图像后处理 在图像后处理时应将ROI放置在肿瘤组织的实性部分,避开水肿和出血坏死区,并以同一层面的正常肌肉组织作为对照。采用不同的药代动力学模型行DCE-MRI定量分析。目前最适合软组织肿瘤的药代动力学模型尚无定论,常用的药代动力学模型有以下几种:①STK模型,为单室模型。该模型认为血管容积为零,对比剂由血管直接进入血管外细胞外间隙(e xtravascular extracellular space,EE S)。STK模型适用于病变中微血管密度(microvessel density,MVD)很低的情况。②ETK模型,为双室模型。该模型将组织分为2个部分,分别为血管内部分及EES部分。对比剂进入血管内为第一室;利用组织的灌注和微血管的通透性,通过血液循环到达EES为第二室。该模型对MRI检查设备的时间分辨力及空间分辨力要求较高,分析结果较为准确,是目前临床应用比较广泛的模型。③Patlak模型,为单室模型。该模型采用线性回归的方法来进行药代动力学分析。由于对比剂的转运是单向的,只从血管向EES流动,没有回流。Patlak模型适用于渗透性低且检查时间短的情况,但只有在血液的首过(第一次血液循环)情况下才能成立。如果检查时间较长,结果会不准确[6]。
1.4 影像分析 DCE-MRI分为定性分析、半定量分析和定量分析。定性分析即直接根据TIC曲线的形态变化判断对比剂进入组织和病变的流入速度及廓清时间,进而判断病变的强化程度和血供特点。定性分析是最基本的一种分析方法,简单直观,但是主观性较强[5]。半定量分析依据TIC曲线的形态特点,计算出一系列半定量参数,进而对组织的强化特点进行描述。半定量分析较定性分析更为准确,但因其受参数设置、组织T1时间变化以及病人状态的影响,不同研究者间的结果难以直接比较,而且不能获得组织的生理代谢情况[7]。定量分析则需要先获得动脉输入函数,再运用血流动力学模型进行计算。DCE-MRI的定量分析可以减少外部因素的干扰,相对更准确,可以真实地反映组织微循环内对比剂浓度变化及药代动力学信息。
2 DCE-MRI用于软组织肿瘤的生物物理学基础
DCE-MRI的3种分析方法虽然不同,但都是对软组织肿瘤生理变化情况的反映。定性分析的TIC曲线目前多分为4型:Ⅰ型为速升-速降型,Ⅱ型为速升-平台型,Ⅲ型为缓慢上升型,Ⅳ型为平台型。而TIC曲线的形态与软组织肿瘤血管系统状态关系密切。肿瘤新生血管越丰富,血管通透性越大,血流灌注量越大,对比剂的流入和流出就越快;反之,则相反。半定量分析可以根据TIC曲线计算出初始曲线下面积、达峰时间、最大强化率、最大上升斜率、平均通过时间等一系列半定量参数,对组织的强化特点进行描述。研究证实DCE-MRI的半定量参数能够敏感地反映软组织肿瘤的血流动力学变化[8]。动态增强早期,对比剂进入肿瘤血管内,毛细血管数量及血流灌注的增加可使肿瘤内信号升高;晚期,对比剂扩散进入血管外间隙,可以再次引起肿瘤内信号改变。定量分析的生理学基础是组织微循环的改变,参数主要有容量转移常数(Ktrans)、速率常数(kep)、血管外细胞外容积分数(ve)[5,9-10]。 三者关系如下:ve=Ktrans/kep。大部分人体组织在注射对比剂后,对比剂均可渗出到EES,其渗出速度受微血管渗透性、微血管表面积和血流量的共同影响。在对肿瘤行增强扫描时,可用Ktrans表示对比剂在扩散时的跨内皮转运速度。Ktrans受组织血流量和渗透性的影响,Ktrans越高表示血流量和渗透性越高,提示肿瘤新生血管的数量和渗透性越高。因为小分子对比剂不能通过细胞膜,所以可以用其分布体积代表间质间隙。对比剂从血管系统扩散入组织间隙后,经过一段时间再扩散回到血管系统中,这个扩散的速度可以用kep来表示。ve表示每单位体积组织血管外细胞外间隙的大小,软组织肿瘤细胞数目越多,分布越拥挤,加之新生血管丰富,使得细胞外间隙减少,ve值减小。总的来说,随着软组织肿瘤生物学行为的不同,肿瘤内的血流灌注和血管的通透性都会发生改变,而定量分析则可以将肿瘤及瘤周区域微血管的通透性变化转换成可观察计算的数值,动态评价肿瘤的生物学行为[4]。
3 DCE-MRI在软组织肿瘤中的临床应用
3.1 鉴别良恶性肿瘤 肿瘤组织内的缺氧、弱酸性等微环境及癌基因的激活能产生大量的微血管内皮生长因子,刺激肿瘤生成大量肿瘤血管。肿瘤血管走行扭曲、紊乱,内径粗细不均,异型性高,且血管壁缺乏完整的肌层和基底层。恶性软组织肿瘤新生血管更加丰富,通透性更高,早期灌注效应明显,使得恶性肿瘤内对比剂快速充填,同时又快速流出,对比剂的滞留时间多短于良性肿瘤,TIC曲线多呈Ⅰ型和Ⅱ型。Einarsdóttir等[11]对33例软组织肿瘤的病人进行了DCE-MRI定性分析,结果显示恶性软组织肿瘤TIC曲线多为Ⅱ型,良性软组织肿瘤较少为此类型。而DCE-MRI诊断敏感度为87%,特异度为70%,因此可以在术前对良、恶性软组织肿瘤进行粗略的鉴别诊断。但研究同时指出,DCE-MRI定性分析受诸多因素的影响,目前仅能粗略鉴别良恶性,需要更大数量的样本最终确定DCE-MRI定性分析的临床价值。Tuncbilek等[12]采用DCE-MRI半定量分析22例病人软组织肿瘤的良恶性,结果显示恶性肿瘤组的TIC曲线最大上升斜率等参数明显高于良性肿瘤组,其差异有统计学意义。在多参数联合鉴别诊断时,总体的准确度可达95.5%(P=0.004)。Park等[13]采用3.0 TMRI对7个良性软组织肿瘤和6个恶性软组织肿瘤行DCE-MRI半定量分析,恶性软组织肿瘤的曲线最大上升斜率明显高于良性软组织肿瘤,并趋向于早期强化。陈等[14]对42例良恶性软组织肿瘤进行了DCE-MRI的半定量分析,结果显示恶性肿瘤组的TIC曲线的最大强化率和最大上升斜率明显高于良性肿瘤组,其差异有统计学意义(Z 值分别为 1.961、3.203,P<0.05、P<0.01)。TIC曲线的最大强化率、最大上升斜率和两者联合的受试者操作特征(ROC)曲线下面积分别为0.680、0.794、0.793。DCE-MRI定量参数的大小受组织内血流量、毛细血管渗透性及其表面积共同影响。正常组织的血管壁完整,毛细血管床发育成熟。在软组织肿瘤内的缺氧、微酸等微环境的刺激、致癌基因的激活等因素的共同作用下,肿瘤内的血管内皮生长因子(VEGF)的水平会增加,刺激肿瘤组织产生更多的肿瘤血管,MVD计数增大。因肿瘤血管结构不完整,缺乏完整的肌层和基底层,使得其微血管通透性增加,对刺激的反应性及供养能力下降[15],导致肿瘤组织的Ktrans、kep值高于正常肌肉组织。恶性肿瘤生长旺盛,诱导微血管生成的能力强,使得血管渗透性增大,因而Ktrans、kep值较大(图1)。而良性肿瘤生长速度较慢,生长方式相对温和,新生血管的异型性较小,使得血管渗透性较小,Ktrans、kep值较小(图2)。Fayad等[16]对经病理证实的骨肉瘤和软组织肉瘤采用定量DCE-MRI进行分析,结果显示恶性组肿瘤的Ktrans值明显高于良性肿瘤组。张等[17]研究显示,DCE-MRI药代动力学参数Ktrans、kep可以反映骨肌系统良性、交界性和恶性肿瘤在毛细血管渗透性方面存在的差异,有助于肿瘤的定性诊断。恶性肿瘤的定量参数 Ktrans值(P<0.001)、kep值(P<0.01)均高于良性和交界性肿瘤,而ve值的意义有待进一步探讨;良性和交界性肿瘤的Ktrans、kep、ve值的差异无统计学意义(P>0.05)。
3.2 预测疗效 病理类型相同的软组织肿瘤其生物学行为并不完全相同,对放化疗的敏感性也不完全相同。因此,准确预测肿瘤的治疗效果对治疗方案的选择十分重要。大量实验结果证实,肿瘤放疗的敏感性是由其乏氧程度决定的。一些对裸鼠皮下黑色素瘤模型的研究[18-19]证实了Ktrans、ve与肿瘤乏氧程度及缺氧诱导因子1α(HIF-1α)的相关性,提供了DCE-MRI预测肿瘤放疗敏感性的理论依据。Del等[20]利用DCE-MRI定量分析,回顾性分析了37例软组织肿瘤的病人,其中有6例被确定为肿瘤复发,诊断肿瘤复发的特异度达97%。常规MRI检查与功能性MRI检查,特别是与DCE-MRI相结合,区分肿瘤复发与术后瘢痕形成的特异度超过95%。Kim等[3]使用DCE-MRI和DWI对38例恶性软组织肿瘤病人进行术后随访。结果显示DCE-MRI的参数Ktrans、kep、初始曲线下面积值等和肿瘤复发存在着明显相关性(P<0.05)。最大ADC值和平均ADC值也和肿瘤复发存在着明显相关性(P<0.05)。
3.3 肿瘤活检 软组织结构复杂,肿瘤来源多样,很难确定最佳的活检位置。常规肿瘤的穿刺活检多依靠增强检查,而肿瘤活性、恶性程度最高的区域有可能并不是强化最明显的区域。DCE-MRI定量分析可以获得病变的 Ktrans、kep、ve等参数的伪彩图,找到肿瘤新生血管最多、代谢最旺盛的部分,指导活检位置的选择。Noebauer-Huhmann等[21]在MR引导下行软组织肿瘤活检,并应用DCE-MRI进行活检部位的定位。该研究通过对肿瘤强化最明显的层面进行DCE-MRI定量分析,获得该层面的伪彩图,并标记灌注信号最高的区域为活检位置。在所有检出的42例软组织肿瘤中,以手术组织学结果作为金标准,穿刺活检的诊断准确度为100%。在预测良恶性程度、组织特异性及肿瘤分级上,活检的准确度分别为100%、95.2%和90.5%。初步研究表明,DCEMRI可以准确安全地引导软组织肿瘤的穿刺活检。
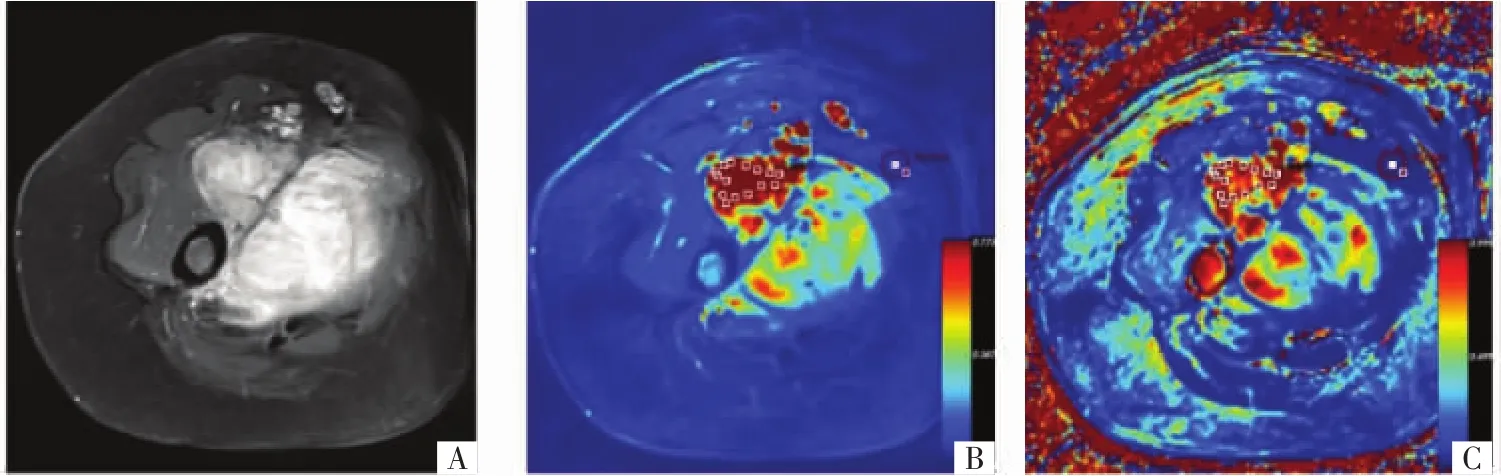
图1 病人女,53岁,右侧大腿恶性软组织肿瘤(纤维肉瘤)。A图为增强MR影像;B图为定量参数K trans值的伪彩图;C图为定量参数k ep值的伪彩图。
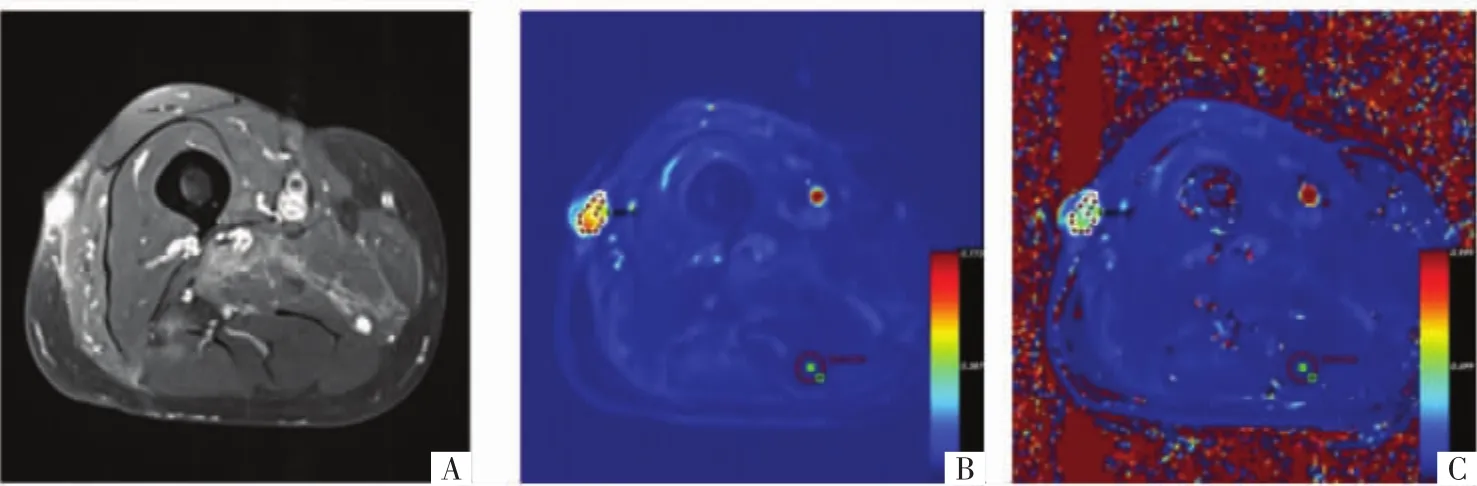
图2 病人男,57岁,右侧大腿良性软组织肿瘤(神经鞘瘤)。A图为增强MR影像;B图为定量参数K trans值的伪彩图;C图为定量参数k ep值的伪彩图。
3.4 评价疗效 传统的实体肿瘤反应评估标准(response evaluation criteria in solid tumors,RECIST)主要是利用肿瘤的形态学指标进行评价,但肿瘤的形态学改变往往滞后于生理学改变,RECIST往往低估治疗药物的疗效。目前临床多用增强CT或增强MRI评价软组织肿瘤治疗后肿瘤残留、复发和纤维化情况,以强化的程度来判断病变的活性。随着新辅助化疗、靶向治疗、基因治疗等多种治疗方法的广泛应用,单纯的形态学指标和强化程度指标存在着较大的局限性,已不能满足准确评价病灶变化的要求[22]。DCE-MRI可以对软组织肿瘤治疗后的强化程度进行量化,从而间接获得肿瘤的生物学信息。Xia等[23]对11例术前接受放化疗且行保肢手术的下肢软组织肉瘤病人进行了DCE-MRI评估,每例病人治疗开始前和治疗后2周均收集DCE-MRI数据,并在手术时报告组织学肿瘤细胞坏死率,结果显示,DCE-MRI可以对软组织肿瘤的放化疗效果进行评估,并且与组织学肿瘤细胞坏死率的相关性良好。
3.5 抗血管生成药物研发 抗肿瘤血管生成靶向药物能够抑制VEGF受体信号转导通路,作用于内皮细胞或周围基质细胞释放的血管生成因子,从而促使肿瘤血管正常化[19]。常规影像检查难以显示肿瘤血管的变化,而DCE-MRI的定量分析可以无创性反映肿瘤血管功能及细胞代谢情况,监测肿瘤微血管的变化,评价抗肿瘤血管生成靶向药物的疗效[24]。Preda等[25]以11只大鼠软组织肿瘤为模型,在药物治疗前后均进行DCE-MRI检查以评估肿瘤微血管在治疗前后的变化,结果证实DCE-MRI可以很好地监测软组织肿瘤微血管的变化,评估药物对肿瘤微血管的短期影响。Alic等[2]也在动物模型上证实了软组织肉瘤的DCE-MRI异质性和灌注水平的相关性,认为DCE-MRI定量参数可以很好地反映肿瘤灌注的情况,用于评估药物治疗对实验性软组织肉瘤模型中肿瘤微脉管的影响。Meyer等[26]将索拉非尼添加到放化疗方案中,用于保肢治疗的恶性软组织肿瘤病人,并通过DCE-MRI评估肿瘤组织微血管的变化及对治疗的反应。其研究结果显示使用索拉非尼治疗2周后获得的软组织肿瘤DCEMRI定量参数与手术时的组织学反应具有相关性(P=0.012),DCE-MRI可以较准确地检测药物对肿瘤组织灌注产生的影响。
4 不足与展望
与传统影像检查相比,DCE-MRI可以将解剖学与功能学结合起来,在宏观及微观方面共同评价病变的特性,更有助于疾病的诊断及治疗疗效的评价。但在软组织肿瘤应用方面,仍有较多问题需要解决。比如扫描序列及技术标准尚不统一,不同的研究结果难以比较,从而导致获得的影像及参数可能缺乏参考价值。DCE-MRI定量分析对药代动力学模型要求相对苛刻,而软组织肿瘤的发病率较低,现在还没有形成完备的药代动力学模型。但随着MRI技术的不断发展,对软组织肿瘤研究的不断深入,将会有较统一的扫描序列及技术标准出现。另外随着人们对生物工程学认识的不断深入,将会有与组织血供及代谢情况匹配得更好的、更合适的药代动力学模型。相信在不久的将来,DCE-MRI能作为一种常规检查方法,提高影像科医生对软组织肿瘤的诊断能力。

