阿柏西普对体外培养的视网膜Müller细胞膜离子通道的影响
雷琦峰,蔡 维
作者单位:(442000)中国湖北省十堰市,湖北医药学院附属东风医院眼科
0引言
视网膜是中枢神经系统的一部分,包括小胶质细胞、星形胶质细胞和Müller细胞等,其中Müller细胞分布在所有脊椎动物的整个视网膜组织中[1]。有研究显示Müller细胞的激活是许多视网膜疾病共同的改变,包括黄斑水肿、糖尿病性视网膜病变、视网膜脱离、缺血-再灌注损伤等[2-3]。Müller细胞上存在多种分子可参与神经递质循环,调节离子平衡以及胶质细胞和神经元之间的联系,包括ATP敏感性K+通道、钙激活的K+通道、Ca2+通道、Na+通道等[4-5]。其中Müller细胞的静息电位主要由ATP敏感性K+通道决定,且ATP敏感性K+通道位于Müller细胞的终板并参与胞外神经递质和离子的吸收[6]。视网膜病变患者的Müller细胞中,内向整流K+电流下调,同时伴随着静息电位的正向移动[7-8],为此研究Müller细胞上K+通道的调节作用,对视网膜疾病的治疗具有重要意义。阿柏西普是一种融合蛋白,是人VEGF受体Flt-1、KDR的细胞外区域部分与人IgG的Fc片段的结合体[9-10],可抑制同源VEGF受体的结合和激活,具有高亲和力,低解离率,与细胞外基质的黏附力弱等特点[11],但是对K+通道的影响还无相关报道。本实验具体探讨了阿柏西普对体外培养的视网膜Müller细胞膜K+通道的影响,以期为改善视网膜疾病的预后提供参考,现总结报道如下。
1材料和方法
1.1材料人Müller细胞由本实验室保存;胎牛血清、DMEM 培养基、5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine, BrdU)购自美国Sigma公司;阿柏西普购自上海生工公司;噻唑蓝MTT溶液购自深圳晶美公司;异硫氰酸荧光素标记的膜联素Ⅴ/碘化丙啶(annexin Ⅴ-fluorescein isothiocyanate/propidium iodide, annexin Ⅴ-FITC/PI)细胞凋亡检测试剂盒、胰蛋白酶、K+荧光探针、超氧化物阴离子荧光探针、DAPI、羊抗caspase-3抗体、羊抗GAPDH抗体、抗谷氨酰胺合成酶(GS)购自Sigma公司。流式细胞仪购自美国BD公司,型号为XP0213。
1.2方法
1.2.1Müller细胞分组与处理将人Müller细胞分为3组:对照组、高糖组、实验组。对照组用含100mL/L胎牛血清的DMEM培养基培养;高糖组用含胎牛血清的高糖DMEM培养基(33mmol/L葡萄糖)培养;实验组用含胎牛血清的高糖DMEM培养基(33mmol/L葡萄糖)和100μmol/L 阿柏西普处理。
1.2.2Müller细胞K+浓度检测采用荧光探针N-甲氧喹诺基乙酰乙酯检测细胞内K+浓度,将按上述方法分组的Müller细胞接种于48孔板中,处理后吸弃培养基。每孔加入100μL 10mmol/L荧光检测工作液,孵育1h;PBS洗涤5min×5次,倒置荧光显微镜进行荧光检测,每个样本随机选取5个细胞,记录与计算荧光强度,实验重复3次。
1.2.3Müller细胞存活率检测将Müller细胞以5×105个/mL接种于96孔板中,按照上述方法处理后,吸弃培养基。加10μL剂量为5mg/mL MTT溶液与100μL无血清培养基继续孵育4h,每孔加150μL二甲基亚砜,振荡10min。在酶联免疫检测仪490nm波长处测定各孔吸光度(A)值,计算细胞存活率,实验重复3次。
1.2.4Müller细胞凋亡率检测细胞分组同上,采用annexin V-FITC/PI双染法结合流式细胞术进行检测。用2.5g/L胰蛋白酶消化Müller细胞,收集1×106个细胞,PBS洗涤1次。重悬细胞后,根据试剂盒操作说明书进行annexin V-FITC/PI染色,采用流式细胞术检测Müller细胞凋亡率。
1.2.5caspase-3蛋白水平检测采用Western blot法检测caspase-3表达情况,以GAPDH作为内参对照,用美国BD公司的8721型凝胶分析软件分析各蛋白目的条带的吸光度(A)值,以A目的蛋白/AGAPDH比值表示目的蛋白的相对表达水平。
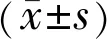
2结果
2.1Müller细胞培养和鉴定Müller细胞培养48h后呈现谷氨酰胺合成酶(GS)阳性,纯化度在90%以上(图1)。
2.2K+水平对比荧光检测显示对照组、高糖组、实验组K+相对浓度分别为(2.14±0.44)%、(23.11±4.39)%、(5.20±0.92)%,组间比较差异有统计学意义(F=28.482,P<0.05)。
2.3细胞存活率对比MTT检测显示对照组、高糖组、实验组Müller细胞存活率分别为(100.00±0.00)%、(73.24±4.13)%、(85.22±5.33)%,组间比较差异有统计学意义(F=8.274,P<0.05)。
2.4细胞凋亡率对比流式细胞术检测显示对照组、高糖组、实验组Müller细胞凋亡率分别为(5.03±1.91)%、(26.73±3.14)%、(16.63±2.73)%,组间比较差异有统计学意义(F=9.284,P<0.05),见图2。
2.5caspase-3蛋白表达水平对比与对照组相比,高糖组Müller细胞内caspase-3蛋白水平显著上升,差异有统计学意义(7.28±1.38vs2.92±1.38,P<0.05);与高糖组Müller细胞相比,实验组Müller细胞内caspase-3蛋白水平显著降低,差异有统计学意义(7.28±1.38vs4.29±2.40,P<0.05),见图3。
3讨论
Müller细胞可参与视网膜葡萄糖代谢,对神经元起着支持作用,调节视网膜血液流动,释放神经递质和其它神经兴奋性物质从而直接或间接地调节神经元兴奋性,维持血-视网膜屏障[12]。Müller细胞也可通过释放抗氧化物质和神经营养因子,还可以通过生成神经前体,促进视网膜重生[13]。而Müller细胞胶质化也会促使神经退化,从而阻止视网膜组织的重生进程[14]。Müller细胞和神经元之间的功能联系需要胶质细胞维持相对负的膜电位,K+电流的下调将导致Müller细胞去极化,使其维持细胞内外K+和水平衡功能障碍,从而严重影响视网膜的功能[15]。
阿柏西普结构为全人源化重组融合蛋白包含VEGF受体1结合域2及VEGF受体2结合域3,4,其与VEGFA结合力均较其它VEGF药物高,结合能力大约是雷珠单抗的30倍,贝伐单抗的50倍[16-17]。本研究荧光检测显示对照组、高糖组、实验组K+相对浓度对比差异有统计学意义(P<0.05),表明阿柏西普的应用能抑制Müller细胞K+水平。从机制上分析,长期高糖刺激可通过葡萄糖对Müller细胞的直接或间接作用经由多种机制造成视网膜损伤,也通过激活Müller的K+通道,从而导致Müller的活化[18]。阿柏西普具有VEGF受体2的免疫球蛋白样区域,直接抑制K+通道,从而调节Müller细胞的兴奋性,从而对其他神经细胞产生调控作用[19]。
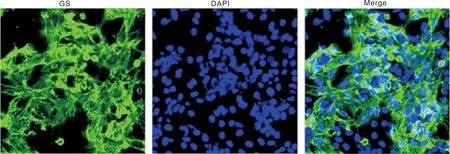
图1Müller细胞的镜下鉴定结果(×400)。
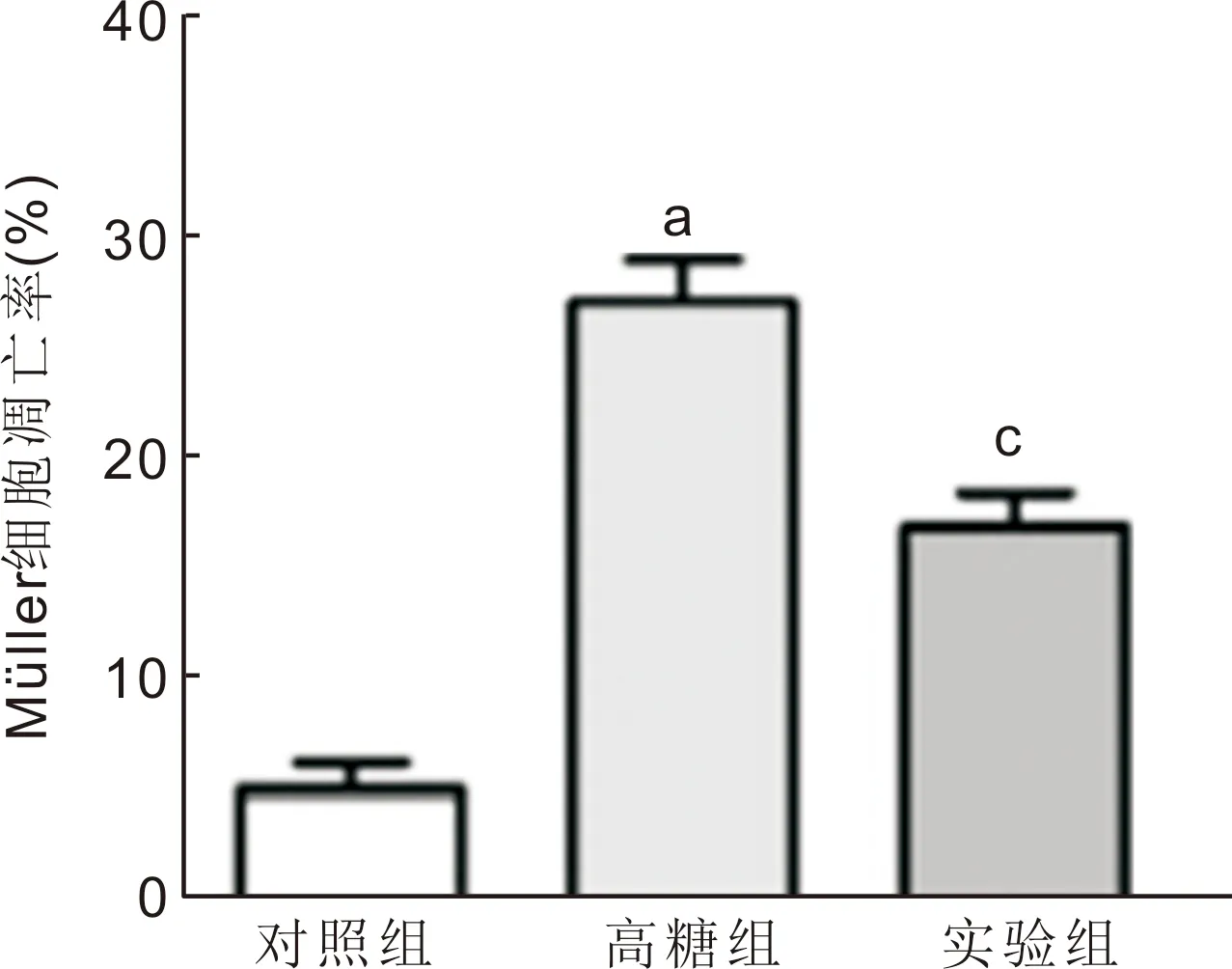
图2流式细胞术检测Müller细胞凋亡情况aP<0.05vs对照组;cP<0.05vs高糖组。
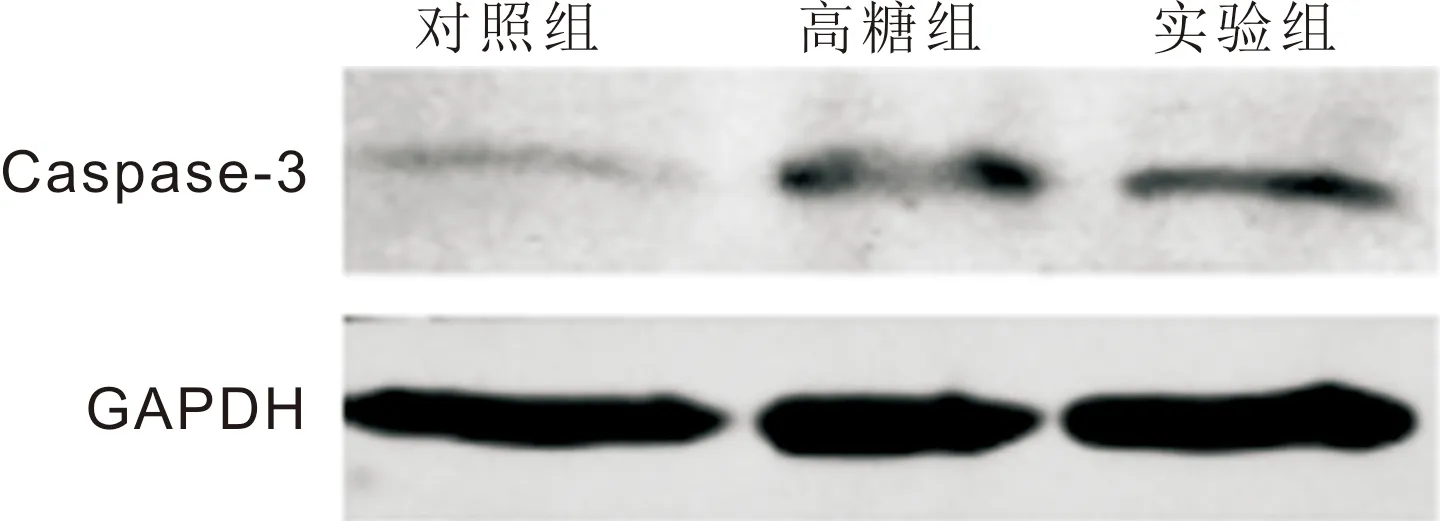
图3Westernblot法检测Müller细胞caspase-3蛋白水平。
本研究显示对照组、高糖组、实验组Müller细胞存活率、凋亡率对比差异有统计学意义(P<0.05)。当前多种机制参与视网膜病变的过程,其中包括离子通道稳态的破坏、血管紧张素系统的上调、氧化应激水平的升高等[20]。Müller细胞的凋亡是视网膜病变的核心病理改变,也是视网膜病变发生的最关键的原因之一。K+是机体内最丰富的阳离子,与细胞迁移、凋亡等多种情况密切相关;阻断K+通道可显著降低Müller细胞的内源性容积调节性K+通道电流,也可改变容积调节性K+通道的整流特性及离子选择性[21]。阿柏西普可以通过各种机制起着保护作用,比如抑制谷氨酸传递从而阻止兴奋性毒性、下调K+内流、抗氧化等;其可直接与Müller细胞上的K+通道相互作用,阻挡欲通过此通道的K+,从而调节Müller细胞的增殖与凋亡[22]。
视网膜是中枢神经系统的延伸,属中枢神经系统,其组织构成类似于脑组织,视网膜Müller细胞对视网膜正常形态、功能的维持起着极其重要的作用[23]。Müller细胞可通过K+通道将胞外的K+流向胞内,为保持神经元内外K+平衡提供保证。Müller细胞的死亡与丢失主要是通过凋亡和坏死两种方式,其中凋亡是一个受到高度调节,需要消耗能量的主动性死亡过程[24]。Caspase是凋亡过程的主要执行者,活化的caspase-3可经蛋白酶解过程激活后,最终引发细胞凋亡[25]。本研究显示与对照组相比,高糖组Müller细胞内caspase-3蛋白水平显著上升(P<0.05);与高糖组Müller细胞相比,实验组Müller细胞内caspase-3蛋白水平显著降低(P<0.05)。表明K+的外流在细胞凋亡中扮演了重要角色;阻断K+通道,也抑制了随后的凋亡事件。本研究也存在一定的不足,没有进行动物模型的体内分析,阿柏西普的具体作用也有待明确,且对于视网膜细胞的作用存在单一性,将在后续研究中进行深入分析。
总之,阿柏西普可抑制体外培养的高糖环境下视网膜Müller细胞膜K+通道,抑制高糖诱导的Müller细胞凋亡,降低caspase-3蛋白表达水平,促进细胞增殖。

