金属有机骨架MIL-101(Fe)吸附As(Ⅲ)的性能
吴桂萍,林晓宇,蒋实,崔龙哲
(中南民族大学 资源与环境学院,武汉 430074)

金属有机骨架(MOFs)是金属离子通过配位键与有机配体上的配体官能团相互作用形成的一种无限结构的配合物,具有孔隙率较高、种类较多、比表面积较大、结构性能优良等优点,被广泛应用于吸附、催化、气体储存等方面[8,9].MIL-101型金属有机骨架是以铁、铝或铬为中心与对苯二甲酸通过配位作用形成一种具有八面体结构材料,作为一种新型的吸附材料,被广泛应用于气体分离与富集及水中污染物的吸附. MOFs还被广泛应用于环境中砷的去除,Li等[10]发现MOF-808对水体中砷的最大吸附量为84.83 mg·g-1,Liu等[11]研究表明ZIF-8对水溶液中砷的最大吸附可达到108 mg·g-1.
本文采用水热法合成金属有机骨架材料MIL-101(Fe)[12],以水中的As(Ⅲ)为吸附对象,探讨溶液pH、时间、溶液浓度、温度等因素对MIL-101(Fe)吸附As(Ⅲ)的影响,并对其吸附动力学、吸附等温线、热力学等进行了研究.
1 实验部分
1.1 材料和仪器
N,N-二甲基甲酰胺DMF、六水三氯化铁、丙酮、氢氧化钠、盐酸(AR,国药集团化学试剂有限公司);亚砷酸钠(CP,上海化学试剂总厂所属上海试剂四厂);对苯二甲酸(99%,aladdin).
pH计(Phs-3C,上海仪电科学仪器);电子天平[FR224CN,上海奥豪斯仪器(常州)];原子吸收光谱仪 (iCE 3500,美国Thermo Fisher );X-射线衍射仪(D8 ADVANCE,德国Bruker);场发射扫描电子显微镜(Supra 40vp,德国Carl Zeiss);X-光电子能谱仪(Multilab AB2000,美国Thermo).
1.2 材料制备
称取1.1009 g对苯二甲酸和3.2243 g FeCl3·6H2O搅拌溶于70 mL DMF中,转移至反应釜中,于383.15 K下反应24 h.将得到的橙色固体在333.15 K下用DMF清洗3次,再用丙酮在323.15 K下清洗3次,离心,将所得固体于333.15 K下真空干燥、研磨,得橙色产品,即为MIL-101(Fe).
1.3 吸附实验
1.3.1 pH对吸附的影响
称取0.02 g MIL-101(Fe)加入至50 mL浓度为50 mg·L-1As(Ⅲ)溶液中,分别调pH为2~11.于恒温震荡器(180 r·min-1)中震荡吸附8 h,吸附结束后,抽取部分溶液过膜(0.45 μm),通过原子吸收光谱仪(火焰原子吸收)测定溶液中As(Ⅲ)浓度及溶出的Fe离子的浓度.
1.3.2 接触时间对吸附的影响
称取0.2 g MIL-101(Fe)放入500 mL浓度为50 mg·L-1As(Ⅲ)溶液中,调节pH=9,在1~480 min内于设定的时间取样过膜(0.45 μm),测定溶液中As(Ⅲ)浓度.实验结果通过拟一级动力学(1)式及拟二级动力学(2)式进行拟合.拟一级动力学是基于膜扩散理论的假设,认为吸附速率与平衡吸附量和吸附量之差的一次方成正比.吸附过程由扩散步骤(膜扩散或颗粒内扩散)控制,公式如下:
(1)
拟二级动力学是基于吸附速率受化学吸附速率控制的假设,认为吸附包括吸附剂和被吸附物之间电子对的共享或转移,公式如下:
(2)
式中:qe为平衡吸附量,mg·L-1;qt为t时刻的吸附量,mg·g-1;k1为拟一级动力学速率常数,min-1,k2为拟二级动力学速率常数,g·mg-1·min-1.
1.3.3 溶液浓度对吸附的影响
称取0.02 g MIL-101(Fe)放入50 mL As(Ⅲ)溶液中,设置浓度为20,50,100,150,200,300,500 mg·L-1.调节pH=9,吸附180 min后取样过膜(0.45 μm),测定溶液中As(Ⅲ)浓度,结果通过Langmuir(3)式、Freundlich(4)式、BET(5)式、TemKin(6)式模型进行拟合分析. Langmuir模型认为吸附属于单层吸附且吸附热为一常数,与覆盖度无关.同时,吸附剂表面活性位点均匀分布,并且假定吸附质分子之间无相互作用[13],公式如下:
(3)
Freundlich模型不受单层吸附的限制且吸附剂表面的吸附位点非均匀分布.一般认为:当1 /n在0.1~0.5表明吸附过程比较容易进行,当1/n>2表明吸附不容易进行[14],公式如下:
(4)
BET模型适合用于多层吸附,吸附剂和被吸附物之间作用力为范德华力.如果实验数据符合BET模型,则吸附以物理吸附为主,公式如下:
(5)
TenKin模型指的是吸附质在表面的吸附热随覆盖度的增大而线性降低.若实验结果符合TenKin模型,则认为吸附以化学吸附为主,公式如下:
qe=BT×(lnA+lnce).
(6)
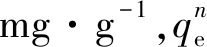
1.3.4 温度对吸附的影响
称取0.02 g MIL-101(Fe)放入50 mL浓度为50 mg·L-1As(Ⅲ)溶液中,调节pH=9.分别将溶液至于293.15,303.15,313.15,323.15,333.15 K条件下吸附180 min后取样过膜(0.45 μm),测定溶液中As(Ⅲ)浓度.实验结果通过如下公式(7~9)进行热力学分析[15].
(7)
ΔG=-RTlnKd,
(8)
(9)
2 结果与讨论
2.1 MIL-101(Fe)性能表征
2.1.1 XRD分析
用X-射线衍射仪对实验中合成的MIL-101(Fe)和经酸(pH=2)浸泡3 h之后的MIL-101(Fe)进行了分析,并与数据库中MIL-101型骨架的标准XRD图谱进行了比较,结果见图1.由图1可见:合成的MIL-101(Fe)在2θ=5.103°,8.333°,8.971°,10.205°,16.377°出现较明显的衍射峰,与数据库以及文献中MIL-101型骨架的标准XRD特征峰基本一致[12,16],证明实验中成功合成了金属有机骨架MIL-101(Fe).MIL-101(Fe)耐酸性较差,在pH=2的酸中浸泡之后,其晶体结构坍塌,XRD特征峰消失.

1)MIL-101(Fe)拟合;2)MIL-101(Fe)合成;3)MIL-101(Fe)(pH=2)图1 MIL-101(Fe)的XRD图谱Fig.1 XRD patterns of MIL-101(Fe)
2.1.2 SEM分析
用场发射扫描电子显微镜对合成的MIL-101(Fe)进行SEM分析,MIL-101(Fe)放大15万倍后的分析结果见图2.由图2可知:合成的MIL-101(Fe)为正八面体结构,其尺寸约为600 nm.

图2 MIL-101(Fe)的SEM图谱Fig.2 SEM patterns of MIL-101(Fe)
2.2 pH对吸附的影响
研究中考察了溶液pH对吸附的影响,并以Fe溶出浓度为参数考察了不同pH条件下MIL-101(Fe)的稳定性,结果如图3.
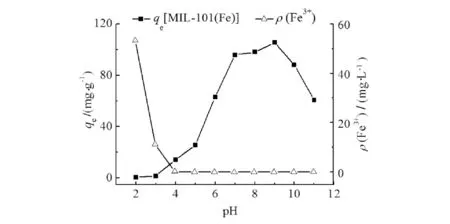
图3 pH对MIL-101(Fe)稳定性及对As(Ⅲ)吸附效果的影响 Fig.3 Effect of pH on stability of MIL-101(Fe) and adsorption of As(Ⅲ)
由图3可知:MIL-101(Fe)在pH为4~11的水溶液中较稳定,Fe溶出浓度很低;但在pH<4时,Fe溶出浓度随着pH的降低而急剧增大,说明MIL-101(Fe)在强酸性条件下,晶体结构遭到不同程度的破坏,结果与XRD分析一致,溶液pH对吸附的影响较大.
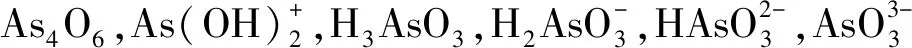

图4 不同pH下As(Ⅲ)的存在形态Fig.4 Existing forms of As(Ⅲ) under different pH
2.3 吸附动力学
MIL-101(Fe)对As(Ⅲ)的吸附量随时间的变化如图5所示.

图5 反应时间对As(Ⅲ)吸附效果的影响Fig.5 Effects of reaction time on adsorption of As(Ⅲ)
由图5可知:MIL-101(Fe)对As(Ⅲ)的吸附速率较快,温度对吸附速率及吸附量均有一定的影响,吸附速率随着温度上升而增加,在303,313,323 K条件下达到吸附平衡所需要的时间分别为10,5,1 min,但随温度的升高,平衡吸附量有一定程度的降低.
用拟一级和拟二级动力学模型对图5中的数据进行拟合,结果如图6所示,相关拟合参数如表1所示.由图6和表1可知:拟二级动力学的相关系数更加接近于1,表明MIL-101(Fe)对溶液中As(Ⅲ)的吸附符合拟二级动力学模型,即吸附速率的控制因素为MIL-101(Fe)与As(Ⅲ)之间的化学反应速率.同时,K323 K>K313 K>K303 K,表明升高温度有利于提高吸附速率,说明随着温度的升高,体系中有效碰撞次数增加,加快反应进行.
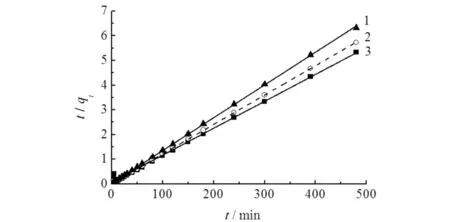
1)323 K; 2)313 K; 3)303 K图6 MIL-101(Fe)对As(Ⅲ)的吸附动力学模型Fig.6 Adsorption kinetics of As(Ⅲ) adsorption by MIL-101(Fe)

T / K拟二级动力学参数R2K2 / (g·mg-1·min-1)3030.99670.00173130.99980.005673230.99990.00747
2.4 等温吸附
溶液平衡浓度对吸附量的影响结果见图7.
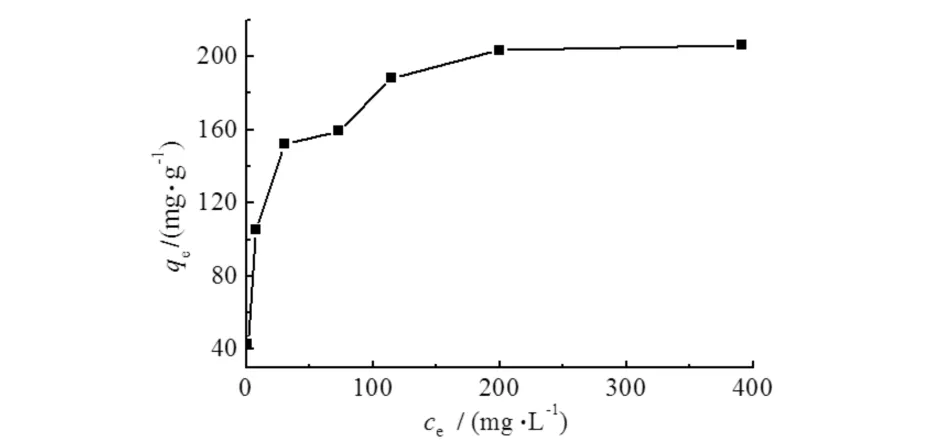
图7 溶液浓度对吸附效果的影响Fig.7 Effects of concentration on adsorption of As(Ⅲ)
由图7可见:在平衡浓度小于30 mg·L-1时,随着平衡浓度的增加,吸附量有较大幅度的增加;平衡浓度在30~200 mg·L-1范围内,随着浓度的增加,吸附量增加幅度较小;当平衡浓度大于200 mg·L-1时,随着溶液浓度的增加,吸附量基本保持不变.由于在浓度较低时,吸附剂表面有大量活性位点未参与吸附,故随着溶液中As(Ⅲ)浓度的增加,吸附量出现较大幅度的提升;当溶液浓度大于200 mg·L-1时,吸附剂上的活性位点基本已经被占据,吸附量基本保持不变.
用Langmuir,TemKin等温模型对图7中的数据进行拟合,结果如图8所示,相关拟合参数如表2所示.由图8和表2可知:Langmuir和TemKin模型与MIL-101(Fe)吸附As(Ⅲ)的实验数据拟合良好,相关系数(R2)均大于0.95,说明吸附剂MIL-101(Fe)表面均匀,对As(Ⅲ)的吸附以单层化学吸附为主.
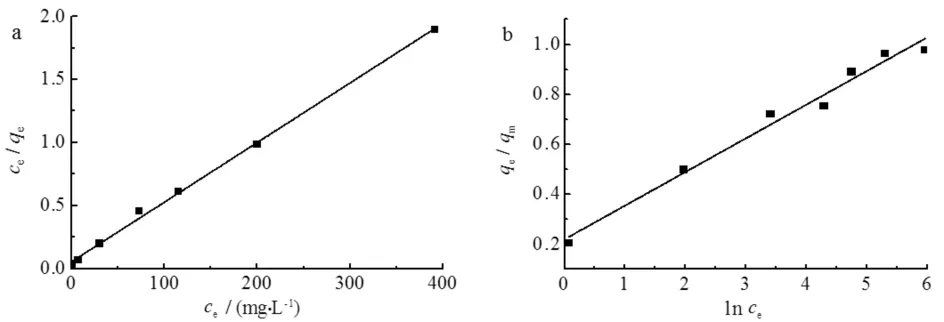
a) Langmuir b)TemKin图8 MIL-101(Fe)对As(Ⅲ)吸附的等温吸附模型Fig.8 Isotherm adsorptionmodelof As(Ⅲ) adsorption by MIL-101(Fe)

模型参数LangmuirR2KLqm/(mg·g-1)TemKinR2BT数 值0.99750.0882211.420.97850.0345
2.5 吸附热力学
在293.15,303.15,313.15,323.15,333.15 K的条件下用MIL-101(Fe)吸附溶液中的As(Ⅲ),MIL-101(Fe)对As(Ⅲ)的吸附量随着温度的升高而降低,结果如图9a所示.
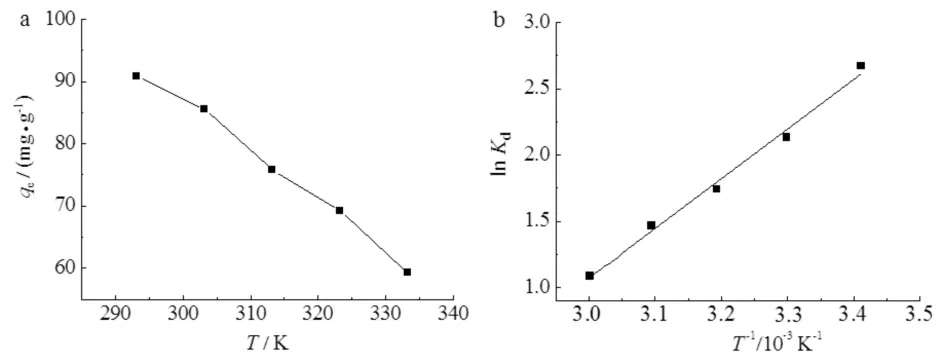
a)温度对MIL-101(Fe)吸附As(Ⅲ)的影响; b) 吸附热力学拟合图9 MIL-101(Fe)对As(Ⅲ)的吸附热力学Fig.9 Adsorption thermodynamics of As(Ⅲ) adsorption by MIL-101(Fe)
对图9a中的数据进行热力学拟合,结果如图9b及表3所示.由图9和表3可知:ΔG<0,表明MIL-101(Fe)对As(Ⅲ)的吸附是自发进行;ΔH=-31.287 kJ·mol-1,表明吸附过程为放热过程,升高温度不利于吸附作用,与实验结果相符[17];ΔS=-84.993 J·mol-1·K-1,表明在吸附过程中,大量As(Ⅲ)被吸附到吸附剂上,使溶液中自由离子含量减少,即在吸附过程中整个水溶液体系的混乱度减少. 同时表明,自发反应可以进行的推动作用是体系能量的降低.
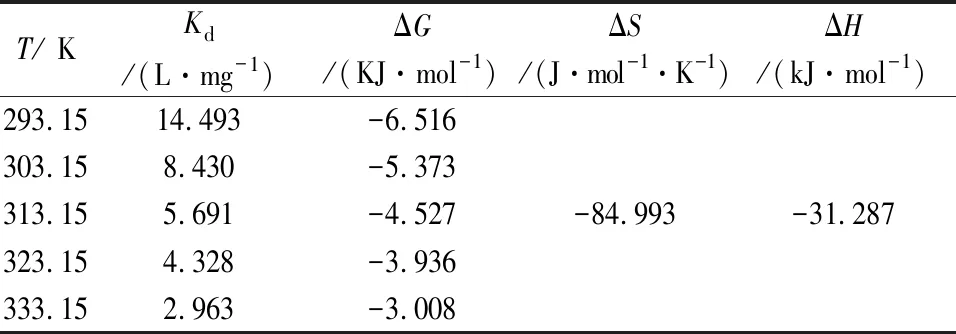
表3 MIL-101(Fe)吸附As(Ⅲ)的热力学相关参数Tab.3 Relatedarameters of As(Ⅲ) adsorption by MIL- 101(Fe) for adsorption thermodynamic
2.6 吸附机理分析
为了探讨吸附机理,对吸附前后MIL-101(Fe)样品中的Fe,As,O进行XPS分析,结果见图10.由图10可知:图10a为Fe2p图谱,710.7,712.38 eV处为Fe2p3/2的特征峰,724.52,726.2 eV处分别为710.7,712.38 eV所对应的Fe2p1/2的峰.在吸附前后,Fe2p峰所在位置以及含量没有发生明显变化,表明在吸附过程中,Fe的价态没有发生变化,始终以Fe3+形式存在[18].
As在溶液中主要以As(Ⅲ)和As(V)形式存在,一般认为,当As的结合能在44.2~44.5 eV范围内时代表As(Ⅲ);而As(V)的峰主要出现在45.2~45.6 eV范围之内.由图10b可知,吸附后的As3d图谱在44.35 eV处出现明显的特征峰,故而表明在吸附过程中As的价态基本没有发生变化,仍然以As(Ⅲ)的形式被吸附[19].

a) Fe2p b) As3d c) O1s图10 As(Ⅲ)吸附前后MIL-101(Fe)XPS分析Fig.10 XPS spectra of MIL-101(Fe) before and after adsorption of As(Ⅲ)
O1s的XPS图谱分析如图10c所示,结合能在531.3,532.2 eV处的特征峰分别代表MIL-101(Fe)中的C—O键和C==O键.529.5,530.5 eV处的峰为Fe—O的特征峰,由表4可知:吸附后MIL-101(Fe)上Fe—O峰的百分含量明显增大,由于As与MIL-101(Fe)的中心金属Fe发生作用生成配位键(Fe←O—As)导致[7].结合前文pH影响、动力学、等温吸附研究的结果,推测MIL-101(Fe)吸附As(Ⅲ)的作用机制主要是MIL-101(Fe)的金属中心Fe与As(Ⅲ)以配位的方式产生化学吸附,如图11所示.
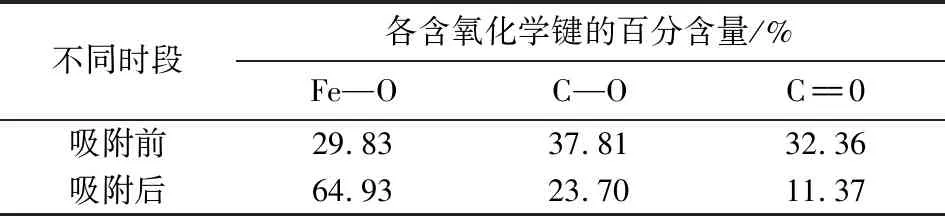
表4 各含氧化学键的百分含量Tab.4 Percentage of each oxygen chemical bond

图11 吸附反应方程式Fig.11 Adsorption reaction equation
3 结论
(1) pH对MIL-101(Fe)吸附As(Ⅲ)影响较大.当pH<9时,随着pH的升高,MIL-101(Fe)对As(Ⅲ)的吸附量随之升高;当pH>9时,随着pH继续升高,MIL-101(Fe)对As(Ⅲ)的吸附量下降.
(2)MIL-101(Fe)对As(Ⅲ)吸附速率较快,在303,313,323 K条件下分别于10,5,1 min达到吸附平衡.吸附过程符合拟二级动力学,影响吸附速率的控制因素为MIL-101(Fe)与As(Ⅲ)之间的化学反应.
(3)吸附符合Langmuir及TemKin等温吸附模型,即MIL-101(Fe)对As(Ⅲ)的吸附为单层化学吸附.
(4)热力学参数(ΔG,ΔH,ΔS)均小于0,表明吸附过程为自发放热反应,且体系混乱度减小.
(5)在吸附过程中,Fe和As基本无价态变化,MIL-101(Fe)对As(Ⅲ)的吸附主要通过中心金属Fe与亚砷酸根之间的配位作用来实现.

