拟南芥隐花色素CRY2调控因子PRP8基因的功能分析
郭亚蓉, 王艳艳, 刘 军*, 裴雁曦*
1.山西大学生命科学学院, 太原 030006;2.中国农业科学院作物科学研究所, 北京 100081
在自然界中,植物体能感受四季变化和昼夜交替,并通过调控自身基因表达的变化来适应周围环境中光照、温度等的改变。光受体是植物体感受外界光信号的主要物质。在模式植物拟南芥中,CRY1和CRY2作为主要的蓝光受体,在调控植物依赖蓝光的光形态建成和长日照下促进开花的过程起作用[1~4]。cry2突变体在高强度蓝光(50 μmol/m2·s)下胚轴表型不明显,而在低强度蓝光(0.6 μmol/m2·s)下表现出明显的下胚轴伸长表型[5]。CRY2通过与下游信号分子CIBs(cryptochrome interacting basic helix-loop-helixes)或COP1/SPA1(constitutive photomorphogenic 1/suppressor of phyA-105) 互作来实现蓝光特异的对下游基因的调控作用[6~10]。作为开花的正调控因子,CRY2通过与CIB1互作直接激活下游FT基因的表达,从而促进开花[7,11,12]。CRY2还可以通过与COP1/SPA1直接互作,抑制COP1/SPA1对CO的降解,从而促进开花[13,14]。蓝光照射后,CRY2蛋白会发生磷酸化,转化成活性形式,并发生依赖蓝光的降解现象[5,15~17]。但目前,直接或间接通过影响CRYs磷酸化或降解作用来调控CRYs功能的作用因子在拟南芥中知之甚少。Blue-light inhibitors of cryptochromes 1 and 2(BIC1 and BIC2)是拟南芥中已发现的两个CRY2的抑制因子,它们可以通过抑制CRY2二聚化、磷酸化及CRY2的降解过程抑制CRY2的功能[18]。
在人和酵母基因组中,PRP8编码一个前体mRNA剪接因子,是mRNA剪接小体中分子量最大、序列最保守的核心蛋白[19]。在拟南芥中,有两个PRP8同源基因,At1g80070(SUS2/PRP8)和At4g38780,PRP8的表达量高于At4g38780百倍以上,因此,有报道指出At4g38780在基因组剪接方面可能没有关键作用。PRP8功能完全缺失的突变体会导致胚胎致死[20]。PRP8基因突变后拟南芥基因组的整体剪接效率降低,出现部分内含子保留现象[21]。PRP8在开花植物合子发育前期,对胚柄的正常发育起关键作用,其功能缺失会导致严重的胚胎发育异常及子叶发育不全现象[22]。PRP8还参与到了自主成花途径中,PRP8突变体降低了FLOWERINGLOCUSC(FLC)反义转录物COOLAIR的剪接效率和对多聚腺苷酸位点的利用效率从而增加FLC基因编码区H3K4me2的甲基化,导致FLC自身表达量升高,从而抑制植物体开花[20]。
为了获得更多能够影响拟南芥CRY2降解的作用因子,本研究对35S:LUC-CRY2的稳定转基因株系进行EMS诱变和筛选,发现了新的PRP8等位基因突变体,该突变导致CRY2蛋白过量积累,并造成了下胚轴伸长和开花变早的表型。
1 材料与方法
1.1 材料
1.1.1实验材料 本实验选用野生型Col-4,35S:LUC-CRY2,prp8-11拟南芥材料,均由实验室保存。拟南芥生长条件为:光照时间为长日照(16 h光照,8 h黑暗),生长温度为22℃左右。
1.1.2实验试剂 高保真酶KOD FX购自TOYOBO公司;In-fusion酶购自全式金公司;2×TaqPCRMix购自康为公司;DNA限制性内切酶购自 Thermo Fisher Scientific公司; TRIzol Reagent、质粒小提中量试剂盒购自天根公司;AxyPrepDNA胶回收及质粒小提试剂盒购自Axygen公司;TransScript®Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒购自全式金公司;TB GreenTMPremix ExTaqTM购自TaKaRa公司。
1.1.3实验器材 DYY-6C电泳仪、Bio-Rad稳压稳流电泳仪、Roche Light Cycler 96型Real-time PCR system、Eppendorf centrifuge 5424R/5417R/5810R离心机、Bio-rad GelDoc XR凝胶成像系统、Nanodrop2000C。
1.2 方法
1.2.1LUC发光检测 在22℃,长日照温室中种植拟南芥35S:LUC-CRY2和prp8-11植株,生长7 d,利用高分辨率化学发光检测成像系统(型号:1024EB)进行LUC发光检测。发射波长为520 nm,激发波长为480 nm,首先在明场曝光1 s,放置好样品的位置;在样品上均匀喷上Luciferase底物,黑暗静置5 min,在暗箱平台曝光10 min后,显示出LUC的发光情况。经过对LUC发光强度的检测,进一步检测出CRY2在蛋白质水平上的表达情况。
1.2.2PRP8基因敲除载体的构建 从TAIR 数据库 (http://www.arabidopsis.org)下载拟南芥PRP8基因的序列,利用在线网站CRISPRdirect(http://crispr.dbcls.jp/)设计两个sgRNA序列(表1)。使用KOD FX 扩增目的片段,限制性内切酶StuⅠ酶切载体JRH0645,凝胶回收目的片段和线性化载体。In-fusion连接且转化大肠杆菌,筛选阳性克隆,保存菌株,并由北京六合华大基因科技有限公司测序。
1.2.3拟南芥遗传转化 在22℃,长日照温室中种植拟南芥Col-4,待大部分植株形成顶端花序后,去除已经结荚的部分。配制花序转化液(含5%的蔗糖,0.03% 的Silwet-77),用花序转化液悬浮农杆菌,将拟南芥的花序浸入转化液中,30 s左右。完成转化以后将拟南芥侧放,黑暗放置12~24 h后,转入正常条件培养,至种子成熟。
1.2.4拟南芥下胚轴长度的测定 野生型Col-4、突变体prp8-11种子春化3 d后,22℃左右,放置在黑暗、蓝光(20 μmol/m2·s)、红光(2.5 μmol/m2·s)、远红光(0.5 μmol/m2·s)的不同生长条件下培养,生长3 d左右,观察下胚轴表型并拍照,用Image J进行下胚轴长度的测量。
1.2.5拟南芥开花统计 用5%的NaClO消毒种子10 min左右,之后用灭过菌的蒸馏水冲洗3次,在1/2 MS培养基上点种。4℃春化3 d,在长日照(16 h光照,8 h黑暗)、22℃左右的生长条件下培养7 d,移至营养土继续培养。花期是指从春化后的种子放到培养室起至抽苔1 cm的时间,莲座叶的统计主要统计在抽苔时拟南芥初生莲座叶的数目。统计突变体莲座叶从植株生长开始每隔一周数一次,并用签字笔做标记,下次统计没有标记的叶片,直至抽苔完成为止,所有数值的总和即为抽苔时莲座叶总数目。
1.2.6Western Blot检测CRY2的蛋白质表达量
拟南芥植株春化3 d后,在持续光照,22℃条件下培养7 d,黑暗下生长24 h,再转到红光(5 μmol/m2·s),蓝光(5 μmol/m2·s)条件下,分别在0 min、5 min、10 min、20 min、30 min时刻取样并进行蛋白质提取。将等量的蛋白质提取物在10%的SDS-PAGE凝胶上以90 V恒压进行电泳操作2 h;使用半干转的方法将蛋白质印迹转到硝酸纤维素膜上,以20 V恒压转膜50 min;用5%脱脂奶粉在水平摇床封闭1 h左右,一抗CRY2(1∶1 000)室温下孵育1~2 h,PBST洗膜3次;二抗(1∶3 000)室温下孵育1~2 h,PBST洗膜3次;加显色底物进行曝光显影,保存图片并分析。
1.2.7qRT-PCR检测CRYs基因的表达量 拟南芥生长条件及取样方式同1.2.5,取样以后利用Trizol法进行总RNA的提取,参照TransGen Biotech反转录试剂盒(TransScript®Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix)的操作说明获取cDNA。从TAIR数据库(http://www.arabidopsis.org)下载拟南芥CRY1、CRY2基因的序列,用Primer 3.0(http://primer3.ut.ee/)设计引物(表1),并由北京六合华大基因科技有限公司合成。以反转录获得的cDNA为模板,用荧光特异引物,参照TaKaRa的TB GreenTMPremix ExTaqTM的操作方法,在Roche Light Cycler 96型实时荧光定量PCR仪进行。qRT-PCR反应体系为(20 μL):SYBR Premix ExTaq10 μL,Primer F 0.4 μL,Primer R 0.4 μL,模板cDNA 2 μL,ddH2O 7.2 μL。每份样品重复3次,并设置阴性对照。qRT-PCR反应程序为:95℃ 30 s,95℃ 5 s,60℃ 20 s,50个循环。

表1 实验所用引物Table 1 Primers used in the experiment.
2 结果与分析
2.1 mac1突变体的获得
为了筛选影响CRY2蛋白降解的作用因子,本研究以LUC蛋白为筛选标记,对35S:LUC-CRY2稳定转基因株系的EMS诱变库进行了LUC发光检测,获得了一个LUC发光强度高于35S:LUC-CRY2植株的突变体mac1/LUC-CRY2(图1A)。

图1 拟南芥mac1突变体的筛选与表型分析Fig.1 Screening and phenotype analysis of Arabidopsis mac1 mutant.
与35S:LUC-CRY2相比,mac1/LUC-CRY2突变体表现出明显的表型缺陷,包括植株矮小、叶片卷曲、早花等(图1B)。利用已有的CRY2多克隆抗体,对mac1/LUC-CRY2突变体中CRY2蛋白水平检测,Western Blot显示,在较低强度蓝光(5 μmol/m2·s)下,外源LUC-CRY2蛋白在0 min、5 min、15 min、30 min、60 min时的表达量都明显高于35S:LUC-CRY2中相应时间的CRY2蛋白表达量;而内源CRY2蛋白在30 min和60 min时的CRY2蛋白表达量明显高于对应35S:LUC-CRY2中相应时间的CRY2蛋白表达量(图1C)。这些结果初步显示mac1突变导致外源转基因LUC-CRY2蛋白的大量积累和内源CRY2蛋白的降解变慢。
2.2 mac1是SUS2/PRP8基因的等位突变体
为了确定mac1突变位点是否与mac1表型连锁,将mac1/LUC-CRY2突变体与野生型Col-4进行回交,对回交后第二代F2进行表型观察和分离比计算,发现F2代中只有野生型和mac1突变体两种表型,并且具有mac1/LUC-CRY2突变体表型的植株占统计植株总数的1/4,因此确定mac1突变位点与表型连锁并且该突变类型为隐性单基因突变。我们进一步从F2代中挑选具有mac1表型但是不含有35S:LUC-CRY2外源转基因的株系,用该株系继续与Col-4进行回交,以消除基因组中其余可能的突变位点,回交4代后,从回交后代收集种子进行后续实验。
将mac1突变体与另一个拟南芥生态型Ler进行杂交,在杂交后的F2群体中挑选具有mac1突变体表型的植株构建图位克隆群体,进行mac1基因定位。最终将mac1突变位点定位在1号染色体末端F18B13 BAC内,通过测序,发现突变位点位于基因At1g80070的第六个外显子上,1个鸟嘌呤核苷酸(G)突变成腺嘌呤核苷酸(A),造成了甘氨酸转到精氨酸的突变(图2A)。At1g80070编码前体mRNA剪接体中的核心剪接因子PRP8,在植物体生长发育各个时期都有表达,在胚柄发育中起主要作用,根据已有的prp8突变体编号,我们将该突变体重命名为prp8-11,以下实验中都使用该名称。
为了进一步确定prp8-11的突变体表型是PRP8基因突变造成的,利用CRISPR/Cas9技术,对野生型Col-4植株进行基因定点敲除实验。获得的多个后代株系prp8-cr都表现植株矮小、叶片卷曲和早花等类似prp8-11突变体的表型(图2C、D)。基因测序结果表明,表型显著的株系均在设计的sgRNA靶标位点发生杂合突变(图2B)。然而由于该基因突变纯合致死,未能鉴定到纯合prp8-11突变体植株。上述结果表明CRISPR/Cas9杂合突变体(prp8-cr)的表型是由于PRP8基因突变造成的。
2.3 prp8-11基因突变导致内源CRY2蛋白降解变慢
CRY2蛋白在高强度蓝光和低强度蓝光下都可以发生降解反应,低蓝光下降解速度较慢;CRY1不发生依赖于蓝光的降解反应。利用已有的CRY1和CRY2蛋白抗体,在低蓝光下检测prp8-11突变对CRY2蛋白降解的影响,Western Blot显示,与野生型Col-4相比,prp8-11突变体在转入蓝光下0 min、5 min、10 min时CRY2蛋白明显积累,在20 min、30 min时蛋白发生降解。CRY1蛋白的表达量在转入蓝光后与野生型相比没有发生明显变化(图3A);将野生型与prp8-11突变体从黑暗转入红光下,CRY2和CRY1蛋白表达量与野生型相比没有发生明显变化(图3B)。这些结果表明PRP8对CRY2蛋白降解有促进作用,prp8-11突变后CRY2蛋白降解变慢,prp8-11突变没有完全抑制CRY2蛋白的降解。prp8-11突变对CRY1蛋白的表达量没有影响。
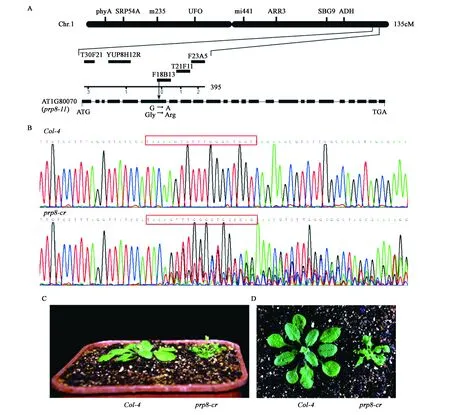
图2 MAC1基因的图位克隆与开花表型验证Fig.2 Map-based cloning and flower phenotype identification of MAC1 gene.

图3 在不同光照条件下prp8-11中的CRY2蛋白质累积Fig.3 CRY2 protein accumulation in prp8-11 mutant under different light.
已有的研究表明, CRY2蛋白依赖于蓝光的降解反应发生在转录后水平,磷酸化后的CRY2蛋白依赖于26 S蛋白酶体途径发生降解。为了鉴别PRP8对CRY2降解的促进作用发生在转录水平还是转录后水平,本研究将野生型和prp8-11突变体分别由黑暗转到蓝光和红光条件下,检测不同时间点Col-4和prp8-11突变体中CRY1、CRY2基因的表达情况,Real-time PCR显示,在低蓝光下,prp8-11突变体中CRY1和CRY2的表达量均低于野生型 (图4A、B)。转入红光条件下后,prp8-11突变体中的CRY1和CRY2表达也同样低于野生型(图4C、D)。这些结果表明,在prp8-11突变体中,CRY2蛋白降解变慢不是由于基因在转录水平表达升高引起的,PRP8对CRY2蛋白降解过程的影响发生在转录后水平。
2.4 prp8-11突变体表现早花表型
CRY2在拟南芥中主要负责在长日照(LD)下促进开花。prp8-11突变体中CRY2蛋白降解变慢,推测可能会因为CRY2蛋白的积累而影响拟南芥的开花时间。通过对prp8-11突变体在LD下开花时间进行统计,发现与野生型相比,prp8-11突变体开花时间明显提前(图5A、B)。在35S:LUC-CRY2转基因株系中,CRY2蛋白过量表达,植株也同样表现出较早的开花表型(图5A)。这些结果表明,PRP8基因在LD下抑制拟南芥开花,这种作用很可能是通过促进CRY2蛋白降解,从而影响CRY2参与调控的开花途径实现的。
2.5 prp8-11突变体表现下胚轴变短表型
CRY1在拟南芥中主要负责蓝光下抑制下胚轴的伸长, CRY2在低蓝光下对下胚轴的伸长有抑制作用。由于prp8-11在低蓝光下对CRY2蛋白降解有抑制作用,推测PRP8可能参与到CRY2调控的下胚轴伸长的抑制过程中。通过分析prp8-11突变体在不同光照条件下的下胚轴长度,发现在黑暗、蓝光(20 μmol/m2·s)、红光(2.5 μmol/m2·s)和远红光(0.5 μmol/m2·s)条件下,prp8-11突变体的下胚轴明显短于野生型Col-4(图6)。这些结果证明PRP8有促进下胚轴伸长的功能,这个过程可以不依赖于光照而独立存在。PRP8也参与到了其他光照相关的下胚轴长度的调控过程中。
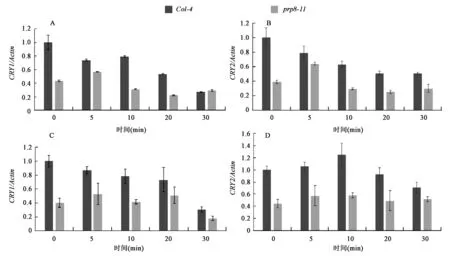
图4 不同光照下CRY1与CRY2基因mRNA表达量分析Fig.4 Gene expression analysis of CRY1 and CRY2 under blue or red light conditions.

图5 prp8-11在长日照条件下表现出早花的表型Fig.5 prp8-11 shows early flowering phenotype in long day.
3 讨论
本研究首次揭示了PRP8基因有促进 CRY2降解和下胚轴伸长的新功能,并且证明PRP8对拟南芥开花有抑制作用。到目前为止,在拟南芥中除已经证实的BIC1和BIC2外,已知的能够影响CRY2降解的作用因子知之甚少[18]。因此本研究弥补了该方面的研究空白,为进一步了解CRY2的降解过程及其作用机理提供了依据。
根据本研究结果,PRP8促进CRY2蛋白降解,但其作用机制还不清楚。我们推测,PRP8作为前体mRNA剪接因子,可能通过影响CRY2前体 mRNA的剪接,改变了CRY2蛋白的结构,最终影响了CRY2蛋白的降解。已有的研究结果表明,PRP8基因突变后植物基因组会发生内含子保留现象[21],如果有内含子保留在CRY2 mRNA中并成功翻译成蛋白质,导致CRY2蛋白结构发生改变,后续的降解过程很可能因此受到影响。此外,PRP8功能完全丧失的突变体导致胚胎致死,因此本研究获得的是功能不完全缺失的突变体,在表型观察时,也可能导致对CRY2蛋白降解的影响不明显,而实际上PRP8对CYR2蛋白降解的影响可能会更显著。

图6 prp8-11在不同光照条件下下胚轴表型Fig.6 Hypocotyl phenotype of prp8-11 in different light conditions.
在拟南芥中,CRY2和PRP8都具有促进开花的功能。在自主成花途径中,PRP8基因突变导致FLC基因表达上调,从而抑制植物开花。本研究中,prp8-11突变体表现出早花表型,因此推测,PRP8在自主成花途径之外,还参与其他开花相关途径。CRY2通过CIBs或COP1/SPAs途径调控拟南芥开花,那么PRP8可能通过参与CRY2相关的开花调控途径。如果PRP8参与CIBs相关途径,那么prp8-11突变后,可能通过抑制CRY2降解,积累更多的CRY2蛋白与CIBs转录因子互作,从而促进下游FT基因的表达;如果PRP8参与COP1/SPAs途径,那么在prp8-11突变体中,CRY2蛋白过多积累导致下游CO蛋白积累,从而促进拟南芥开花。但目前还不知道PRP8具体参与了哪条CRY2相关途径调控开花,这需要实验来进一步确定。
CRY1和CRY2具有蓝光特异的下胚轴调控功能,但从本实验的结果来看,CRY1的蛋白表达并没有受到prp8-11突变的影响,PRP8基因可能不是通过CRY1来调控下胚轴的长度,但prp8-11在蓝光下有明显的下胚轴变短表型,这可能是由于prp8-11属于功能不完全丧失的弱突变体,对CRY1蛋白的影响没有被明显检测到。CRY2在低蓝光下可以抑制下胚轴的伸长,在prp8-11突变体中,CRY2蛋白积累会造成下胚轴明显变短,推测PRP8可能通过CRY2依赖的途径来调控下胚轴的长度。在红光和远红光条件下prp8-11突变体也表现出下胚轴变短表型,所以不排除PRP8通过其他光受体相关途径调控下胚轴长度。PRP8与光信号互作的分子机制还不清楚,所有这些问题都需要进一步研究才能找到答案,这些问题的答案将为进一步了解CRYs及PRP8的作用机制作出贡献。

