运动预处理对大鼠脑缺血再灌注损伤后血脑屏障通透性的影响
梁碧莹,朱路文,唐强,叶涛,李宏玉,李保龙,阮野
1.黑龙江中医药大学,黑龙江哈尔滨市150040;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001;3.贵阳中医学院第一附属医院,贵州贵阳市550000
脑卒中是由于脑部血管突然破裂或因血管阻塞,导致血液不能流入大脑,而引起脑组织损伤的一种急性脑血管疾病。缺血性脑卒中占脑卒中的70%~80%,造成患者运动、感觉、言语、认知等功能障碍[1-2]。脑缺血致脑细胞损伤,灌注恢复后,损伤反而进一步加重,称为缺血再灌注损伤。
脑缺血再灌注损伤可能与血脑屏障功能紊乱有关。缝隙连接作为相邻细胞间的直接通道,是进行细胞间直接信息交流的基础。星形胶质细胞之间存在最广泛的缝隙连接。连接蛋白43(connexin 43,Cx43)是缝隙连接主要组成部分,泛连接蛋白1(Pannexin 1,Panx1)是Pannexins家族的重要成员之一,两者均参与脑缺血再灌注损伤,作用机制较为复杂[3]。
运动预处理是指在缺血前给予大量重复运动训练,能够诱导脑缺血耐受。前期研究证实,运动预处理发挥脑保护作用,与降低炎症反应、抑制谷氨酸兴奋性、减少细胞凋亡有关[4-5]。本文探讨运动预处理对大鼠脑缺血再灌注损伤后血脑屏障通透性及Cx43和Panx1蛋白的影响。
1 材料与方法
1.1 实验动物及分组
健康成年SPF级雄性Sprague-Dawley大鼠54只(北京维通利华实验动物有限公司),许可证号SYXK(京)2010007,体质量(220±10)g。安静环境、温度(21±2)℃、12 h明暗交替、清洁级饲养,环境适宜,通气良好,大鼠自由进食进水。饲养、实验过程均遵照科技部《实验动物管理条例》执行。
随机数字表法分为假手术组、模型组和运动预处理组,每组18只。模型组自由活动3周,制备大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,缺血2 h后恢复灌注;假手术组自由活动3周,仅接受手术操作,线栓插入深度1 cm,不进行再灌注;运动预处理组跑台训练3周,制备MCAO模型,缺血2 h后恢复灌注。
最后所有大鼠均安乐死处理。
1.2 器材和主要试剂
ZH-PT型动物运动跑台:徐州利华电子。移液器:德国EPPENDORF公司。WD-9413B型凝胶成像分析系统:北京六一生物科技有限公司。DY89-ⅠⅠ电动玻璃匀浆机:宁波新芝生物科技股份有限公司。Multiskan FC型酶标仪:美国THERMO公司。小动物麻醉机:深圳瑞沃德生命科技有限公司。激光多普勒血流仪:瑞典PERⅠMED公司。
伊文思蓝:美国SⅠGMA公司。甲酰胺:温州长风生物有限公司。Cx43、Panx1抗体:北京博奥森生物技术有限公司。兔二步法试剂盒:中杉金桥生物技术有限公司。
1.3 方法
1.3.1 模型制备
采用Koizumi[6]改良线栓法制备大鼠MCAO模型。使用小动物麻醉机麻醉大鼠,俯卧放置于手术台上,颅顶正中切口,生物胶垂直固定光纤于前囟后2 mm右侧旁开5 mm。激光多普勒血流仪探测大鼠血流值。
大鼠仰卧、固定,颈部常规消毒、备皮,颈正中偏右切口。结扎颈总动脉主干和颈外动脉,石蜡包裹的鱼线插入颈内动脉,深18~22 cm。激光多普勒血流仪监测血流阻闭,MCA血流降至基线值的30%以下视为造模成功。2 h后缓慢拔出线栓至颈总动脉主干分叉处。血流达基础血流的70%,视为再灌注成功。
1.3.2 运动预处理
运动预处理组予跑台训练,速度15 m/min,坡度0°,电击刺激强度1.5 mA,每天训练30 min,每周6 d,共3周。
1.4 检测指标
1.4.1 改良神经功能评分(modified Neurologic Severity Score,mNSS)
再灌注24 h后,采用mNSS评分[7]评估大鼠神经功能缺损程度。mNSS评分包括行动能力测试、感觉测试、反射测试3大项,14小项,总分14分。评分越低,损伤程度越轻。
1.4.2 血脑屏障通透性
评分后,大鼠麻醉,股静脉注射2%伊文思蓝溶液4 ml/kg。2 h后,生理盐水心脏灌流,至右心房流出澄清液体,取出每组6只大鼠脑组织10 ml/g浸入甲酰胺溶液中,匀浆,60℃恒温水浴孵育24 h,4000 r/min离心20 min,取上清。酶标仪测量光密度(optical density,OD)值。根据标准曲线读出伊文思蓝浓度。
1.4.3 Western blotting
每组6只大鼠脑组织-80℃冰箱冻存。蛋白质抽提,制备蛋白上样液。电泳、转印、封闭,加Cx43一抗(1∶8000)、Panx1 一抗(1∶1000)、内参 GAPDH一抗(1∶2000)孵育,加二抗孵育。取出PⅤDF膜浸入TTBS中,摇床摇动5 min,重复4次;加ECL发光液,静置5 min。暗室曝光。全自动化学发光图像分析系统扫描,计算目的蛋白与内参GAPDH的比率。
1.4.4 免疫组化染色
每组6只大鼠脑组织石蜡切片。脱蜡、入水、冲洗、高压修复,置PBS中。滴加山羊血清封闭液,室温 20~30 min。加 Cx43 一抗(1∶60)和 Panx1 一抗(1∶60),4℃过夜。恢复至室温后,PBS冲洗3次。滴加即用型二抗,37℃避光20 min,PBS冲洗3次。DBA显色5~10 s,水洗终止;苏木素复染,梯度乙醇脱水,二甲苯透明,封片。显微镜观察,Ⅰmage-Pro Plus软件行图像分析,计算目的蛋白表达面积与组织总面积的比率。
1.5 统计学分析
采用SPSS 22.0统计软件对数据进行统计分析。数据用(xˉ±s)表示。组间比较采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1 mNSS评分
假手术组未出现神经功能缺损表现。与模型组比较,运动预处理组的神经功能缺损评分降低(P<0.05)。见表1。
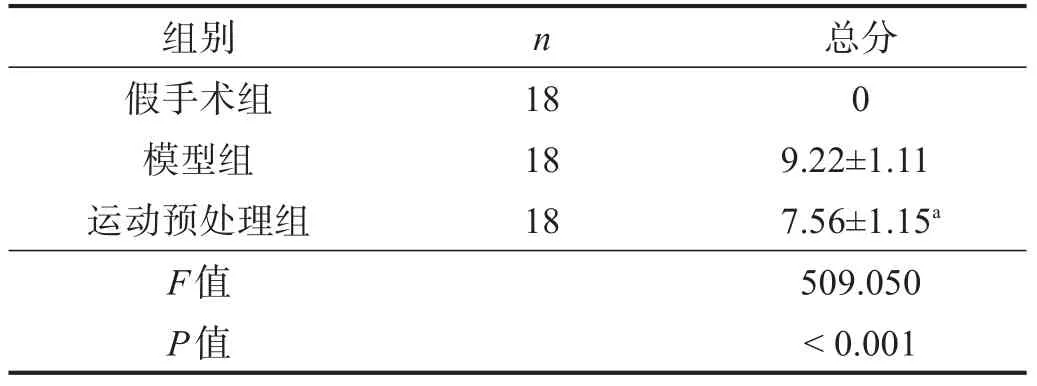
表1 各组神经功能缺损评分比较
2.2 血脑屏障通透性
模型组伊文思蓝含量高于假手术组(P<0.05)。与模型组比较,运动预处理组伊文思蓝含量下降(P<0.05)。见表2。
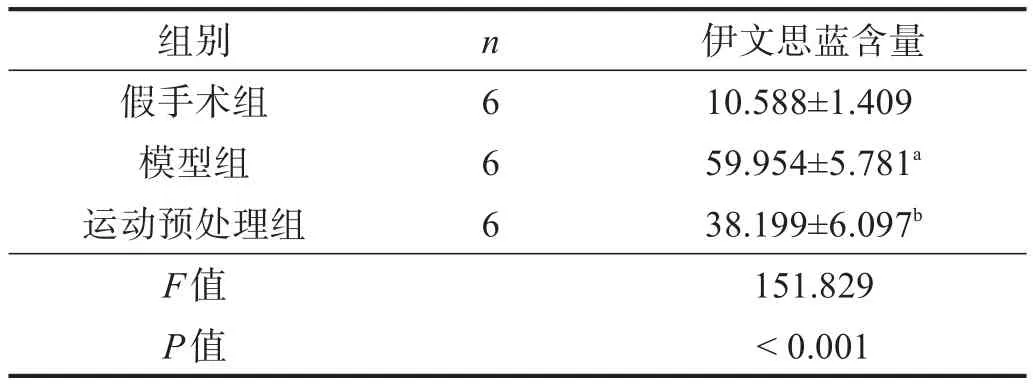
表2 各组大鼠伊文思蓝含量比较(μg/g)
2.3 Western blotting
与假手术组比较,模型组Cx43和Panx1蛋白表达增加(P<0.05)。与模型组比较,运动预处理组Cx43和Panx1蛋白表达下降(P<0.05)。见表3、图1。

表3 各组脑组织Cx43、Panx1蛋白表达
2.4 免疫组化染色
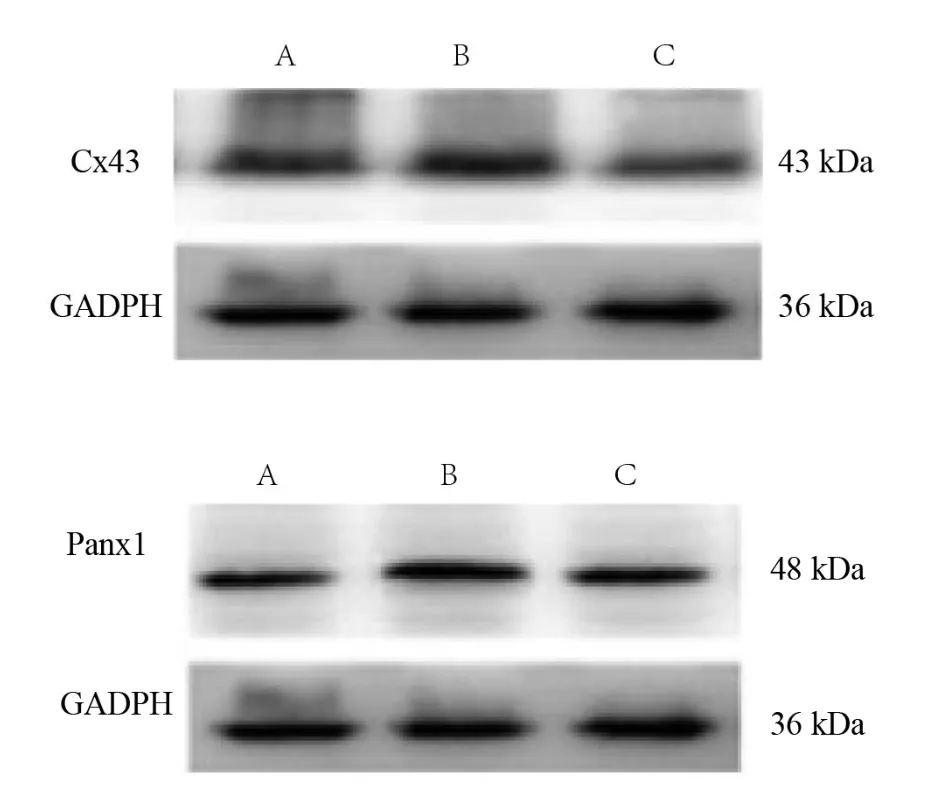
图1 各组Cx43、Panx1蛋白表达
假手术组细胞轮廓清晰,有Cx43和Panx1阳性表达。模型组细胞轮廓模糊,出现大量Cx43和Panx1阳性表达。运动预处理组细胞形态明显恢复。与假手术组比较,模型组Cx43和Panx1阳性表达增加(P<0.05)。与模型组比较,运动预处理组Cx43和Panx1阳性表达降低(P<0.05)。见表4、图2、图3。
3 讨论
预处理的概念于1986年首次提出。Murry等[8]发现,缺血预处理可减轻致死性缺血发生,认为存在缺血耐受现象。1990年,Kitagawa等[9]证实脑缺血耐受的存在。预处理是指经过多次重复干预,对随后的致命伤害可以产生保护[10]。运动预处理可操作性强,安全性高,不易产生疼痛和损伤。既往研究表明[11-12],连续3周运动预处理可降低大鼠脑缺血后的炎症反应,减少脑梗死体积、脑水肿,降低神经功能缺损,也可通过调节脑血流量保护大脑,降低缺血性损伤。运动预处理具有脑保护作用[13],作用机制具有多水平、多通道、多靶点的特点。前期研究发现[14-15],运动预处理可以调节Toll样受体4、核转录因子κB,抑制炎性反应;也可以降低脑缺血再灌注大鼠血清白细胞介素-1β、白细胞介素-6和肿瘤坏死因子α含量。运动预处理还可通过促进神经血管再生、抑制谷氨酸兴奋性毒性、减小细胞凋亡等,发挥脑保护作用[16]。
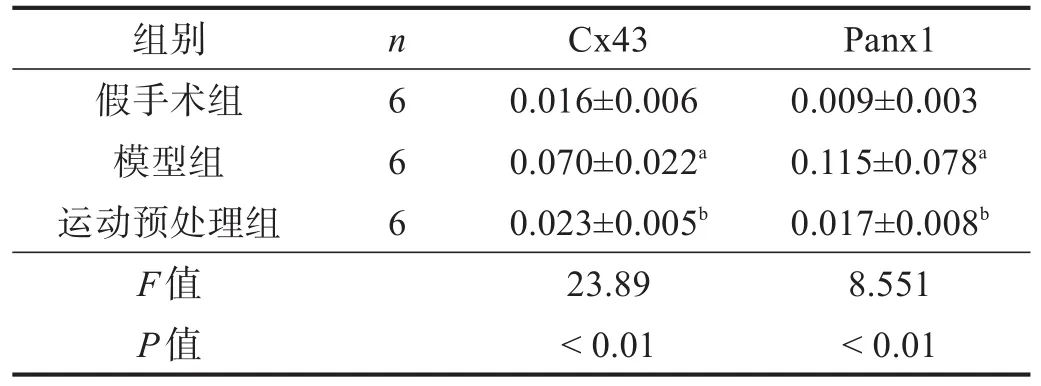
表4 各组Cx43和Panx1阳性面积比率比较
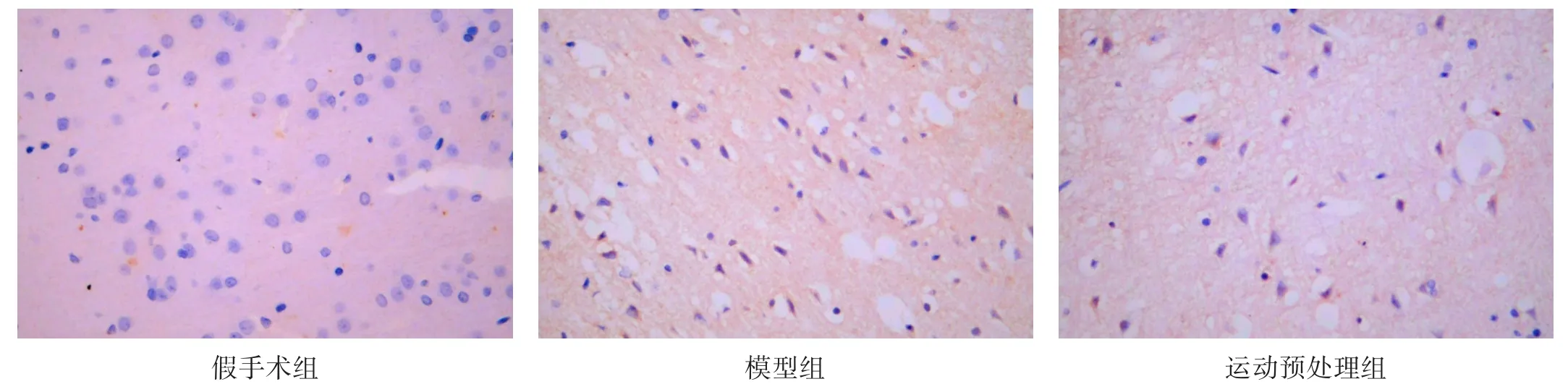
图2 各组Cx43蛋白表达(免疫组化染色,×400)
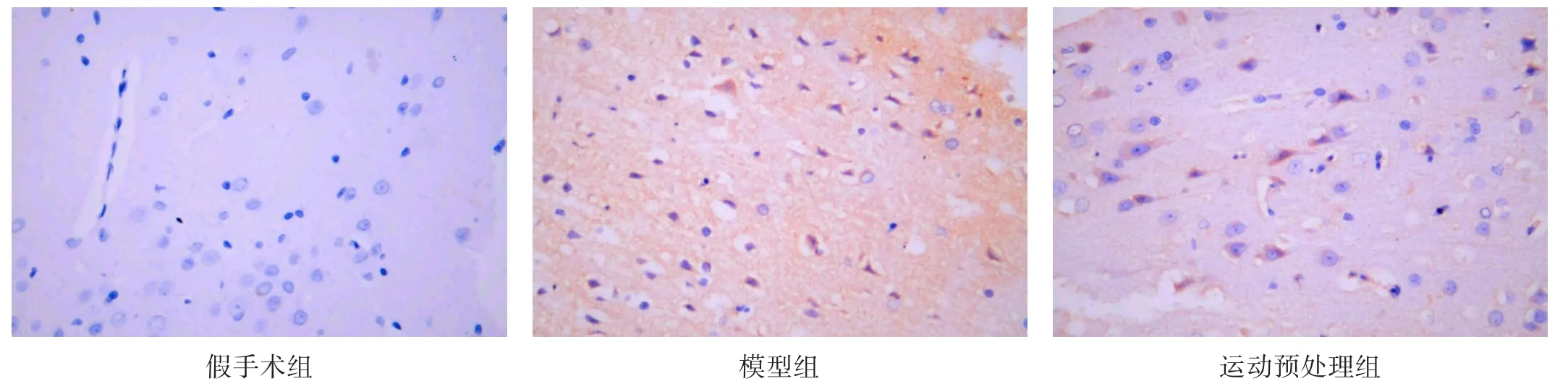
图3 各组Panx1蛋白表达(免疫组化染色,×400)
循环中的染料可以染色大多数组织和器官,但正常情况下大脑无法被染色,这是由于血液和大脑间存在血脑屏障[17]。伊文思蓝可以迅速与白蛋白结合,当血脑屏障被破坏时,伊文思蓝可以随白蛋白渗漏至脑组织中,因此常用伊文思蓝法测量血脑屏障通透性。脑缺血后,血脑屏障通透性改变是脑水肿发生的重要原因[18]。血脑屏障结构和功能的改变与缺血再灌注损伤关系密切,血脑屏障通透性增加会引起脑水肿和其他并发症[19]。
神经胶质细胞是血脑屏障的构成成分,可以维护血脑屏障的生理功能[20]。Cx43和Panx1是星形胶质细胞的重要组成,二者在脑卒中后有较为复杂的作用[21]。Cx43广泛分布于星形胶质细胞终足,其表达增加会破坏血脑屏障通透性,导致一些大分子物质可以透过血脑屏障,加重脑水肿[22]。也有研究认为[23],Cx43可起到保护作用,可能与释放ATP有关。Panx1通道参与脑水肿过程,其抑制剂可以抑制大鼠脑缺血后水通道蛋白4表达,使大鼠脑组织水含量减少,脑水肿程度减轻[24]。使用Panx1阻断剂也可明显阻断其神经保护作用,认为Panx1对脑缺血有一定保护作用[25]。Cx43和Panx1作用复杂,两者在缺血性脑卒中疾病中发挥重要作用,需要深入研究。
本研究显示,大鼠脑缺血再灌注24 h后,运动预处理组mNSS评分降低,伊文思蓝含量、Cx43和Panx1蛋白表达降低。表明运动预处理可以减轻脑损伤,改善神经功能,改善血脑屏障通透性,维持血脑屏障完整,下调Cx43和Panx1蛋白表达,发挥脑保护作用。临床可以制定合理的运动预处理方案,降低脑血管疾病发病率,减轻患者患病后的脑损伤。

