枯草芽孢杆菌发酵提取物对大肠杆菌的抑制作用
, ,,
(浙江万里学院生物与环境学院,浙江宁波 315100)
随着人们食品安全意识的增强,传统的化学防腐剂已不能满足人们的需求,开发新型天然防腐剂已成为食品添加剂发展的主要方向之一。在微生物天然防腐剂中,研究最多的是乳酸链菌肽(Nisin)和纳他霉素(Natamycin),也是目前我国允许使用的两种天然生物保鲜剂。但是Nisin抑菌谱相对较窄,仅对革兰氏阳性菌表现出显著抑制作用,不能抑制革兰氏阴性菌和真菌。Natamycin仅能有效杀灭霉菌、酵母菌和丝状真菌,而对细菌无效。因此,研究开发安全、广谱、高效的微生物天然防腐剂和保鲜剂具有重要意义。
枯草芽孢杆菌(Bacillussubtilis)广泛分布于自然界中,产生抗菌活性物质是其发挥生物防治功能的重要机制之一。枯草芽孢杆菌产生的抗菌活性物质主要有两大类:核糖体合成的抗菌蛋白和抗菌肽以及非核糖体合成的脂肽类化合物[1-3]。枯草芽孢杆菌产生的活性代谢物质抗菌谱广,对植物病原菌、食品腐败菌、致病菌等有明显的抑制作用,同时也表现出抗氧化等功能,是极具潜力的微生物天然食品防腐剂[4-5]。目前对枯草芽孢杆菌抗菌物质的研究较多,主要集中在抗菌物质分离鉴定、抑菌活性等[6-8],抑菌机制涉及较少。此外,不同枯草芽孢杆菌菌株产生的抗菌物质有较大差异,即使同一菌株,发酵条件改变也会导致抗菌物质有偏差,因此开展特定菌株的抗菌物质的筛选及活性研究,对正确利用相关菌株具有重要意义。
本文以革兰氏阴性菌大肠杆菌为目标菌,对枯草芽孢杆菌WL17发酵抗菌物质成分及其对大肠杆菌的抑菌机理进行初步研究,以期为科学开发和利用枯草芽孢杆菌及其抑菌物质提供一定依据。
1 材料与方法
1.1 材料与仪器
LB液体培养基、Hank’s溶液 北京索莱宝科技有限公司;二乙酸荧光素、钙离子荧光探针Fluo-3/AM 美国 Sigma公司;牛肉膏、蛋白胨、酵母膏、L-谷氨酸钠、二甲基亚砜等 均为分析纯;大肠杆菌(E.coli)ATCC25922、枯草芽孢杆菌WL17 由实验室分离得到;种子培养基配方:牛肉膏5 g、蛋白胨10 g、氯化钠5 g、酵母膏5 g、葡萄糖5 g、蒸馏水1L,pH7.0~7.4;发酵培养基配方:葡萄糖20 g、MgSO40.5 g、L-谷氨酸钠5 g、KCl 0.5 g、KH2PO41.0 g、FeSO40.15 mg、MnSO45.0 mg、CuSO40.16 mg、蒸馏水1L,pH7.2~7.4。
H-7650透射电子显微镜 日本Hitachi公司;S-3400N扫描电子显微镜 日本Hitachi公司;F-380荧光分光光度计 天津港东科技发展有限公司;754型紫外可见分光光度计 上海菁华科学仪器有限公司;LC-6AD半制备液相色谱仪 日本岛津公司;LCQ Advantage电喷雾质谱仪 美国Finnigan公司。
1.2 实验方法
1.2.1 枯草芽孢杆菌发酵提取物的制备 取枯草芽孢杆菌斜面菌种到种子培养基中,37 ℃、160 r/min摇床培养18 h后,按3%的接种量接入装有100 mL发酵培养基的三角瓶中,30 ℃、160 r/min,发酵培养38 h。发酵液在4 ℃下8000 r/min离心15 min去菌体得到上清液,上清液用6 mo1/L的HCl调pH为2.5,4 ℃下沉淀1 h。然后离心(4 ℃,10000 r/min)15 min,收集沉淀物,用70%甲醇提取三次,收集提取液将其pH调为中性,旋转蒸发后冷冻干燥得到枯草芽孢杆菌发酵提取物(BsFE)。
1.2.2 BsFE最小抑菌浓度(MIC)的测定 采用液体倍比稀释法测定BsFE对大肠杆菌的最小抑菌浓度[9]。将BsFE用LB液体培养基倍比稀释为0.196、0.393、0.492、0.614、0.768、0.96、1.2、1.5 mg/mL浓度范围,取对数生长期的大肠杆菌分别接种到不同BsFE浓度的LB培养基中,接种菌落数为1×105cfu/mL,同时设置空白对照组(不加BsFE,接种)和阴性对照组(不加BsFE,不接种)。各试管于37 ℃、160 r/min摇床中培养18 h后,观测大肠杆菌的生长情况,并进行固体平板培养实验[10],计算菌落总数,以大肠杆菌不生长的最小稀释度对应的BsFE含量为MIC值。
1.2.3 BsFE对大肠杆菌生长曲线的影响 取大肠杆菌斜面菌种到种子培养基中,37 ℃、160 r/min培养18 h作种子培养液,然后按3%的接种量分别接种于6组含有50 mL LB液体培养基的锥形瓶中,放置于37 ℃、160 r/min的摇床中进行培养。组1(空白组):接种同时添加1 mL无菌蒸馏水;组2(延滞期):接种同时添加BsFE使其浓度为1MIC;组3、组4(对数期):培养5 h后添加BsFE使其最终浓度分别为1MIC、2MIC;组5、组6(稳定期):培养10 h后添加BsFE使其最终浓度分别为1MIC、2MIC。6组分别于培养的0、1.5、3、4、6、8、10、12、14、16、20、24、36、48 h取样测OD600值,制作生长曲线。
利用杀菌率考察BsFE对大肠杆菌的抑菌效果,公式如下:
杀菌率(%)=(对照OD600值-试验组OD600值)/对照OD600值×100
1.2.4 BsFE对大肠杆菌细胞通透性的影响 取对数生长期的大肠杆菌菌液离心(8000 r/min,5 min)收集菌体,用Hank’s溶液洗涤三次,制成浓度为1×105cfu/mL的菌悬液,分别向其加入BsFE,使其最终浓度分别为0、1MIC、2MIC和3MIC。于37 ℃、160 r/min条件下,孵育2 h,离心(8000 r/min,5 min)收集菌体,菌体用Hank’s溶液洗涤三次。然后分别向菌悬液中添加二乙酸荧光素丙酮溶液和Fluo-3/AM二甲基亚砜溶液,两者终浓度分别为0.25 mg/mL和5 μmol/L。添加二乙酸荧光素的菌悬液振荡均匀,室温下放置10 min后,进行荧光分析测定。添加Fluo-3/AM试剂的菌悬液振荡均匀后,避光37 ℃下孵育30 min,5000 r/min离心5 min,菌体用Hank’s溶液洗涤三次,进行荧光分析测定。参照陈卫等[11]方法设置荧光分析测定条件:Fluo-3/AM:激发波长405 nm,扫描波长380~430 nm;二乙酸荧光素:激发波长490 nm,扫描波长460~580 nm。
相对荧光强度(%)=(添加样品后的荧光强度/空白荧光强度)×100
1.2.5 BsFE对大肠杆菌细胞显微特征的影响 取对数生长期的大肠杆菌种子液,接种到BsFE浓度为1MIC的LB液体培养基中,菌液浓度为1×105cfu/mL。于37 ℃、160 r/min摇床中培养3 h后,离心(8000 r/min,5 min)弃上清液,收集细胞沉淀,并用pH7.2磷酸盐缓冲溶液洗涤三次,用2.5%戊二醛固定2 h,然后分别制备扫描电镜和透射样品[12-13],并进行观察。
1.2.6 BsFE的分离纯化和成分分析 采用Sephadex LH-20柱层析(1 cm×85 cm)对BsFE进行分离纯化,以70%甲醇作为洗脱液,流速为0.3 mL/min,检测波长230 nm,每6 min收集一管,按照洗脱峰合并收集液,分别浓缩后冷冻干燥得到BsFE分离组分。选取对大肠杆菌抑菌效果好的组分采用半制备液相色谱仪进行分离制备,采用Kromaisl C-18色谱柱(250 mm×10 mm,5 μm),柱温25 ℃,以乙腈/水(0.1%三氟乙酸)为流动相,进样量150 μL,流速4 mL/min,检测波长230 nm,按色谱峰收集洗脱液,冷冻干燥后得到不同组分,对各组分进行抑菌分析,筛选活性大的组分,利用ESI/MS对其结构进行初步分析。ESI/MS条件如下:正离子模式,扫描范围m/z 100~2000,毛细管电压3.5 kV,锥电压30 V,离子源温度150 ℃。
1.2.7 BsFE分离组分抑菌能力的测定 参照南楠等[14]方法,将大肠杆菌培养至对数生长期,调整其菌体浓度为1×105cfu/mL,采用牛津杯双层平板法测定BsFE分离组分的活性。普通营养琼脂培养基15 mL为下层培养基,凝固后加入混有菌液的改良营养琼脂培养基(琼脂含量为8%)5 mL,即上层培养基。在双层平板上放置牛津杯,分别添加0.2 mL经0.45 μm滤膜过滤的相同浓度的不同组分溶液于牛津杯中,37 ℃培养18~20 h,测定抑菌圈的大小,每个实验重复三次。
1.3 数据处理
实验均重复三次,采用Excel 2010进行统计分析,实验数据用实验结果的平均值±标准差表示。
2 结果与分析
2.1 BsFE最小抑菌浓度(MIC)的测定结果
由实验结果可知,当浓度大于0.614 mg/mL时,接种培养后菌体不变浑浊,BsFE浓度越小,培养液越浑浊,这是因为浓度小于0.614 mg/mL时BsFE无法有效抑制菌体的繁殖生长。取0.614 mg/mL附近的浓度进行平板培养,结果如表1所示,当BsFE浓度小于0.614 mg/mL时,可以观察到菌落生长,而大于0.614 mg/mL时,无菌落生长,因此BsFE的最小抑菌浓度为0.614 mg/mL。

表1 固体平板法验证BsFE的最低抑菌浓度Table 1 Validation the MIC of BsFE by solid plate method
2.2 BsFE对大肠杆菌生长曲线的影响
分别在大肠杆菌生长的延滞期、对数期和稳定期添加不同浓度的BsFE,结果如图1所示。组2于延滞期加入1MIC的BsFE(0 h、1MIC),生长曲线一直保持在较低水平,表明BsFE能够有效地抑制大肠杆菌的生长,并表现出一定的溶菌作用。组3和组4分别在对数生长期加入不同浓度的BsFE(5 h、1MIC,5 h、2MIC),其对大肠杆菌的抑菌和溶菌作用明显,能在短时间内降低其菌体浓度,但添加量对抑菌作用无明显影响。组5和组6分别在稳定期加入不同浓度的BsFE(10 h、1MIC,10 h、2MIC),高浓度(2MIC)下其抑菌和溶菌作用明显好于低浓度(1MIC)。

图1 BsFE对大肠杆菌生长曲线的影响Fig.1 Effects of BsFE on E.coli growth curve
2.3 BsFE对大肠杆菌细胞通透性的影响
经BsFE作用的大肠杆菌细胞染色后的荧光强度变化如图2所示,染色后的细胞在512 nm处荧光强度最大,荧光强度随BsFE浓度的增大而降低,添加1MIC、2MIC、3MICBsFE的相对荧光强度分别为85.3%、75.5%和47.9%。二乙酸荧光素本身不发荧光,但它能够穿透细胞膜被细胞内的非特异性酯酶水解为荧光素[15-16],当细胞膜受到破坏,膜通透性变大,会导致荧光从胞浆中外漏致使荧光强度下降。因此,实验结果表明BsFE能够破坏大肠杆菌细胞膜的完整性,且浓度越高,破坏程度越大。
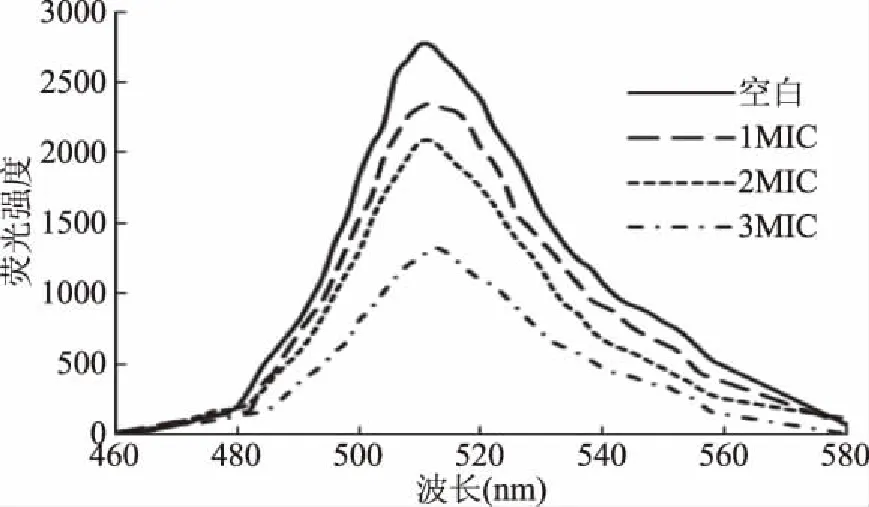
图2 BsFE对大肠杆菌细胞FDA染色后荧光强度的影响Fig.2 Effect of BsFE on the fluorescence intensity of the E. coli by FDA staining
细胞膜通透性的变化可导致细胞内钙离子浓度的改变,采用Fluo-3/AM荧光探针检测BsFE处理后大肠杆菌细胞钙离子浓度的变化,可反映其细胞膜通透性的变化。对BsFE处理后的大肠杆菌细胞进行Fluo-3/AM负载,孵育后荧光强度变化如图3所示,408 nm处荧光强度最大。随着BsFE浓度的增大,荧光强度不断增加,经1MIC、2MIC和MIC BsFE处理后,相对荧光强度分别达202%、245%和318%。结果表明经BsFE处理后,细胞内钙离子浓度大幅度增加,即BsFE处理能破坏大肠杆菌细胞膜的完整性,这与图2所得结果相一致。
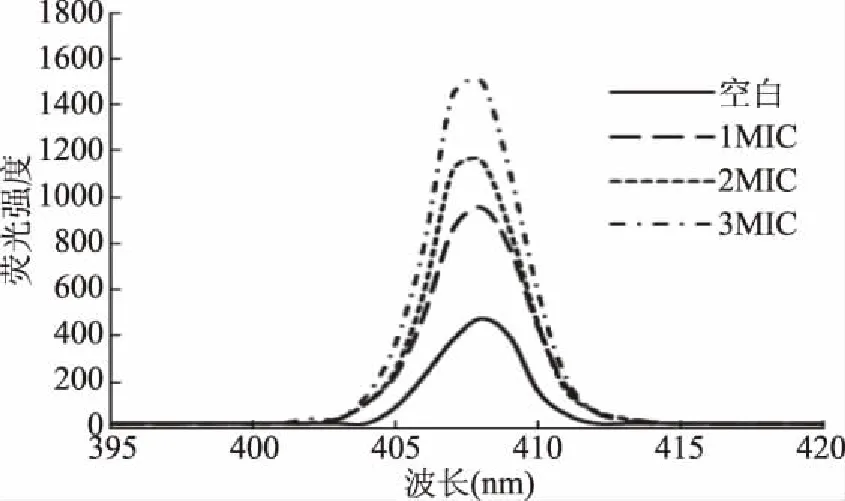
图3 BsFE对大肠杆菌细胞内Ca2+浓度的影响Fig.3 Effect of BsFE on the calcium concentration in the E. coli cell
2.4 BsFE对大肠杆菌细胞显微特征的影响
采用扫描电镜和透射电镜观察BsFE对大肠杆菌细胞形态结构的影响,推断BsFE作用导致大肠杆菌细胞破裂的情况,结果如图4~图5所示。

图4 扫描电镜观察BsFE对大肠杆菌细胞形态结构的影响Fig.4 Effect of BsFE on the structure ofE. coli under scanning electron microscope注:A:空白组;B:BsFE处理组。
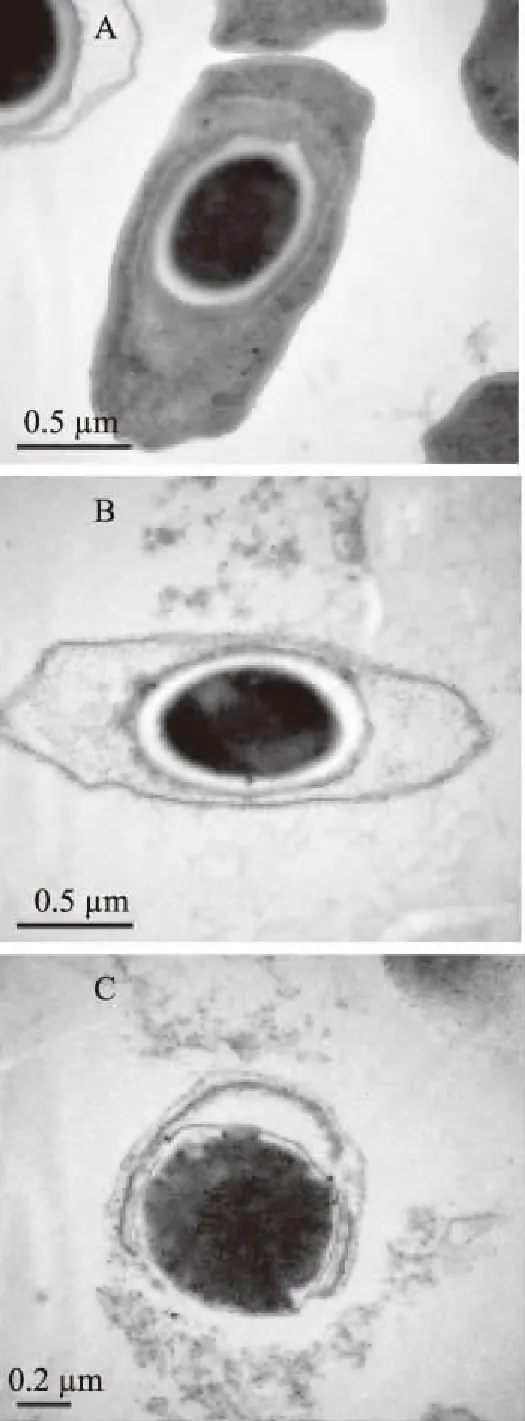
图5 透射电镜下BsFE对大肠杆菌细胞形态结构的影响Fig.5 Effect of BsFE on the structure ofE. coli under transmission electron microscope注:A:空白组0.5 μm;B:BsFE处理组0.5 μm; C:BsFE处理组0.2 μm。
扫描电镜下空白组菌体细胞饱满,细胞轮廓清晰,表面完整光滑,呈现两端钝圆的短杆状,而BsFE作用3 h后,菌体细胞粗糙,大量菌体表面出现褶皱及凹陷,异常菌体数量增多,表明BsFE能有效地破坏细胞表面结构,造成细胞结构形态的改变。透射电镜下空白组菌体细胞完整光滑,细胞膜与细胞壁结合紧密,细胞质均匀,细胞整体无缺陷、无断裂,而BsFE作用3 h后,菌体细胞边缘模糊,细胞壁缺失,细胞膜破裂,细胞质大量流失,表明BsFE能导致细胞膜的破裂,内容物泄露,最终致使细胞死亡。
2.5 BsFE的分离纯化和成分分析
BsFE采用Sephadex LH-20柱层析(1 cm×85 cm)分离可得3个主要组分(S1、S2、S3),选取抑菌活性最强的组分(S3)采用半制备液相色谱进行分离制备,可得6个主要组分(图6),其中峰Ⅰ、峰Ⅴ和峰Ⅵ对大肠杆菌有抑制作用(表2),故对这三个组分进行了ESI/MS分析(表3),结果提示BsFE中主要抑菌成分可能是多烯类化合物和脂肽类化合物。1L发酵液可以获得组分Ⅰ10.25 mg,组分Ⅴ77.48 mg,组分Ⅵ5.73 mg。

表2 分离组分Ⅰ~Ⅵ抑菌活性的分析Table 2 Antimicrobial activities of componentsⅠ~Ⅵ

图6 S3的高效液相色谱图Fig.6 HPLC chromatogram of S3

表3 分离组分Ⅰ、Ⅴ和Ⅵ的质谱分析Table 3 ESI/MS analysis of componentsⅠ,Ⅴ and Ⅵ
3 讨论
枯草芽孢杆菌发酵提取物BsFE对大肠杆菌的最小抑菌浓度(MIC)为0.614 mg/mL。有研究报道阳离子抗菌肽对革兰氏阳性菌、阴性菌以及真菌的最低抑菌浓度范围为0.25~16 μg/mL[17]。黄现青[4]研究发现BacillussubtilisfmbJ产生的脂肽对大肠杆菌的最低抑菌浓度为468.75 μg/mL。相比较,BsFE的MIC值较高,可能是因为抗菌物质不同,同时与试验所用BsFE为混合物有关。抗菌物质的抑菌作用主要有抑菌不溶菌和抑菌并溶菌两种,前者菌体的生长曲线保持一定的浊度水平,不升高也不下降,后者菌体生长曲线会下降[18]。BsFE对大肠杆菌生长曲线的影响表明BsFE能够有效地抑制大肠杆菌的生长,并表现出一定的溶菌作用,且在延滞期和对数期加入BsFE后溶菌作用更明显。另外,考察BsFE对大肠杆菌的杀菌率发现,在延缓期和对数生长期加入BsFE后杀菌率分别能达到80%和60%以上,而在稳定期对大肠杆菌的杀菌率较低,仅为40%左右,说明BsFE对低浓度菌体具有更好的杀菌效果。
卢群等[19]在研究中证实二乙酸荧光素能够有效的载入活的大肠杆菌细胞,可以通过荧光强度的变化表征细胞膜的完整性。Fluo-3/AM在进入细胞后经非特异性酯酶脱去AM酯,与细胞内游离钙离子结合后,荧光强度增加,且与钙离子浓度成比例关系[20],细胞膜通透性的变化可导致细胞内液中钙离子浓度的改变,因此采用Fluo-3/AM荧光探针检测可反映细胞膜通透性的变化。二乙酸荧光素染色法和Fluo-3/AM荧光探针法的试验结果均表明,BsFE能够增加大肠杆菌细胞膜的通透性,使得大量的荧光素随细胞内容物泄露出来,且Fluo-3/AM能够更容易进入细胞内部。为进一步说明BsFE对大肠杆菌菌体细胞的影响,采用扫描电镜和透射电镜观察BsFE对大肠杆菌细胞形态结构的影响,从而推断BsFE处理能够导致大肠杆菌细胞的破裂。由此说明,BsFE能够通过改变细胞膜的结构形态来影响菌体细胞的新陈代谢,从而抑制其生长繁殖。BsFE的抗菌作用可能是通过膜结合性实现的,膜结合性抗菌是一种比较被认可的抗菌作用模型[21-22],该模型认为抗菌物质的膜结合性使其穿透细胞壁结合到细胞膜表面,通过改变膜的通透性或在膜上形成离子通道或进入细胞内部,抑制DNA、RNA和蛋白质的合成,致使细胞死亡。BsFE分离纯化后对具有大肠杆菌抑制作用的组分进行初步成分分析,与相关文献比对[23-27],推测BsFE抑菌活性成分包含多烯类化合物和脂肽类化合物,具体的分子结构有待进一步确定。
4 结论
研究结果表明,枯草芽孢杆菌发酵提取物(BsFE)对大肠杆菌具有明显的抑制作用,在大肠杆菌不同生长期加入BsFE均能取得很好的抑制效果,且延缓期和对数期的效果优于稳定期。试验表明BsFE能增加大肠杆菌细胞膜的通透性,同时经BsFE作用后的细胞表面粗糙,边缘模糊,细胞膜破裂。BsFE经Sephadex LH-20柱和液相制备色谱分离后得到三个具有抑菌活性的组分,初步成分分析显示可能是多烯类化合物和脂肽类化合物。本试验结果为枯草芽孢杆菌及其抑菌物质的进一步开发和研究提供了一定理论基础和科学依据。

