Mg/Ba(NO3)2热分解动力学和热安全性计算
陈明华,过乐驹,曹庆国,张欢迪
(1.中国人民解放军32181部队, 石家庄 050000; 2.中国人民解放军32681部队, 辽宁 铁岭 112000;3.中国人民解放军73906部队, 南京 210041; 4.吉林大学, 长春 130000)

由于组分中含有硝酸钡,这类烟火药剂具有热不稳定性,这使得生产、运输和使用过程事故偶发[3-5],为此,孙斌[6]通过绝热量热仪[7](ARC)研究了硝酸钡类烟火药在干燥和潮湿情况下的绝热反应,得到对应的变化曲线。时烁[8]研究相对湿度和预湿时间对于硝酸锶类药剂的分解机理、动力学和热爆炸参数的影响机制,并对于含水量对于硝酸锶类的安定性和两者的相容性进行评价。I.M.Tuukkanen等[9]研究了Mg/Sr(N03)2烟火药剂在相对湿度为65%环境下可能发生的分解反应。Vethathiri Pakkirisamy Sridhar等[10]研究了不同含水量的烟火药的起始分解温度,王文娟[11]则利用DSC-TG综合热分析实验对3种硝酸锶类药剂在不同湿度下的热安全性进行了探究。
但对于Mg/Ba(NO3)2的热安全性则未见诸报道。本实验采用热重法(TG)法和差式扫描量热法(DSC)法研究Mg/Ba(NO3)2在气压为0.2 MPa的动态气氛下的非等温分解动力学反应,得到其动力学参数,并进行热安全性的研究,为下一步研究Mg/Ba(NO3)2的燃烧性能提供重要的理论参考。
1 实验
实验样品和仪器:
Mg/Ba(NO3)2:Mg、Ba(NO3)2和粘结剂组成。
TGA1,美国PerkinElmer公司,铝制敞口坩埚盛装样品,高纯N2(99.999%)气氛,流速20 mL/min,0.2 MPa压强。
DSC8000,美国PerkinElmer公司,样品用普通铝池卷边盛装,高纯N2(99.999%)气氛,流速20 mL/min。
TG实验为:
升温速率为2.5 ℃·min-1、5.0 ℃·min-1、10.0 ℃·min-1、15 ℃·min-1、20.0 ℃·min-1,温度范围为150~700 ℃。样品质量约2.5 mg。
动态DSC实验为:
升温速率为2.5 ℃·min-1、5.0 ℃·min-1、10.0 ℃·min-1、15 ℃·min-1、20.0 ℃·min-1,温度范围300~500 ℃。
Ba(NO3)2在加热条件下与Mg反应,受热分解反应式如式(1)所示。在N2环境下,Mg与N2在加热环境下生成Mg3N2,如式(2)所示。不同升温速率下Mg/Ba(NO3)2的TG曲线和DSC曲线如图1、图2。由图1可见,TG曲线只有一个台阶,600 ℃后质量的增加主要是因为镁粉和氮气反应。而且随着温升速率的增加,Mg/Ba(NO3)2的起始分解温度的变化不大,但峰温明显增大,如表1。在DSC曲线中,在温升速率为5.0 ℃·min-1时,在349.77 ℃处有一个吸热峰;在温升速率为10.0 ℃·min-1时,在361.5~382.97 ℃有两个吸热峰,对应峰温分别为366.43 ℃和378.70 ℃;在温升速率为20.0 ℃·min-1时,在358.93 ℃~384.39 ℃也有两个吸热峰,对应峰温分别为367.93 ℃和379.32 ℃。而温升速率为2.5 ℃·min-1的吸热熔融峰主要被放热分解过程掩盖。放热峰的各项特征参数见表2。
(1)
(2)
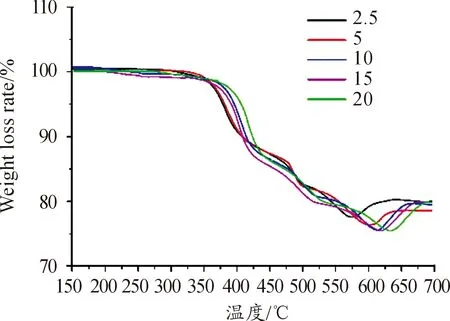
图1 不同升温速率下Mg/Ba(NO3)2的TG曲线

图2 不同升温速率下Mg/Ba(NO3)2的DSC曲线

表1 TG实验Mg/Ba(NO3)2的热分解特征参数

表2 DSC实验Mg/Ba(NO3)2的热分解特征参数
2 化学动力学参数计算
温度和反应转化率决定了物质分解反应的过程,且两者相互独立,从而得到了非均相非等温条件下常用的动力学方程:
(3)
式(3)中,E为活化能(J·mol-1);T为峰温(K);A为指前因子(s-1);R=8.314 J·mol-1·K-1,f(α)为反应机理函数,α为反应深度,β为温升速率(K·min-1)。
对于式(3)以不同方法处理,可以得到不同的数学表达式[12]。对Mg/Ba(NO3)2进行化学动力学计算,采用了积分法中的Flynn-Wall-Ozawa法[式(4)]、一般积分法[式(5)]和微分法中的Starink法[式(6)]、Kissnger法[式(7)]:
(4)

(5)
(6)
(7)
式(5)、式(6)中,G(α)为机理函数积分形式,CS为常数。
为得到Mg/Ba(NO3)2反应的活化能,对于表1数据,利用Flynn-Wall-Ozawa法,不同的β下,若α一样,则G(α)是恒定值,lgβ与1/T成线性关系,由拟合直线斜率和截距计算得到活化能E及相关系数r2,见表3所示。同理,采用微分法的Starink法处理Mg/Ba(NO3)2的TG曲线,ln(β/T1.8)与1/T呈线性关系,进而得到活化能E及相关系数r2,见表4所示。
由表3、表4可以得出,通过Flynn-Wall-Ozawa法可以得到Mg/Ba(NO3)2的活化能E是81.41 kJ·mol-1;采用Starink法时,Mg/Ba(NO3)2的活化能E是76.52 kJ·mol-1。

表3 Flynn-Wall-Ozawa法得到的Mg/Ba(NO3)2活化能E和相关系数r2

表4 Starink法得到的Mg/Ba(NO3)2活化能E和相关系数r2
式(5)的右边第一项是常数,则对于合适的G(α),ln[G(α)/T2]与1/T成线性关系,利用表1数据得到的拟合曲线斜率和截距得到活化能E和指前因子A,如表5所示。同理,利用Kissinger法处理Mg/Ba(NO3)2的TG曲线数据时,如果选择相同的α,ln(β/T2) 与1/T呈线性关系,由直线斜率和截距计算活化能E和指前因子A,如表6所示。

表5 一般积分法得到的Mg/Ba(NO3)2活化能E、指前因子A和相关系数r2
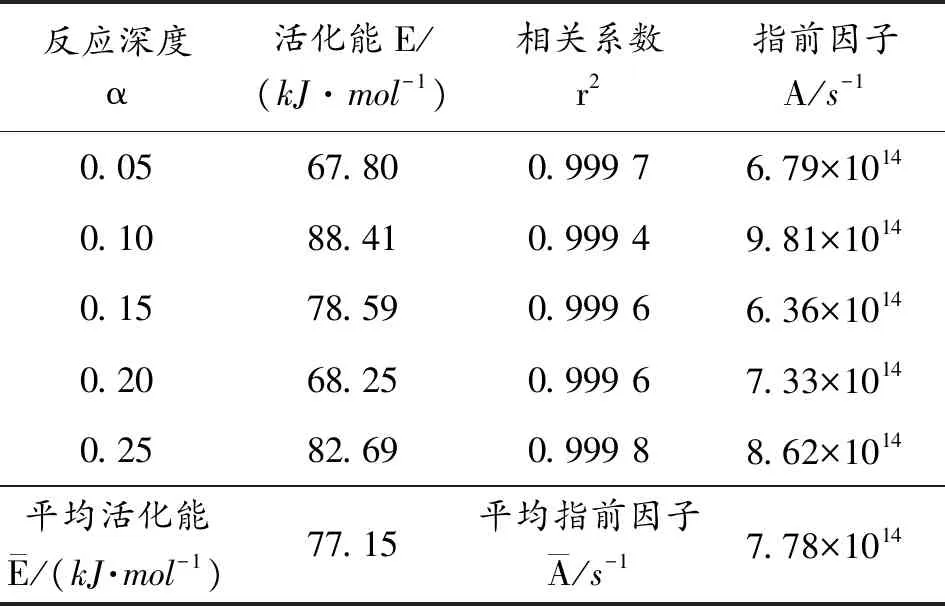
表6 Kissinger法得到的Mg/Ba(NO3)2活化能E、指前因子A和相关系数r2
利用一般积分法,经过迭代法和线性最小二乘法,得到合适的G(α),即G(α)=(1-(2/3)α)-(1-α)2/3,由表6可知,采用一般积分法计算得到的Mg/Ba(NO3)2的活化能E为78.45 kJ·mol-1,指前因子为7.77×1014s-1。由表7 可知,利用Kissinger法得到的Mg/Ba(NO3)2的活化能E为77.15 kJ·mol-1,指前因子为7.78×1014s-1。利用上述的这些参数可以得到Mg/Ba(NO3)2的化学动力学方程:
(8)
3 加速分解温度计算
热爆炸临界温度[13-14]是指延滞期为10 h的药柱发生爆炸(燃烧)的最低环境温度与未发生爆炸(燃烧)的最高环境温度的算术平均值,是含能材料发生热自燃和热爆炸的临界值,可以利用公式(9)计算加热速率趋于零的放热峰值温度TP0,随后通过Zhang-Hu-Xie-Li法[11]以公式(10)求取热爆炸临界温度Tb。
TP=TP0+bβ+cβ2+dβ3
(9)
(10)
式(9)、式(10)中,Tp为不同温升速率β对应的峰值温度(℃);TP0为加热速率趋于零的峰值温度(℃);b、c、d为拟合系数;Tb为热爆炸临界温度(℃)。将表2中的峰温Tp和温升速率β代入式(9)得到相应的拟合曲线:
TP=375.19+1.30β+0.31β2-0.013β3
(11)
因此,Mg/Ba(NO3)2在升温速率趋于零时的峰值温度Tp0为375.19 ℃,代入式(11)得到热爆炸临界温度Tb为391.88 ℃。
自加速分解温度[15]是指一定包装材料和尺寸的反应性化学物质在实际应用过程中的最高允许环境温度,是目前国际上普遍用于评价含能材料热安全性的重要指标之一[16],可以描述一定量的含能材料在生产云水过程中发生热自燃或爆炸的难易程度。通过得到的Mg/Ba(NO3)2的热爆炸临界温度通过公式(12)得到自加速分解温度为375.19 ℃。
(12)
391.88 ℃的热爆炸临界温度,375.19 ℃的自加速分解温度和用各种热力学方程计算得到的活化能与指前因子,都表明了Mg/Ba(NO3)2药剂良好的热安全性。
4 热力学参数计算
根据文献[17],利用得到的活化能和指前因子可以求得,Mg/Ba(NO3)2的活化自由能ΔG≠,活化焓ΔS≠和活化熵ΔH≠:
(13)
ΔH≠=E-RTP0
(14)
ΔG≠=ΔH≠-TP0ΔS≠
(15)
式(13)-(15)中,TP是加热速率趋于零时的外推峰温(K);KB是Boltzman常数,KB=1.380 7×10-23J·K-1;h是plank常数,h=6.626×10-34J·s。
经过计算,Mg/Ba(NO3)2的分解反应活化自由能ΔG≠为28.55 kJ·mol-1,活化焓ΔS≠为120.56 kJ·mol-1,活化熵ΔH≠为73.42 kJ·mol-1。
5 结论
1) Mg/Ba(NO3)2的TG曲线只有一个台阶,DSC曲线中有两个吸热熔融峰,一个放热峰。随着升温速率增加,Mg/Ba(NO3)2的TG曲线起始分解温度的变化不大,但峰温明显增大。DSC曲线中,随着升温速率增加,Mg/Ba(NO3)2的起始分解温度和峰温均升高,在2.5 ℃·min-1时,Mg/Ba(NO3)2的放热起始温度为367.43 ℃,终止温度为390.78 ℃,峰温380.16 ℃;在20.0 ℃·min-1时,Mg/Ba(NO3)2的放热起始温度为390.39 ℃,终止温度为449.88 ℃,峰温421.35 ℃。
2) 利用Flynn-Wall-Ozawa法得到的活化能为81.41 kJ·mol-1,利用Starink法得到的活化能为76.52 kJ·mol-1。通过一般积分法得到的Mg/Ba(NO3)2活化能为78.45 kJ·mol-1,指前因子为7.77×1014s-1。通过Kissinger法得到的Mg/Ba(NO3)2的活化能E为77.15 kJ·mol-1,指前因子为7.78×1014s-1。利用这些参数得到了对应的热分解动力学方程。
3) 将热动力学参数、机理函数相结合,得到了评价Mg/Ba(NO3)2热安全性的参数,即升温速率趋于零时的峰值温度为375.19 ℃,热爆炸临界温度Tb为391.88 ℃,自加速分解温度为375.19 ℃。Mg/Ba(NO3)2的分解反应的热力学参数活化自由能ΔG≠为28.55 kJ·mol-1,活化焓ΔS≠为120.56 kJ·mol-1,活化熵ΔH≠为73.42 klJ·mol-1。

