RVVC致病白假丝酵母菌对小鼠阴道上皮侵袭性及局部免疫的研究
姚福强,卢 伟,祁文瑾
(昆明医科大学第一附属医院产科,昆明 650032)
外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)是由假丝酵母菌引起的阴道黏膜和(或)外阴真菌感染,是妇产科常见的感染性疾病。研究显示,VVC的发生与宿主防御机制及阴道上皮局部免疫功能变化相关[1-2]。上皮细胞在假丝酵母菌刺激下释放多种免疫因子组成复杂的信号网络,在局部免疫应答中起着调控作用[3-4]。细胞介导免疫(cell-mediated immunity,CMI)是阴道局部免疫抵抗假丝酵母菌感染的主要防御机制,其中辅助性T(helper T,Th)细胞及其细胞因子等在抗假丝酵母菌感染中发挥了重要作用[5]。但其确切机制尚不明确,本研究在小鼠阴道上皮细胞体外培养的基础上检测阴道局部免疫因子表达与真菌侵袭力的关系,以期为RVVC的发病机制提供新理论。
1 材料与方法
1.1材料
1.1.1致病白假丝酵母菌 所有致病白假丝酵母菌均来自本院妇产科门诊VVC、RVVC患者。患者均知情同意,研究通过医院伦理委员会批准。VVC、RVVC诊断标准以第8版妇产科学为依据。排除妊娠期、哺乳期、患糖尿病,口服避孕药,3个月内接受过全身抗真菌治疗或1个月内接受过外用抗真菌药物治疗,患免疫性疾病或正在服用免疫抑制剂、混合阴道感染者。
1.1.2实验动物 小鼠购自昆明医科大学SPF动物房,雌性,体质量23~27 g,动物合格证编号:SCXK(滇)K2015-0002。
1.1.3主要试剂 沙堡罗氏培养基(250 g,法国生物梅里埃公司);EpiLife cf kit(500 mL,美国Gibico公司);胎牛血清(500 mL,美国Gibico公司);0.25%胰酶+0.02%EDTA(100 mL,美国HyClone公司);中性蛋白酶Ⅱ(1 g,德国Sigma公司);小鼠IL-8、TNF-α、IL-4 ELISA试剂盒(4 pack,美国Ebioscience公司)。
1.2方法
1.2.1小鼠阴道上皮细胞的原代培养 断颈法处死小鼠,消毒铺巾解剖取出新鲜阴道上皮,用含双抗的PBS清洗后放入含2 U/mL DispaseⅡ中并置于4 ℃冰箱过夜。分离上皮层分割成碎片,用2 mL 0.25%胰酶37 ℃消化15 min,含10%胎牛血清的DMEM/F12终止消化,轻轻吹打2 min吸出细胞悬液过滤,1 000 r/min离心5 min,弃上清液。加EpiLife重悬计数,按每毫升1×106个细胞接种于25 cm2细胞培养瓶,置于37 ℃、5%CO2培养箱培养;48 h首次换液,以后隔天换液,倒置相差显微镜观察细胞生长情况。
1.2.2小鼠阴道上皮细胞传代与铺板、爬片制作 取生长汇合度90%的上皮细胞,1 mL 0.25%胰酶消化,等量含10%胎牛血清的DMEM/F12终止消化,1 000 r/min离心5 min,弃上清液。加EpiLife重悬并计数,按每毫升1×105个细胞接种于明胶处理的24孔板,继续培养;将明胶处理的爬片置于24孔板中,爬片中点上方加2滴细胞悬液,置于培养箱30 min,沿孔边加入1 mL EpiLife,继续培养。
1.2.3致病白假丝酵母菌菌液配置 选取VVC、RVVC致病菌株各6株,复温后挑取单菌落在沙堡罗氏培养基上转种纯化2次,挑取约1 mm单菌落加入1 mL EpiLife中,吹打混匀,计数调整密度为1×106CFU/mL。
1.2.4ELISA检测IL-4、IL-8、TNF-α水平 铺板24 h,换液。实验组加1 mL EpiLife及致病菌悬液各1 mL与上皮细胞继续培养6、12、24、48 h;对照组则以1 mL EpiLife代替菌液。实验组及对照组陪养6、12、24、48 h取上清液以ELISA法检测IL-4、IL-8、TNF-α水平。
1.2.5电镜观察致病菌对上皮细胞的侵袭过程 细胞爬片24 h,换液加1 mL EpiLife及100 μL上述VVC(VVC组)、RVVC(RVVC组)致病菌各1株菌液继续培养6、12、24、48 h;对照组则以等量EpiLife代替菌液。扫描电镜下观察细胞形态学变化。

2 结 果
2.1体外培养小鼠阴道上皮细胞形态学特征 小鼠阴道上皮细胞体外培养传代后,电镜下可见所培养上皮细胞表面布满皱褶微绒毛,呈不规则疏网状,细胞触角细长,细胞边缘连接处,形成清楚的细胞分界线,细胞紧密相连、呈铺石状排列,见图1。

图1 小鼠阴道上皮细胞形态学(扫描电镜×600)
2.2小鼠阴道上皮细胞与白假丝酵母菌共培养后的形态学变化 培养6 h后,VVC、RVVC组细胞微绒毛较对照组减少,部分细胞缩小,胞体变圆凸起呈滴状,少量孢子附着。培养12 h后,VVC组少量孢子附着在细胞周围,细胞间隙增大;RVVC组大量孢子聚集,细胞表面微绒毛减少、消失,部分孢子转化为菌丝。培养至24 h,VVC组细胞被菌丝侵蚀,表面形成孔洞,部分细胞塌陷,胞质外溢,偶见残缺的细胞轮廓和菌丝;RVVC组菌丝穿透细胞膜在细胞内生长,微绒毛消失,细胞萎缩,部分细胞残缺不全,大量菌丝缠绕。培养至48 h,VVC、RVVC组均见大量残缺不全的细胞残骸并缠绕附着成团的菌丝,核中央形成空洞。RVVC致病白假丝酵母菌表现出比VVC致病菌更强的黏附性、穿透性、破坏性,见图2。

A:VVC组6 h(扫描电镜×1 200);B:RVVC组6 h(扫描电镜×1 000);C:VVC组12 h(扫描电镜×400);D:RVVC组12 h(扫描电镜×900);E:VVC组24 h(扫描电镜×900);F:RVVC组24 h(扫描电镜×900);G:VVC组48 h(扫描电镜×1 200);H:RVVC组48 h(扫描电镜×200)
图2两组电镜扫描形态学分析
2.3小鼠阴道上皮细胞与白假丝酵母菌共培养后免疫细胞因子的表达情况 共培养12、24、48 h后,RVVC组IL-4、IL-8、TNF-α水平高于对照组(P<0.05);VVC组IL-4、IL-8水平在共培养12、24、48 h后高于对照组,而TNF-α水平在6、12、24、48 h均高于对照组(P<0.05)。RVVC组IL-8水平在6、12、24、48 h均明显高于VVC组,TNF-α水平在24、48 h高于VVC组,差异有统计学意义(P<0.05),IL-4水平在两组间差异无统计学意义(P>0.05)。培养6、12、24 h后,VVC、RVVC组的IL-8、TNF-α水平均逐渐升高(P<0.05),IL-4水平在共培养6、12、24 h逐渐升高(P<0.05),见表1。
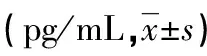
表1 各组小鼠阴道上皮免疫细胞因子浓度
a:P<0.05,与对照组比较;b:P<0.05,与VVC组比较
3 讨 论
成熟的鼠类阴道上皮细胞的培养方法主要有组织块法和酶消化法。本研究采用酶分步消化法[6-7]。DispaseⅡ酶可成功分离上皮组织,具有细胞纯度高、培养周期短的特点,可以快速获得大量活性高的上皮细胞,能够有效排除非上皮细胞的干扰[8-9]。扫描电镜下细胞表面见许多微绒毛和脊样胞质皱褶,符合典型的鳞状上皮细胞特点,体外培养上皮细胞成功。
本研究选取VVC和RVVC的主要致病菌种白假丝酵母菌(占60%~80%[10])为研究对象。作为条件致病菌,假丝酵母菌以酵母相少量存在于阴道中不引起临床症状,当阴道微环境的免疫低下时,酵母相转变为菌丝相并大量繁殖,从而致病[11]。假丝酵母菌对上皮细胞的黏附、穿透、破坏导致了对细胞的侵袭作用,是VVC发生的关键事件[12-13]。结果显示,白假丝酵母菌发芽形成菌丝并黏附于上皮细胞单层,然后上皮细胞吞噬部分菌丝,导致白假丝酵母菌介导的上皮细胞裂解。酵母相发展为菌丝相伴随着对细胞的黏附、穿透,同时细胞被破坏逐渐加重、脱落死亡;RVVC致病菌的转变时间更短、破坏性更强。表明RVVC致病菌的侵袭性强于VVC。
Th细胞包括Th1、Th2等不同的亚型,各自亚型通过表达细胞因子实现免疫应答作用。Th1表达IL-8、TNF-α等,IL-8通过正反馈调节中性粒细胞等活化、聚集,释放出系列活性物质,介导阴道局部的抵抗性免疫反应,以杀菌和抑制细胞损伤[5];同样TNF-α增强中性粒细胞和巨噬细胞的吞噬活性,介导炎症相关免疫应答,增强机体对假丝酵母菌的抗性,清除病原体[14]。Th2分泌IL-4等,作为致病性细胞因子,IL-4响应于假丝酵母菌抑制Th1介导的噬菌作用,增加对假丝酵母菌的易感性[15]。
本研究通过对Th1免疫因子IL-8、TNF-α及Th2 免疫因子IL-4的研究发现,随时间的增加对照组上清液中Th1免疫因子IL-8、TNF-α、IL-4水平呈上升趋势,提示阴道上皮细胞可能是Th细胞免疫因子的重要来源,说明正常阴道上皮细胞在没有外界刺激的情况下也分泌少量免疫因子,发挥防御作用。表明在无法顺利获取人类阴道上皮细胞的情况下,可采用小鼠阴道上皮细胞进行相关研究。在实验组,感染后12 h的IL-8、TNF-α、IL-4水平上升,RVVC组中IL-8在感染中期(12 h)、TNF-α在感染后期(24 h)水平比VVC组升高,表明感染后上皮细胞出现了随时间增强的抵抗性免疫反应,并且RVVC组的抵抗力更强;而Th2代表因子IL-4水平在感染6~24 h随时间上升,但后期(24 h以后)则没有变化,RVVC与VVC组之间IL-4亦无差异,推测IL-4可能仅在感染早期的致病菌易感性中起了一定的作用,但是在RVVC与VVC的致病均易感性中并没有明显区别。
在感染后期,Th1/Th2比值增大,局部Th1占优势,阴道局部表现出对致病菌的抗性,对RVVC致病菌的抗性更强,表明Th1/Th2平衡在阴道局部免疫中具有重要作用;致病菌对上皮细胞的侵袭逐渐加重,RVVC菌株侵袭性更强。由此可见,致病菌侵袭性与阴道局部抵抗性免疫之间相互拮抗的结果和RVVC的演进(即病情好转或加重)息息相关,本研究在小鼠阴道上皮细胞体外培养的基础上,体外构建阴道模型,结合致病菌侵袭力和免疫功能变化,希望为RVVC的发病机制提供新理论,有助于设计更有效的RVVC治疗方式。

