小潮气量不同通气方式在开胸手术单肺通气时的临床疗效
王 雁,杨 渊
(昆明医科大学第一附属医院麻醉科,昆明 650032)
单肺通气可防止血液及分泌物进入健侧肺,并有助于保持手术视野相对开阔,有利于手术各项操作的进行。单肺通气时的低氧血症是一个尚未解决的焦点问题,其发生率大约占胸科手术中的1%[1]。单肺通气时全潮气量通气可能会导致肺泡过度膨胀引起气压伤[2],潮气量过小又可能引起小气道的过早关闭。有研究表明[3],对分侧肺独立实施连续气道正压通气(continuous positive airway pressure,CPAP)/呼气末正压通气(positive end expiratory pressure,PEEP)不仅有利于处理低氧血症和肺不张,更重要的是作为一种肺保护通气策略,有助于防止急性肺损伤。以前的研究多采用降低潮气量增加呼吸频率来维持通气量,但小潮气量复合CPAP和PEEP的研究尚少见报道。本研究观察小潮气量复合PEEP和CPAP在开胸手术单肺通气时气道管理的效果,现报道如下。
1 资料与方法
1.1一般资料 择期行肺叶切除术患者90例,男52例,女38例,麻醉ASA分级Ⅰ~Ⅱ级,平均年龄(51.1±9.3)岁,平均体质量(60.3±9.2)kg。术前心功能正常、肺功能基本正常,平静未吸氧下SpO2≥95%,无贫血、高血压,肝、肾功能正常。纤支镜排除双腔管定位不好者。90例患者分为Ⅰ、Ⅱ、Ⅲ组,每组30例,各组患者一般资料比较差异无统计学意义(P>0.05)。本研究经伦理委员会批准(2016L50),患者及家属知情同意。
1.2方法 患者入室后开放上肢静脉,输入复方电解质10 mL·kg-1·h-1,监测血压、心率(HR)、血氧饱和度、心电图。于局部麻醉下桡动脉穿刺置管并行有创动脉血压监测。麻醉诱导静脉注射芬太尼4 μg/kg、丙泊酚2 mg/kg、维库溴铵0.1 mg/kg。面罩去氮给氧后行气管插管,插入左侧Robetshaw双腔支气管导管(男性F37~39,女性F35~37),纤支镜下定位,固定。连接麻醉机,于手术开始前行双肺全潮气量通气[潮气量(VT) 10 mL/kg,呼吸频率(RR) 12 bpm],吸呼比1∶2,吸入氧浓度100%,氧流量2 L/min。维持用药丙泊酚泵注100~200 μg·kg-1·min-1,瑞芬太尼0.2~0.4 μg·kg-1·min-1,视患者情况追加维库溴铵2 mg,根据手术需求调节麻醉深度。翻侧卧位,纤支镜重新确认支气管导管位置正确。手术开始行健侧单肺通气,吸入氧浓度100%,氧流量2 L/min。Ⅰ组全潮气量单肺通气(VT 10 mL/kg,RR 12 bpm),Ⅱ组小潮气量复合健侧肺PEEP(VT 6 mL/kg,RR 20 bpm,PEEP 5 mm H2O),Ⅲ组小潮气量复合健侧肺PEEP和患侧肺CPAP(VT 6 mL/kg,RR 20 bpm,PEEP 5 mm H2O,CPAP 4 mm H2O),Ⅰ、Ⅱ组单肺通气时未通气侧支气管导管开口放于空气中。术中处理:收缩压降低超过基础值20%或低于90 mm Hg,静脉注入麻黄碱6 mg;HR低于60 bpm,静脉注入阿托品0.3~0.5 mg,必要时可重复给药。
1.3监测指标 连续监测患者心电图、HR、血氧饱和度、气道峰压(peak airway pressure,Ppeak)、有创平均动脉血压(mean arterial pressure,MBP)。并在双肺通气30 min后(T0)、单肺通气30 min后(T1)、恢复双肺通气30 min后(T2),行动脉血气分析,记录动脉血氧分压(partial pressure of oxygen in arterial blood,PaO2)和动脉血二氧化碳分压(partial pressure of carbon dioxide in arterial blood,PaCO2)。记录每组麻黄碱、阿托品等血管活性药物的使用次数比较差异,排除其对HR、MBP的干扰。

2 结 果
T1时点:与Ⅰ组比较,Ⅱ、Ⅲ组患者PaO2和PaCO2明显升高(P<0.05),Ppeak 明显下降(P<0.05),MBP、HR无明显差异(P>0.05);与Ⅱ组比较,Ⅲ组 PaO2明显升高(P<0.05),其余指标差异无统计学意义(P>0.05)。T2时点:3组患者PaCO2、PaO2、Ppeak、HR、MAP差异均无统计学意义(P>0.05);3组患者PaO2较T0时明显下降(P<0.01),见表1、2。3组患者麻黄碱、阿托品使用例次差异无统计学意义(P>0.05)。
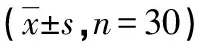
表1 3组患者不同时点PaO2、PaCO2、Ppeak变化
a:P<0.05,与Ⅰ组比较;b:P<0.05,与Ⅱ组比较;c:P<0.01,与T0比较

表2 3组患者不同时点MAP和HR变化
3 讨 论
单肺通气时,全潮气量通气可致气道压力过高,严重压迫肺泡内血管和微小气管,使健侧的血管阻力增大,血液大量分流至患侧,且一侧肺容纳双侧肺的潮气量,极易使气道压过高,导致气压伤,引起肺呼吸功能不全,加重低氧血症。为了防止潮气量过小导致通气不足,小气道提前闭合,笔者在单肺通气时采用小潮气量复合PEEP,PEEP可避免肺泡早期闭合,增加呼气末肺泡的容积,使肺功能残气量增大,改善肺顺应性,防止肺泡塌陷,有利于氧合[4]。但PEEP过大可导致胸内压升高,并且一定程度上增加肺容量,使肺泡小血管受压,增加肺血管阻力,使静脉回流受阻,造成血流动力学紊乱[5]。YSUI等[6]认为5 cm H2O的PEEP可使吸气扩张的肺泡在呼气时不至于萎缩,大大提高了单肺通气时的PaO2,是单肺通气的最佳PEEP。本研究为防止小潮气量肺泡小气道塌陷复合5 cm H2O PEEP。
理论上,单肺通气时改善氧合的理想方式是双肺分别进行PEEP/CPAP,无论血液流经哪一侧肺,均有机会参与肺泡的氧交换。有研究表明[7],萎陷肺的顺应性只有10 cm H2O,5~10 cm H2O的CPAP由于没有潮气量运动,又是小流量低水平压力,患侧肺轻微膨胀仅占50~100 mL空间,并不影响手术操作,还可能有利于叶间裂的解剖。但也有研究[8-9]认为,由于跨肺压是5 cm H2O,CPAP>5 cm H2O会使肺过度膨胀而影响手术。所以本研究中复合4 cm H2O的CPAP。基于BENUMOF等[10]的研究,PaO2在OLV后20 min可以稳定,故选择30 min作为血气分析的期限。
本研究中单肺通气30 min后,与Ⅰ组相比,Ⅱ、Ⅲ组组PaO2明显升高,有效改善围术期患者氧合;而与Ⅱ组比较,Ⅲ组PaO2明显升高,表明复合PEEP/CPAP对改善更氧合更为有效,其机制可能为低水平的CPAP使患侧肺泡保持开放,减少死腔;增加了静止肺容量,增大了肺泡通气。另有研究认为其可降低肺内分流[9,11]。而同时单肺通气30 min后,与Ⅰ组相比,Ⅱ、Ⅲ组PaCO2也明显升高,虽然单肺通气时通气血流比会不匹配,但总的分钟通气量不变。由于CO2具有较高的扩散能力,加之PEEP的作用使呼气末小气道开放,有利于CO2的排出。且本研究选取患者体质量均大于50 kg,避免了死腔量较大低体质量病例,所以PaCO2仍处于临床允许范围内。单肺通气30 min后,与Ⅰ组相比,Ⅱ、Ⅲ组Ppeak明显下降,减少了发生气压伤的危险,这体现了Ⅱ、Ⅲ组使用了小潮气量通气的优势;MBP、HR无明显差异,表明5 cm H2O PEEP对血流动力学影响不大,这可能是小量PEEP使肺泡复张同时肺血管重新开放,使肺血管容量增加,有利于右室功能的改善,使血流动力学的影响达到最小。
麻醉过程中肌松药的使用导致呼吸肌群失去支持张力,胸腔容积出现改变,膈肌向头侧移动,功能残气量和肺顺应性明显降低,这使肺泡更易塌陷不张,导致肺内分流和通气-血流比例失调,引起低氧血症。现已证实,这些改变不仅发生于术中,术后早期仍持续存在[12]。且单肺通气、手术操作、缺血缺氧、缺血/再灌注均对肺有损伤,所以恢复双肺通气30 min,3组PaO2较初始双肺通气30 min后明显下降。
张光明等[13]给予3~5 cm H2O的CPAP,发现可以有效减少白细胞介素8 mRNA和1β的表达水平,抑制炎性反应,提示对患侧肺有一定的保护作用。但恢复双肺通气30 min后,3组PaO2差异均无统计学意义,这并未证明小潮气量复合PEEP/CPAP对术毕PaO2的影响,这可能与本研究术前肺功能较好,单肺通气时间较短,尚未形成差异有关。
总之,小潮气量复合PEEP/CPAP的通气方式有利于改善氧合,降低气道压,且对血流学没有明显影响,可能有利于减少术后低氧血症的发生。但如何采取更佳的通气模式,减少低氧血症的发生,实现更好的肺保护作用,尚需进一步研究。

