弗氏柠檬酸杆菌临床株对碳青霉烯类耐药的分子机制研究
董丹丹,刘真真,李笃军,张 会,赵 辉,贾 楠,朱元祺*
(1.青岛大学医学院,山东 青岛266071;2.青岛大学附属医院 检验科;3.山东烟台业达医院 检验科)
碳青霉烯类抗生素是一类抗菌谱广、抗菌活性强的β-内酰胺类抗生素,对 Amp C酶和超广谱β-内酰胺酶高度稳定,是临床抗感染的最后一道防线。但近几年,碳青霉烯类耐药的革兰氏阴性菌在全球范围内逐年增多,给临床治疗带来了挑战[1,2]。弗氏柠檬酸杆菌是柠檬酸杆菌属最常见的分离株,也是医院感染中常见的革兰氏阴性杆菌。因此,我们对2012年4月-2018年5月分离的12株耐碳青霉烯类弗氏柠檬酸杆菌的耐药表型、耐药基因和同源性进行研究,为医院感染的预防和采取控制措施提供理论依据,现报道如下。
1 材料和方法
1.1实验菌株资料12株耐碳青霉烯类的弗氏柠檬酸杆菌(CFR1-CFR12)于2012年4月-2018年5月分离自住院患者。病人年龄11-80岁,平均54岁。菌株鉴定和药敏试验为梅里埃Vitek-2 Compact系统。药敏使用GN13卡,并依据CLSI-M100(2018)标准判定结果。blaKPC和blaNDM阳性对照菌株为本室保留。药敏质控菌株为ATCC35218、ATCC700603、ATCC25922和ATCC27853。
1.2仪器设备和试剂脉冲场凝胶电泳仪和PCR扩增仪为美国BIO-RAD公司;凝胶成像系统为美国Alpha Innotech公司;核酸分子量标准和PCR试剂等为宝生物(大连)工程有限公司。
1.3耐药基因检测PCR检测菌株产碳青霉烯酶、超广谱β-内酰胺酶和质粒介导的AmpC酶耐药相关基因。PCR扩增耐药基因的引物序列及方法参照文献[3]。生工(上海)生物技术有限公司完成引物合成和扩增产物测序。
1.4脉冲场凝胶电泳脉冲场凝胶电泳的方法、结果解释参照文献[3,4]。电泳条件:转换角度120°,场强6V/cm,转换时间1-20秒,电泳时间为19 小时。依据Dice系数和UPGMA聚类,使用BioNumerics(7.6)软件对脉冲场凝胶电泳进行分析。
2 结果
2.1菌株的药敏和携带的耐药基因
除了CFR-6 和CFR-10这两株菌仅对氨曲南敏感外,12株弗氏柠檬酸杆菌对其他β-内酰胺类抗生素都耐药,且多数菌株对氨基糖苷类、喹诺酮类和磺胺甲恶唑/甲氧苄啶抗菌药物也表现出耐药。PCR扩增和测序表明:12菌株中的每一株都携带多个耐药基因,且分别携带blaKPC-2(4/12,33.3%)、blaNDM-1(6/12,50%)和blaIMP-4(2/12,16.7%)耐药基因;除了碳青霉烯酶耐药基因外,每一株还同时携带不同亚型的blaCMY基因。菌株信息、药敏和耐药基因检测结果详见表1-2和图1-3。
2.2菌株的脉冲场凝胶电泳和聚类分析
脉冲场凝胶电泳聚类分析显示12株弗氏柠檬酸杆菌之间有75.8%-89.6%的相似度,其中CFR11和CFR12分离株相似度89.6%,CFR2、CFR7和CFR10之间相似度85.0%-87.3% ,但依据病例资料、Tenover规则和流行病学“三间”分布特征,判定这12株弗氏柠檬酸杆菌之间不存在克隆聚集性,即为散发克隆。菌株相似度聚类分析详见图4。
3 讨论
碳青霉烯酶是一类能水解碳青霉烯类抗生素的β-内酰胺酶。依据Ambler 分类,包括A、B和D三类。其中,A和D类为丝氨酸酶,B类为金属酶(MBL)。产碳青霉烯酶是菌株对碳青霉烯酶类抗生素耐药的主要原因。blaKPC-2是A类中最常见的类型。国内ST11型和国外ST258型肺炎克雷伯菌是携带blaKPC-2基因最常见的医院感染分离株[1,5,6]。B类金属酶中以blaNDM和blaIMP为主。其中,前者代表菌是以肺炎克雷伯菌和大肠埃希菌为主[5],后者是第一个最早被发现的金属酶(MBL,IMP-1),主要见于铜绿假单胞菌。但近几年,IMP在肠杆菌中检出逐年增多。D类酶主要是blaOXA-48,我国目前报道较少[6]。
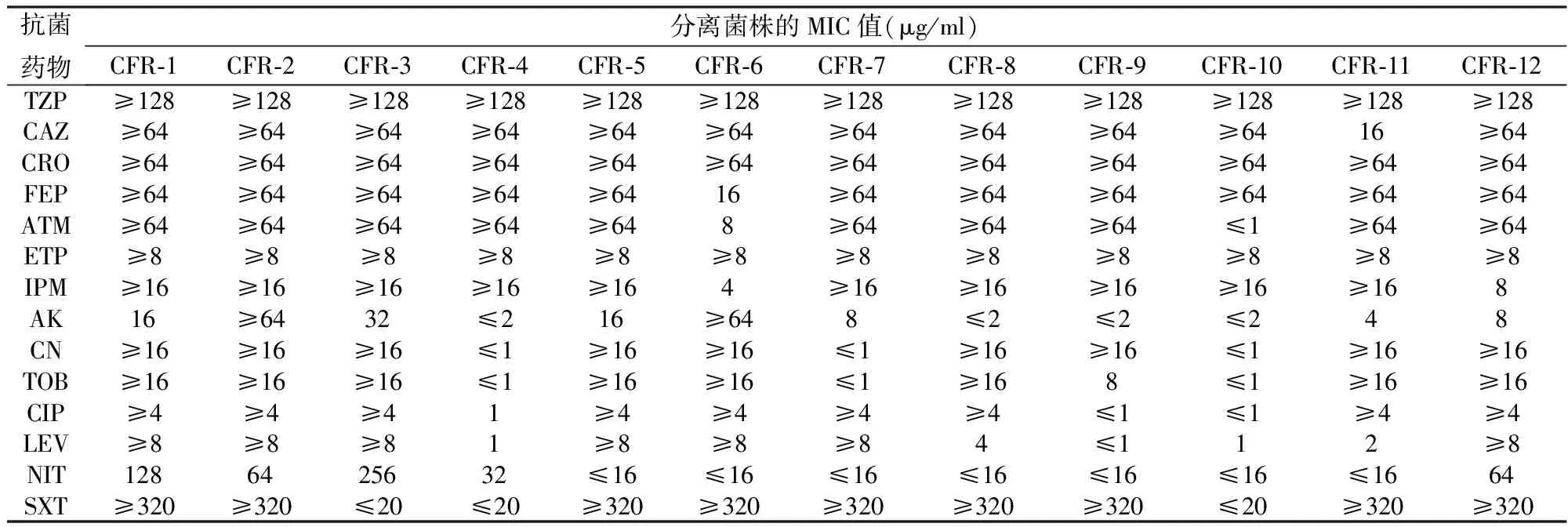
表1 12株弗氏柠檬酸杆菌对常用抗菌药物的药敏结果
注:TZP(哌拉西林/他唑巴坦),CAZ(头孢他啶),CRO(头孢曲松),FEP(头孢吡肟),ATM(氨曲南),ETP(厄他培南),IPM(亚胺培南),AK(阿米卡星),CN(庆大霉素),TOB(妥布霉素),CIP(环丙沙星),LEV(左氧氟沙星),SXT(磺胺甲恶唑/甲氧苄啶)
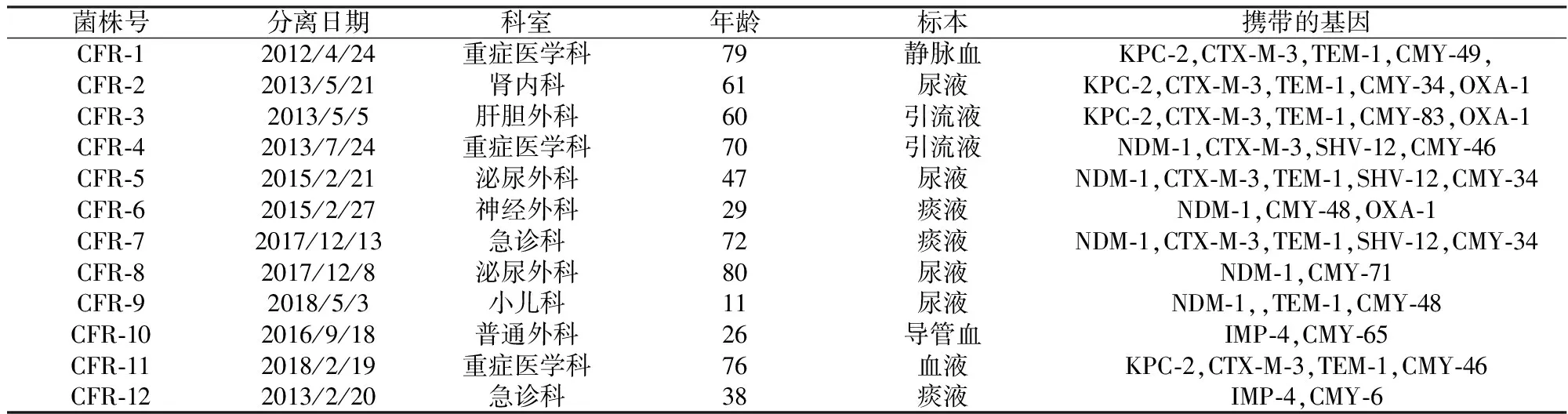
表2 12株弗氏柠檬酸杆菌携带的耐药基因

M:DNA分子量标准;Lane1-12:CFR-1-12菌株;N:阴性对照;P:blaKPC阳性对照

M:DNA分子量标准;Lane1-12:CFR-1-12菌株;N:阴性对照;P: blaNDM阳性对照
M:DNA分子量标准;Lane1-12:CFR-1-12菌株;Lane13:阴性对照
研究显示,12株弗氏柠檬酸杆菌对β-内酰胺类、氨基糖苷类和喹诺酮类抗生素呈现多重耐药,并携带多个耐药基因。其中,携带blaKPC-2、blaNDM-1和blaIMP-4分别为33.3%(4/12),50%(6/12)和16.7%(2/12)。除了携带碳青霉烯酶耐药基因外,每一株菌还携带属于AmpC酶中的blaCMY基因,且呈现不同的亚型,如blaCMY-6、blaCMY-34、blaCMY-46、blaCMY-48,blaCMY-49和blaCMY-83。另外,携带blaKPC-2基因的弗氏柠檬酸杆菌分离株同时存在blaCTX-M-3和blaTEM-1基因,这三个基因是否存在于一个质粒上,有待于进一步证实。

注:依据Dice系数和UPGMA聚类构建系统进化树,基因组相似比例见左侧树状图。Key1-12:弗氏柠檬酸杆菌CFR1-CFR12菌株。
目前,国内外已有报道在弗氏柠檬酸杆菌中检测到菌株携带碳青霉烯酶耐药基因。Arana在西班牙2013-2015年分离的柠檬酸杆菌属中检测到多种碳青霉烯酶耐药基因,包括VIM-1,OXA-48,KPC-2,NDM-1和VIM-2基因[7]。国内Feng 报道[8],分别携带KPC-2和NDM-1的质粒共存于一株弗氏柠檬酸杆菌中,这增加了细菌耐药的复杂性。在柠檬酸杆菌中,碳青霉烯酶耐药基因blaIMP很少检出,仅有Xiong于2016年报道一株携带blaIMP-4的弗氏柠檬酸杆菌[9]。
对碳青霉烯类耐药的肠杆菌科细菌检出增多与抗菌药物的不合理使用、侵入性操作和住院时间延长等因素有关[10]。12株耐碳青霉烯类的弗氏柠檬酸杆菌分离自不同年龄(11-80岁)住院患者、不同的标本和分布于多个科室。标本来源包括血液(3株)、痰液(3株)、尿液(4株)和引流液(2株),其中无菌体液占较大比例(9/12)。上述表明,引起弗氏柠檬酸杆菌对碳青霉烯类抗生素耐药原因复杂,呈现多样性,应引起临床注意。由于是回顾性研究,尽管结合患者的病例资料、脉冲场凝胶电泳聚类分析数据和流行病学判定这12株之间不存在克隆聚集性,但是,我们不能进一步查找感染源和感染途径,这有待于以后的研究。
综上所述,我们研究显示携带blaKPC-2、blaNDM-1和blaIMP-4耐药基因是这12株弗氏柠檬酸杆菌对碳青霉烯类耐药的主要机制,并以产金属碳青霉烯酶为主(8/12,66.7%)。因此,有必要进一步加强对碳青霉烯类抗菌药物的管理和重视对肠杆菌科细菌的耐药监测。

