酶凝与酸凝牦牛乳硬质干酪成熟期间质量特性的比较
张义全,梁琪,赵春燕,吴晗,宋雪梅,张炎
(甘肃农业大学食品科学与工程学院,甘肃省功能乳品工程实验室,甘肃 兰州 730070)
牦牛乳功能性营养成分(氨基酸、酪蛋白和免疫球蛋白)含量较高,是一种优质的乳品[1-2],也是干酪加工的优质乳源[3].凝乳是干酪生产的关键环节之一.干酪成熟过程中伴随着复杂的生物化学变化,酸凝与酶凝是两种不同的促进凝胶形成的方法[4],会影响干酪的质构特性和风味.传统干酪的生产多是以酶凝方式为主,需要动物性凝乳酶,如小牛皱胃酶等,但这些酶资源短缺,价格昂贵.酸凝干酪可以不添加凝乳酶,通过直接添加酸化剂使牛乳发生凝结而制得干酪,其生产工艺简单,成本较低,风味清新,适合中国人的口味[5].
Breene等[6]首次通过酸凝法生产Mozzarella干酪.Quarne等[7]研究了不同酸化剂和凝乳酶对农家干酪的出品率、感官品质以及蛋白质降解的影响.Ralph[8]首次通过感官分析评价了酸凝Mozzarella干酪.马玲等[9]和马杨等[10]研究了酸凝干酪成熟期间理化特性的变化.综上所述,国内外对酸凝干酪品质特性的研究较多,但鲜见酸凝牦牛乳硬质干酪的研究报道,并且酸凝和酶凝牦牛乳硬干酪的对比性研究也较少.
本试验以酶凝和酸凝牦牛乳硬质干酪为研究对象,通过对其感官品质、质构特性、理化特性以及苦味肽分子量分布的测定,揭示不同凝乳方式(酶凝和酸凝)的牦牛乳硬质干酪在成熟过程中质量特性差异,对影响酸凝和酶凝干酪成熟期品质的因素进行系统分析,旨为改进牦牛乳硬质干酪成熟期品质提供理论参考.
1 材料与方法
1.1 材料与仪器
新鲜牦牛乳:采自甘肃省天祝藏族自治县抓喜秀龙乡;混合发酵剂:嗜热发酵剂(嗜热链球菌、保加利亚乳杆菌)与嗜温发酵剂(乳酸乳球菌乳酸亚种、乳酸乳球菌乳脂亚种)按1∶1组成,均来自丹麦丹尼斯克公司;微生物凝乳酶:酶活为1.95×104SU/g,甘肃华羚生物技术研究中心;Sephadex G-25葡聚糖凝胶(色谱纯)美国GE公司;细胞色素C、抑肽酶、氰钴胺素VB12、氧化性谷胱甘肽均为标准品.
1.2 仪器与设备
Scientz-ND真空冷冻干燥机(宁波新芝生物科技股份有限公司);SBS-100数控计滴自动部分收集器(上海青浦沪西仪器厂);SBS-100蛋白纯化层析系统和组分收集器(上海青浦沪西仪器厂);TA.XT Express质构仪(美国FTC公司).
1.3 方法
1.3.1 干酪的制作 新鲜牦牛乳→过滤→检验→巴氏杀菌(63 ℃,30 min)→冷却(35 ℃)→添加发酵剂(0.006 25 g/L)→添加CaCl2(0.3 g/L)→添加凝乳酶(100.9 U/mL)/添加乳酸(切割pH值达到4.6)→35 ℃凝乳→切割→45 ℃二次加热→排乳清→搅拌、加盐(用量为凝块的2%)→35 ℃堆酿(30 min)→压榨成型(4~5 h)→真空包装→成熟[11].
1.3.2 操作要点 1)新鲜牦牛乳:选用理化、微生物指标合格,无抗生素的牦牛鲜乳.2)杀菌:采用巴氏杀菌,在62~65 ℃保温杀菌30 min.
3)添加发酵剂:将杀菌乳冷却至35 ℃左右,添加1%食盐水,配制成相应浓度的发酵剂,使原料乳产酸.
4)添加氯化钙:在干酪生产过程中添加0.3 g/L氯化钙,可提高干酪凝块的质构,并抑制原料乳中的杂菌.
5)添加凝乳酶/乳酸:加入氯化钙10 min以后,向酶凝干酪中添加由1%的食盐水溶解,在35 ℃活化30 min的微生物凝乳酶;向酸凝干酪中添加适宜浓度的乳酸,使pH值达到4.6,促进凝乳.
6)凝块切割、搅拌和加热:凝块达到一定硬度后,切割成立方体小块,轻微搅拌,使凝块颗粒悬浮在乳清中,使乳清分离,加热可使凝块颗粒稍微收缩,有利于乳清从凝块中排出.
7)加盐:待排出乳清后,向其中加入2%的食盐.
8)堆酿:为提高干酪质地,堆酿2 h.
9)压榨:促使干酪中的乳清进一步排除,并让干酪具备一定的组织状态.
10)真空包装:干酪成品用LDPE袋进行真空包装.
11)成熟:将制作的新鲜干酪在10 ℃条件下分别成熟0、30、60、90、120、150、180 d.
1.3.3 干酪感官品质的评定 感官评定方法参照GB 5420-2010的方法并改进.随机抽取成熟第0、30、60、90、120、150、180 d干酪样品,在25 ℃下放置1 h后.组成经过培训筛选的10人评定小组,采用100分制,从色泽(20%)、组织状态(30%)、滋味和气味(50%)进行质量感官评定.具体评价标准见表1.

表1 牦牛乳硬质干酪质量评定标准
1.3.4 干酪苦味值的测定 参照Emmons等[12]的方法测定.评定小组由经培训筛选的18人组成(男女比例为1∶1,均为不吸烟者),评定员用蒸馏水漱口后,取适量干酪样品置于口中5~10 s后吐出.用不同浓度的硫酸奎宁(0,2.9×10-3,5.8×10-3,1.2×10-2和 2.4×10-2mmol/L)作为参照物.0分表示完全无苦味;0~1.0分表示非常轻微苦味(包括1分);1.0~2.0分表示轻微苦味(包括2分);2.0~3.0分表示中等苦味(包括3分);3.0~4.0分表示强苦味(包括4分);4.0~5.0分表示非常强苦味(包括5分).
1.3.5 干酪质构品质的测定 参照孙彩玲等[13]的方法测定.样品制备:测试样品的尺寸为10 mm×10 mm×10 mm,在室温(25±2)℃下平衡1 h后进行质构测试.质构参数:探头类型为P/50,测试前速率为5.0 mm/s,测试中速率为1.0 mm/s,测试后速率为5.0 mm/s,下压变形为50%,触发力为0.2 N.
1.3.6 干酪出品率测定 参照任娟[14]的方法,将牦牛乳干酪压榨完后称质量,根据干酪原料乳质量与干酪质量计算干酪出品率.

为了更加准确地比较2种牦牛乳硬质干酪的出品率,将干酪的实测出品率校正到水分含量为45%时再进行计算.

1.3.7 干酪水分含量的测定 根据GB 5009.3-2010中直接干燥法进行水分含量测定.
1.3.8 干酪苦味肽的分离纯化
1.3.8.1 干酪苦味肽的提取 参照Konstantinia等[15]的方法.将成熟120 d的酶凝和酸凝牦牛乳硬质干酪真空冻干,分别取50 g干酪切成碎片,加入150 mL蒸馏水用小型均质机高速搅拌2~15 s,然后通过Whatman.No 1滤纸抽真空过滤,在4 ℃下放置30 min除去脂肪.将沉淀物用100 mL和50 mL的蒸馏水两次抽提.然后在水层中加入无水乙醇,调整其最终浓度达到60%,除去蛋白质.在4 ℃下低速搅拌1 h,在10 000 r/min离心30 min,除去不溶物.取上清液旋转蒸发除去水和乙醇,浓缩液真空冷冻干燥备用.
1.3.8.2 干酪苦味肽的分离纯化 将提取的干酪苦味肽配制成20 mg/mL,采用Sephadex G-25凝胶渗透层析分离纯化.分离条件为凝胶柱1.6 cm×70 cm;上样量1 mL;洗脱液为蒸馏水;流速为0.5 mL/min;紫外检测仪在波长280 nm处进行检测,以保留时间为横坐标,洗脱液吸光值为纵坐标绘制洗脱曲线.收集组分峰,冷冻干燥备用.
1.3.8.3 干酪苦味肽分子量分布的测定 将分子量已知的标准品:氧化性谷胱甘肽(600 u)、氰钴胺VB12(1 302 u)、抑肽酶(6 512 u)、细胞色素C(12 500 u)、卵清蛋白(43 000 u)分别溶于Tris-HCl缓冲溶液(pH8.0)中,将上述真空冻干蛋白质配制成浓度为2 mg/mL的标准品溶液.将4种标准品溶液混合均匀,抽取混合样品溶液1 mL上样,紫外检测仪在波长280 nm处进行检测.以标准品分子量的对数为纵坐标,保留时间为横坐标绘制标准曲线,标准曲线见图1.
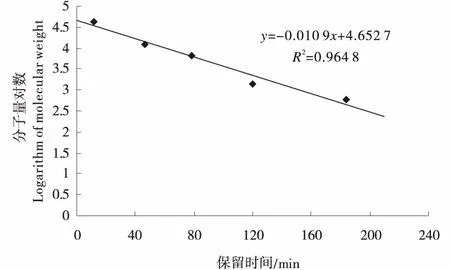
图1 分子量标准曲线Figure 1 Standard curve of molecular weight
将干酪苦味肽进行层析分离,确定出峰时间,通过分子量标准曲线,将样品峰的保留时间代入回归方程y=-0.010 9x+4.652 7,计算干酪苦味肽分子量分布.用峰面积归一化法,确定不同分子量范围苦味肽的相对百分含量.
1.3.8.4 干酪不同分子量苦味肽苦味值测定 测定方法同1.3.4.
1.4 数据分析
试验每个处理重复3次,采用Orign8.0软件分析数据并作图.
2 结果与分析
2.1 酸凝和酶凝干酪感官评分
由图2可知,在整个成熟过程中,酶凝与酸凝干酪的感官评分均呈先升高后降低的趋势,并且在90 d时感官品质都达到最佳.酶凝干酪风味浓郁,组织状态好,苦味重;酸凝干酪由于没有添加凝乳酶,其蛋白质降解程度小,色泽均匀,呈乳白色,滋气味清淡,有适宜的乳香味和乳酸味,但其组织状态松散,凝块无弹性易碎,因此其总体感官评分较低.
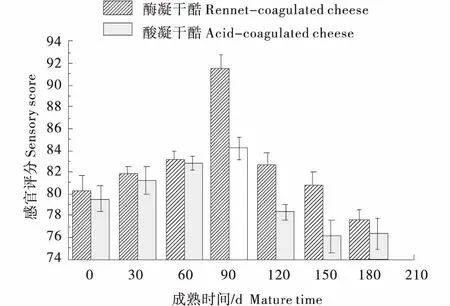
图2 酶凝与酸凝干酪感官评定Figure 2 Sensory evaluation of rennet-coagulated and acid-coagulated cheese
2.2 酸凝和酶凝干酪苦味值差异
从图3可以看出,随着成熟时间的延长,酶凝与酸凝干酪的苦味值呈先升高后下降的趋势,并且都在120 d时苦味达到最大值,分别达到3.1(强苦味)和1.9(轻微苦味).成熟期0 d时,两种干酪的苦味值均为0;在成熟30 d时,酸凝干酪苦味值仍为0;随着成熟时间的增加,在30~180 d内,酶凝干酪的苦味值始终高于酸凝干酪,说明凝乳酶对干酪苦味形成的影响很大.

图3 酶凝与酸凝干酪苦味值评价Figure 3 Bitter value of rennet-coagulated and acid-coagulated cheese
2.3 酸凝和酶凝干酪质构品质的差异
2.3.1 硬度 硬度反映干酪对变形抵抗的程度.由图4可知,随着成熟时间的延长,酶凝和酸凝干酪的硬度呈先增大后减小的趋势,在成熟90 d时均达到最大值,分别为13.01 N和6.28 N.在整个成熟期,酸凝干酪的硬度始终小于酶凝干酪,主要是因为酸凝干酪在凝结时本身水分含量较高,干酪蛋白质分子中包含较多的结合水所致.90 d后干酪硬度发生下降,主要是因为成熟中期酶凝干酪蛋白质降解程度较大,使酪蛋白的凝胶网状结构被破坏,干酪中的部分结合水进入干酪蛋白分子中,从而使干酪的硬度逐渐减小.
2.3.2 弹性 由图5可知,随着成熟时间的延长,酶凝和酸凝干酪的弹性呈先增大后减小的趋势,在成熟90 d时均达到最大值,分别为0.78和0.47.在整个成熟期,酶凝干酪的弹性值始终大于酸凝干酪.这主要是由于适宜的水解可使干酪高度交联的酪蛋白微胶束表现出较高的抗变形能力,体现出较高的弹性.随着干酪的进一步水解,干酪长链结构蛋白不断变短,直至酪蛋白网状结构坍陷交融,干酪的弹性减小[16].
2.3.3 黏着性 黏着性反映了咀嚼时干酪对上腭、牙齿、舌头等接触面的黏性大小.干酪黏着性值的负号代表测试探头受到的作用力方向向下,与大小无关.由图6可知,在整个成熟期,两种干酪的黏着性呈无规律的变化趋势,在成熟中后期(即90 d以后)两种干酪的黏着性下降,适口性较好.
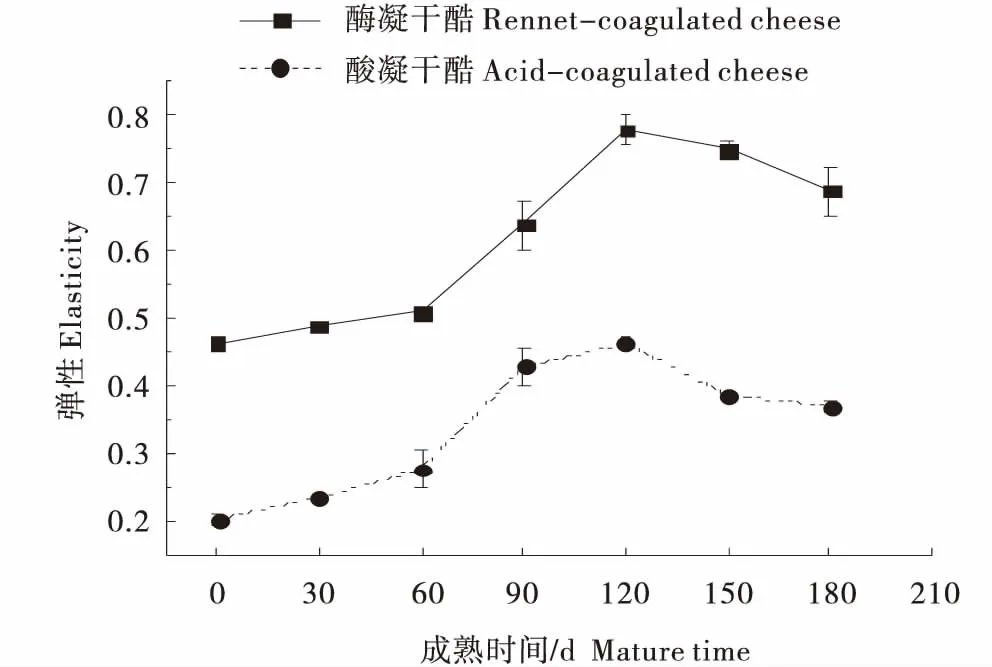
图5 酶凝与酸凝干酪的弹性Figure 5 Elasticity of rennet-coagulated and acid-coagulated cheese

图6 酶凝与酸凝干酪的黏着性Figure 6 Adhesiveness of rennet-coagulated and acid-coagulated cheese
2.4 酸凝和酶凝干酪理化性质的差异
2.4.1 出品率 将干酪水分调整到45%,采用校正出品率进行比较,可忽略干酪中水分含量的影响.从表2可知,酶凝干酪校正出品率为22.87%,酸凝干酪校正出品率为19.44%.
2.4.2 水分含量 水分不仅影响干酪出品率,对干酪品质也有显著影响.由图7可知,酶凝和酸凝干酪水分含量在整个成熟期均呈逐渐下降的趋势,由于干酪采用真空包装,因此其水分含量降低程度很小,分别下降了0.73%、1.01%.在成熟0 d时,酶凝干酪水分含量为41.44%,酸凝干酪的水分含量为46.12%,高于酶凝干酪.说明凝乳酶在干酪生产过程中可促进乳清的排出,而在成熟过程中,虽然酸凝

表2 酶凝与酸凝干酪的出品率

图7 酶凝与酸凝干酪的水分含量Figure 7 Moisture content of rennet-coagulated and acid-coagulated cheese
干酪有较低的蛋白水解能力,但其较差的网状结构导致较多的水分析出.
2.5 酸凝和酶凝干酪苦味肽分子量的分布
2.5.1 酶凝干酪苦味肽的分离 由图8可知,成熟120 d的酶凝干酪中提取的苦味肽经Sephadex G-25凝胶层析分离,得到4个大的组分峰,分别编号为A1,A2,A3,A4.由图8可看出,在选定条件下层析分离时干酪苦味肽出峰较多且峰距适中,提取肽的分离效果较好.将4种组分的出峰保留时间代入标准曲线回归方程,测得相应分子量,并分别收集各组分峰,测定酶凝干酪不同分子量苦味肽的苦味值.

图8 酶凝干酪苦味肽葡聚糖凝胶层析谱图Figure 8 Glucan gel chromatography spectrum diagram of rennt-coagulated cheese bitter peptide
2.5.2 酶凝干酪苦味肽分子量分布及苦味的测定 由表3可知,酶凝干酪成熟120 d时,其苦味肽分子量分布大约在428~3 908 u,其中2 466~3 908 u、1 386~2 249 u和663~1 352 u这3段苦味肽分子量范围占到了总量的79.24%,并且表现出较强烈的苦味值,是酶凝干酪成熟120 d时苦味形成的重要贡献者.低分子量肽段(428~648 u)由于苦味肽疏水性片段的进一步降解,生成较多的游离氨基酸,因此其苦味值相对其他3种组分低.

表3 酶凝干酪苦味肽分子量分布及苦味值
2.5.3 酸凝干酪苦味肽的分离 由图9可知,成熟120 d的酸凝干酪中提取的苦味肽经Sephadex G-25凝胶层析分离,得到4个大的组分峰,分别编号为C1,C2,C3,C4.由图9看出,在选定条件下提取肽的分离效果较好.将4种组分的出峰保留时间代入标准曲线回归方程,测得相应分子量,并分别收集各组分峰,测定酸凝干酪不同分子量苦味肽的苦味值.
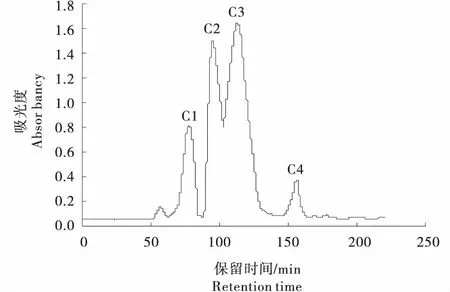
图9 酸凝干酪苦味肽葡聚糖凝胶层析谱图Figure 9 Glucan gel chromatography spectrum diagram of acid-coagulated cheese bitter peptide
2.5.4 酸凝干酪苦味肽分子量分布及苦味值的测定 由表4可知,酸凝干酪成熟120 d时,其苦味肽分子量分布大约在1 127~9 375 u,其中4 487~5 395 u、2 249~3 564 u这两段苦味肽分子量范围占到了总量的65.44%.分子量2 249~3 564 u的苦味肽表现出一定的苦味值,是成熟120 d酸凝干酪苦味形成的重要贡献者.由于酸凝干酪中没有添加凝乳酶,使其蛋白质降解程度和苦味值均小于酶凝干酪.

表4 酸凝干酪苦味肽分子量分布及苦味值
3 讨论
本试验结果表明,酸凝干酪产率低,水分含量高,滋气味较好,苦味值低于酶凝干酪,组织状态,硬度、弹性较差.凝乳酶是凝乳过程中的关键酶,其主要作用是促进牛乳的凝结,便于乳清析出,对干酪成熟过程中良好的质地与口感形成有重要影响.然而,酶凝干酪在成熟过程中残留的凝乳酶对蛋白质的降解依然难以控制,易降解过度,导致干酪产生苦味物质、过于浓郁的风味或其他不良风味.因此,干酪加工生产过程中,凝乳酶添加量过高,会使干酪产生苦味,影响干酪风味及质地,这与García等[17]研究发现相似.
牦牛乳中干物质含量高,凝乳性能良好,出品率可达到20%左右[18].发酵剂中乳酸菌会利用原料乳中乳糖产生大量乳酸,为凝乳酶创造较好的凝乳条件,有利于凝块的收缩并加速乳清排出,因此干酪水分含量低,出品率高[19].只用乳酸对原料乳进行凝固不易形成干酪优良的蛋白质网状结构,致使形成的凝块也比较松散无弹性,用小刀切割过程中易破裂,排出乳清时易损失,因此酸凝干酪产率较低[20].试验中干酪采用真空包装,成熟过程中干酪水分含量呈现略微降低的趋势,这与高婉伟等[21]的研究结果一致.Topcu等[22]曾发现Kasar干酪中苦味肽分子量在500~4 000 u和200~700 u.本试验中酶凝与酸凝牦牛乳硬质干酪产生的苦味主要是500~5 000 u的疏水性多肽所引起的,这与Lee等[23]关于苦味肽的分子量分布研究结果基本一致.酶凝干酪苦味肽分子量小于酸凝干酪苦味肽分子量,说明凝乳酶对苦味肽的降解程度较大.
4 结论
1) 酸凝牦牛乳硬质干酪组织状态松散,质构欠佳,但色泽均匀,滋气味清淡,苦味值低.
2) 酶凝牦牛乳硬质干酪校正出品率高,水分含量较低,质构品质较好,说明凝乳酶的添加有利于凝块的收缩并加速乳清排出,干酪产率较高.
3) 干酪成熟120 d时,酶凝牦牛乳硬质干酪中酪蛋白的降解更加充分,且降解产生的苦味肽苦味值较强烈;酸凝牦牛乳硬质干酪中苦味肽分子量较大,且苦味肽的苦味值较低.

