玉扇组织培养研究
安佰义,贾博雅,丁晓丽,刘晓嘉,包文慧
(吉林农业大学园艺学院,吉林长春 130118)
玉扇(Haworthia truncata)是百合科十二卷属具有代表特征的植物,因其特殊的观赏价值多用于观赏性栽培与繁殖。该属植物主要通过播种和叶插进行繁殖,但播种受环境约束较大,对环境温度、湿度都有要求,且播种繁殖有些性状难以稳定遗传;叶插成活率较低,且培育时间较长,产量较低,对母本易造成损伤,因此其新品种苗供应速度较慢,生产速度较为滞后。
近年来关于玉扇的研究较少[1-3],且缺乏全面性。本试验以玉扇的叶片和花茎作为外植体,采用正交试验法,挑选最适宜激素配比方案,以提高繁殖系数,定向选取生长途径和缩短繁殖周期,为该种植物的扩大生产和今后研究提供依据。
1 材料与方法
1.1 材料
取种植于吉林农业大学园艺学院教学实验基地的3年实生玉扇植株,取其健壮、无病虫害叶片及花茎为外植体。
1.2 方法
1.2.1 外植体的消毒处理 取玉扇叶片和花茎为外植体,用自来水冲洗30 s,然后在超净工作台上用分别用75%乙醇浸洗30 s,无菌水冲洗3次,然后0.1%氯化汞分组处理3、5、7、10 min,无菌水冲洗5次,或直接用0.1%氯化汞分组处理3、5、7、10 min,无菌水冲洗5次。
1.2.2 启动培养基成分及培养条件 将灭菌处理过的外植体接种到含有0.1 mg/L 6-BA和0.1 mg/L NAA的启动培养基中,基础培养基为MS,添加9.5 g/L琼脂,3%蔗糖,pH值为5.8~5.9之间。1周后观察外植体的灭菌及生长情况,统计污染率和褐化率。前期培养条件为(25±2)℃,光照度约为40μmol/(m2·s),光源为荧光灯,光照时间为12 h/d。后期栽培条件为温度(25±2)℃,给予日光光照。
1.2.3 增殖培养基成分 将经过启动培养的外植体接种在添加不同浓度组合的植物激素配比的培养基上,基础培养基为MS,采用L16(43)正交试验设计,其中6-BA(细胞分裂素)浓度为0、1、2、3 mg/L,NAA(萘乙酸)浓度为0、0.1、0.3、0.5 mg/L,KT(激动素)浓度为0、0.5、1、1.5 mg/L,20 d后观察愈伤及不定芽分化情况。将生长状况良好的愈伤继续转入正交设计培养基中,50 d后观察、记录愈伤组织分化情况。
1.2.4 根的诱导 将单个不定芽接种在添加不同蔗糖、活性炭和不同浓度激素组合的培养基上,基础培养基为1/2MS,采用正交设计L9(34),其中NAA浓度为0、0.5、1.5 mg/L,(吲哚丁酸)浓度为0、1.5、3 mg/L,蔗糖添加量为10、30、50 g/L,活性炭添加量为0、5、7 g/L,观察并记录根的分化过程,分析后选出最优生根培养基。
1.2.5 炼苗及移栽 选择根健壮的组培苗,将其培养瓶的瓶盖逐渐打开,在瓶内加入无菌水,防止试管苗污染,待温室内温度达22~26℃时,将组培苗移入温室内炼苗。采用泥炭土∶蛭石∶珍珠岩=2∶1∶1(体积比)为基质,经过炼苗处理后均匀插入移栽的基质中。培养温度:(24±2)℃,相对湿度70%,给予自然光照。
1.2.6 数据统计 采用Excel 2007和SPSS 17.0对数据进行处理分析,对试验结果进行方差分析和相关性分析。
污染率=污染的外植体数/接种外植体数×100%;
褐化率=褐化的外植体数/接种外植体数×100%;
成活率=存活的外植体数/接种外植体数×100%;
愈伤组织诱导率=形成愈伤组织的外植体数/接种的外植体总数×100%;
愈伤组织分化率=分化出新芽的愈伤组织块数/接种的愈伤组织总块数×100%;
出芽率=萌生丛芽的外植体数/未污染的外植体数×100%;
生根率=生根的芽数/接种的芽总数×100%。
2 结果与分析
2.1 最佳消毒处理的筛选
由于取材部位的不同,不同植物器官的耐受性也有所差异,因此本试验针对不同取材部位进行了分类研究,将进行分组消毒灭菌处理的外植体接种在启动培养基上,15 d后观察其污染、褐化情况,得出结果(表1)。
采用75%乙醇、0.1%氯化汞对玉扇的叶片、花茎进行8组不同的时间的处理,结果发现,不同灭菌试剂的选用及处理时长,对叶片和花茎的影响均不相同。当氯化汞处理时间为10 min时,组8花茎污染率最低,为1.3%,同时组4也出现了最高的褐化率48.3%,在使用30 s乙醇处理的前提下,氯化汞处理5~7 min时,花茎的污染率、褐化率较低,为玉扇花茎的最佳灭菌处理方案。综合组3、4、7、8可以看出,叶片在氯化汞处理7~10 min时出现了较低污染率,但在氯化汞处理10 min时,褐化率最高,为46.3%。因此,当选用选用乙醇处理30 s、氯化汞处理7~10 min时,叶片存活率较高,污染率和褐化率均较低。使用75%乙醇与0.1%氯化汞共同处理外植体可以明显降低外植体的污染率,并降低褐化率。

表1 不同灭菌处理对外植体的影响
2.2 增殖培养基的筛选
将经过启动培养的外植体分别接入16个正交培养基中,根据实际生长情况,可以采用诱导愈伤组织和直接诱导不定芽2种方式进行增殖培养,分别统计其愈伤组织诱导率、出芽率和愈伤组织分化率(表2)。
由图1、图2可知,外植体接入培养基,叶片的启动时间较花茎晚4~5 d,20 d左右在花茎和叶片伤口附近开始产生白色的小型颗粒物(图1-A、图1-B),并且很快分化为不定芽或愈伤组织,但此时常伴有褐化现象,应及时更换新的培养基将材料转移,并将褐化部分进行切除,防止已生愈伤组织退化。花茎取材部位含有花蕾时,花蕾迅速膨大,并在膨大处产生较多不定芽和愈伤组织(图1-C)。因此,在16组培养基中根据外植体初始反应的差异,基本分为直接生成不定芽(图2-A、图2-D),生成愈伤组织(图2-C、图2-F)和不定芽与愈伤组织同时产生(图2-B、图2-E)3种生长途径。不同生长途径对生产培育的指导意义不同,生成愈伤途径有助于植株及品种的扩繁,生成不定芽途径有助于快速生产和一步成苗等技术的研究。将16组玉扇不同部位愈伤组织诱导率、出芽率和愈伤组织分化率进行极差分析,结果见表3。
2.2.1 愈伤组织诱导 随着6-BA浓度的变化,不同培养基内产生的愈伤组织也发生了变化。当6-BA浓度为3.0 mg/L时,花茎产生的愈伤组织较多,但颜色多为黄白色,适当地降低6-BA浓度,花茎的愈伤组织多为黄绿色,且较饱满;当6-BA浓度过高时,叶片的愈伤组织生长状况较差,且出现玻璃化现象,适当加入KT可以减少并有效抑制6-BA浓度较高所引起的玻璃化现象。2种外植体在加入KT和低浓度NAA时都可以得到较好的愈伤组织诱导的效果,愈伤组织饱满且颜色更为翠绿。
就愈伤组织诱导率的极差分析可以看出6-BA浓度是对愈伤组织诱导率影响最大的因素,这与试验结果相同。根据各因素极差大小顺序,并结合试验情况,得出花茎的最佳愈伤组织诱导培养基为MS+1.0 mg/L 6-BA+0.1 mg/L NAA+0.5 mg/L KT,叶片的最佳愈伤组织诱导培养基为MS+0.3 mg/L NAA+0.5 mg/L KT。
2.2.2 不定芽诱导 当花茎取材部位含有花蕾时,大部分花蕾在6-BA浓度较高时仍然可以直接分化为大量的不定芽。由表3可知,3种因素对出芽率的影响顺序依次为6-BA浓度>KT浓度>NAA浓度。将玉扇不同部位愈伤组织诱导率、出芽率进行方差分析,可知6-BA浓度、NAA浓度、KT浓度这3个因素均显著影响玉扇的愈伤组织诱导率和出芽率(P=0<0.05)。综合试验结果和极差分析可知,花茎出芽率最高的培养基选择为MS+0.1 mg/L NAA+0.5 mg/L KT,叶片出芽率最高的培养基为MS+1.0 mg/L 6-BA+0.3 mg/L NAA+1.0 mg/L KT。选用叶片作为外植体时,当培养基中6-BA的浓度与NAA比值趋近1∶2时,外植体更易优先产生粗壮的根系(图3-A),然后从根系上诱导出大量黄白色愈伤,一段时间后黄白色变绿,愈伤组织变亮,与叶片直接产生的愈伤基本一致,并能快速分化成不定芽(图3-B)。
2.2.3 愈伤组织分化 将直接诱导生成的不定芽转至生根培养,花茎和叶片所产生的愈伤组织经过增殖培养后进入分化阶段,花茎所产生的黄白色团状愈伤体积增大且颜色愈加翠绿(图3-C),与叶片生成的愈伤组织形态趋近,构成愈伤组织的颗粒顶端逐渐膨大并开始出现不定芽的分化,颗粒底部则聚合在一起形成白色块状物(图3-D)。待颗粒顶端分化出不定芽形态后,应及时对底部的白色块状物进行切割,每块保留3~4个不定芽,以利于不定芽的继续生长(图3-E);若切割不及时,不定芽易产生畸形,且分化的叶片偏细长。不定芽的分化及生长状况受3种激素共同调节影响,本试验选用6-BA、NAA和KT 3种激素搭配,并进行筛选,发现3种激素组合使用愈伤分化效果最佳。从对愈伤组织分化率的极差分析和方差分析中可以看出,不同激素对愈伤分化率的影响大小为6-BA>NAA>KT,综合愈伤组织分化率各因素的极差大小(表3)可知,MS+1.0 mg/L 6-BA+0.1 mg/L NAA+0.5 mg/L KT为玉扇愈伤组织分化最佳培养基。
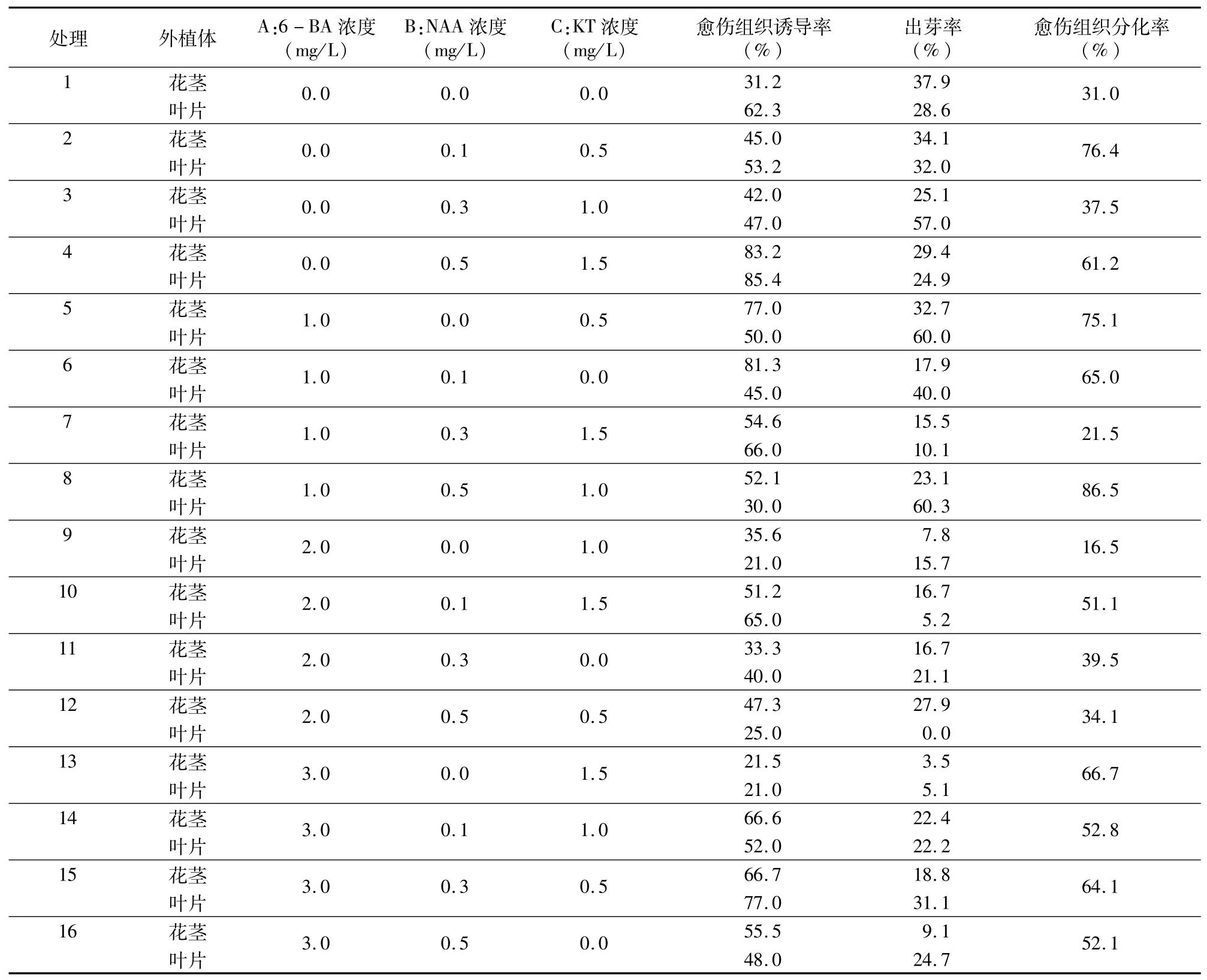
表2 玉扇不同部位愈伤组织诱导率、出芽率和愈伤组织分化率

2.3 最佳生根培养基的筛选及移栽
本试验在前期预试验中发现,各激素配比浓度相同条件下,选用1/2MS为基础培养基比用MS所产生的新根更健康,植株更饱满,因此试验选取了1/2 MS为基础生根培养基。
将已成功培养的2种植物不定芽分别接种在9种不同的正交培养基中,统计其生根率、生根株数及不定根生长情况(表4)。添加活性炭的处理组生根状况明显优于未添加活性炭的处理组,适当调节NAA与IBA的浓度可以使植株更加饱满,且生根效果更好(图5-F)。
从玉扇生根率的极差分析(表5)可知,4种因素的极差值大小依次为活性炭添加量>IBA浓度>NAA浓度>蔗糖,活性炭对生根诱导影响最大。由生根率的方差分析(表6)可知,NAA、IBA和活性炭浓度这3种因素与生根率均呈显著相关,其中活性炭浓度F值最高,达到极显著水平,这与极差分析结果一致。综合分析可以得出生根的最优培养基,为1/2MS+0.5 mg/L NAA+3.0 mg/L IBA+10 g/L蔗糖+7 g/L活性炭,活性炭添加量是生根培养的关键影响因子。选用最佳生根培养基进行生根诱导,所产生的根系健康,炼苗后转入栽培基质中,移栽成活率可达80%以上。
3 结论与讨论
在外植体的选择上,选取叶片作为外植体,其出菌率约为花茎的4倍,选取内轮新叶作为外植体比老叶出愈率、出芽率高,且继代次数的胚性也较老叶强,这与何佳越等对同科属植物玉露的外植体选取研究结论[4]相同。本研究发现,选取花茎作为外植体时,带花蕾的部分更易直接诱导产生不定芽,且不定芽长势良好,株型美观,成活率较高。熊丙全等应用根的横切片作为外植体,在较短时间内获得了玉扇成株[5],本研究中一些叶片作为外植体时会先产生粗壮的根系,并可从根系进一步发育,因此可以认为当选取根茎横切片作为外植体进行组培体系建立时耗时最短。
针对褐化现象,在后期试验中选取在培养基内培养了20、50 d的叶片与生长在原生境的玉扇叶片,用Filion酚法[6]对3种取材进行酚类化合物总含量进行测定,发现3种材料酚类化合物含量差别微弱,分别为15.07、15.58、14.01 mg/100 g,因此可以初步排除褐化是因为酚类化合物氧引起的,但具体原因还有待进一步研究。


表4 不同对照组对生根诱导的影响

表5 玉扇生根率的极差分析

表6 玉扇生根率的方差分析

表7 玉扇不同阶段最适宜诱导培养基
经过研究分析,本试验得出玉扇不同阶段最适宜诱导培养基(表7)。6-BA的添加对愈伤组织分化有显著影响,这与王燕等对寿锦的组培研究结果[7]一致。根据6-BA添加的不同浓度和与其他激素的组合可以使外植体向产生愈伤和产生不定芽2种生长途径定向发展,生成愈伤途径有助于植株及品种的扩繁,生成不定芽途径有助于快速生产和一步成苗等技术的研究,这为该植物在后期的研究和生产扩繁中提供了参考,且选用直接诱导出芽途径,所产生的不定芽外形美观,植株饱满,成活率高,更大程度上继承了母本的一些形态特征,耗时较短。
在生根诱导过程中,发现活性炭的添加对根系的生长尤为重要。已发表的玉扇组培体系研究[1-3]中,得出最佳生根培养基为MS+0.1 mg/L NAA浓度,并未见活性炭成分的添加,且本试验将NAA浓度、IBA、蔗糖和活性炭进行了组合筛选,得到了较为高效的生根诱导培养方案。
玉扇作为百合科十二卷属的精品代表植物,市场价格一直居高不下,对于玉扇组培体系的研究虽有过报道,但在激素的选择和配比上却不尽完善,商品化生产的组培苗品质参差不齐。本试验通过总结该属其他植物及玉扇已报道过的激素配比与外植体选择,将激素浓度、配比选取不同的外植体进行全面的筛选与研究,最终得出较好的激素组合方案,所培育的组培苗植株饱满,耗时较短,成活率高。调节6-BA浓度从而对不同的生长途径进行调控,有利于从不同方向对种苗进行产业化推广,这对玉扇的规模化生产具有指导意义,也为该植物的组培快繁及科学研究提供了参考。

