一株牦牛源屎肠球菌对小鼠肠道微生物、形态和免疫功能的影响
杨运南, 杨昌福, 刘亚楠, 罗 璠, 字向东, 高彦华
(青藏高原动物遗传资源保护与利用教育部重点实验室,西南民族大学生命科学与技术学院,四川成都610041)
现代畜牧业正面临过度依赖抗生素使用而导致的抗生素残留、细菌耐药性增强和环境承载力降低等难题(陈振等,2017),益生菌作为饲用抗生素替代物拥有安全、环保等特点。益生菌饲喂动物后,能够改善肠道形态结构、调节肠道免疫和改善微生物菌群(谯仕彦等,2014;王永等,2013)。因此,益生菌的分离及其功能的研究一直是饲用抗生素替代物研究领域的热点。
屎肠球菌是一种产乳酸菌(LAB),其在动物体内有调节肠道菌群、肠道形态与黏液层以及肠上皮细胞免疫功能(谯仕彦等,2014)。王永等(2013)研究发现,屎肠球菌可以显著促进盲、结肠中乳酸杆菌的增殖,并且可显著抑制仔猪结肠中大肠杆菌的增殖。方伟等(2017)研究发现,添加不同剂量的屎肠球菌对仔猪肠绒毛高度、隐窝深度以及绒毛隐窝比存在不同程度的影响。李雨宸(2015)研究发现,乳酸菌定植肠道后可以增强小鼠上皮细胞抗菌肽Reg3γ的分泌,刘丹等(2008)研究发现,益生菌能明显降低结肠炎小鼠结直肠黏膜TNF-α的表达。丁爽等(2017)研究发现,屎肠球菌B13可提高断奶仔猪免疫力和日增重,说明肠球菌作为一种乳酸菌,具有促进动物肠道免疫,改善肠道健康的效果。
本课题组前期在牦牛肠道黏膜中分离出一株高产乳酸菌素肠球菌G2,乳酸菌素效价能为17.47×105IU/mL,并且具有广泛抑菌活性,对酸具有较强的耐受性(张艳,2013)。目前关于牦牛肠黏膜源益生菌对健康动物肠道菌群、形态和免疫功能的影响研究较少。因此,本研究将以小鼠为研究对象,探讨屎肠球菌G2对健康小鼠肠道微生物、形态与肠道免疫功能的影响,为进一步将屎肠球菌G2开发成为益生菌制剂,替代饲用抗生素使用提供基础数据。
1 材料与方法
1.1 试验菌株 屎肠球菌G2由西南民族大学生命科学与技术学院提供,本实验室保藏。取保种菌液10μL平板划线,37℃恒温培养后,挑取单菌落于37℃,200 r/min条件下培养,重复2~3次,至恢复活力。再挑取单菌落于3 mL M17培养基中,37℃,200 r/min培养16~18 h,混匀后得109cfu/mL的屎肠球菌G2菌液。菌液经由80℃水浴60 min灭活,12000 r/min离心2 min去上清,重悬于M17培养基中即得热灭活菌液。
1.2 试验动物及饲养管理 7周龄雌性C57BL/6小鼠[体重(18.1±0.470)g,SPF级]24只,购于成都达硕实验动物有限公司。小鼠饲养于恒温、恒湿、清洁、无特殊病原体,室温18~22℃,湿度45%~65%环境中,标准小鼠繁殖料购于成都达硕实验动物有限公司,试验期间所有小鼠自由摄入无菌饮用水及饲料,定期更换垫料。随机分为3个处理组,每组8只,分别为对照组(CON组)、热灭活菌组(EHK组)与活菌组(ENT组)。CON组、EHK组和ENT组小鼠分别按照0.1 mL/只剂量灌胃M17肉汤、109cfu/mL热灭活菌液、109cfu/mL屎肠球菌G2菌液。试验期共计14 d,前7 d为适应期,后7 d为正式试验期。正式试验期第1、2、4、6天对小鼠按分组进行灌胃处理,每只小鼠每日9:00灌胃1次,第1、3、5、7天无菌收集小鼠粪便,对粪便乳酸菌总数进行菌落计数。第8天,对小鼠进行屠宰,收集肝脏、脾脏样品,计算器官指数。收集结肠末端组织样品、小鼠结肠内容物,液氮速冻,-80℃保存。收集结肠末端样品,10%中性甲醛固定,用于制作石蜡切片。
1.3 检测指标及方法
1.3.1 肠道微生物数量 试验期间收集小鼠粪便,按照GB 4789.2-2010方法对小鼠粪便中产乳酸菌总数进行菌落平板计数。试验结束后,无菌收集小鼠结肠内容物,用粪便基因组DNA提取试剂盒(天根生化科技有限公司,DP328)提取结肠内容物DNA,采用实时荧光定量PCR法测定肠球菌、乳杆菌和大肠杆菌的数量(高彦华,2014)。引物序列见表1,绝对定量反应体系包括:2×SG fast mix 5.0μL,上游引物0.2μL(10μmol),下游引物0.2μL(10μmol),模板1μL,加PCR-Grade Water至10μL。定量反应程序:95℃3 min;95℃3 s;退火30 s;40个循环。将Ct值带入标准曲线计算得到各细菌基因拷贝数。荧光定量PCR标准曲线的建立包含:质粒重组、重组质粒浓度检测、质粒拷贝数确定、质粒拷贝数与Ct值之间建立线性关系。绝对定量PCR的检出限为:乳球菌104~1010拷贝,乳杆菌104~1010拷贝,大肠杆菌102~109拷贝。

表1 实时荧光定量引物序列
1.3.2 肠道形态 试验结束时,断颈法处死小鼠并称重。无菌采集小鼠远端结肠肠段,10%中性甲醛处理过夜,制作苏木精-伊红(H&E)染色石蜡切片。按照M.Wlodarska(2011)的方法对切片进行肠道病理学评分,包括对肠腔坏死上皮存在的情况、表面上皮的增生及上皮细胞剥离情况、黏膜杯状细胞数量及隐窝增生情况和黏膜下层水肿情况进行评定。
1.3.3 肠道免疫因子 肠道抗菌肽胰岛再生源蛋白(Reg3γ,Reg3β)、细胞因子肿瘤坏死因子-α(TNF-α)、黏蛋白(MUC2)采用实时荧光定量PCR法进行检测。TRizol法提取小鼠结肠组织RNA,1%琼脂糖变性凝胶电泳验证RNA完整性。按照RevertAid First Strand cDNA Synthesis Kit(赛默飞世尔科技(中国)有限公司)方法反转录获得cDNA。反应体系同1.3.1,采用GAPDH作为内参基因,目的基因及内参基因引物序列见表2。采用2^(-△△Ct)方法计算得到基因的相对表达量。
1.3.4 器官指数 按以下公式计算器官指数与脏器指数:

表2 实时荧光定量引物序列
器官指数=(肝脏重+脾脏重)/体重×100;
脏器指数=脏器重/体重×100。
1.4 数据统计分析 采用SPSS 18.0中One-Way ANOVA对各组之间的差异进行单因素方差分析,采用T检验对两组之间的差异进行分析,差异显著性水平为P<0.05。
2 试验结果
2.1 屎肠球菌G2对肠道微生物的影响 试验期间小鼠粪便中乳酸菌总菌平板计数结果显示(图1),在试验的第3、5天,ENT组乳酸菌总菌数量显著高于CON组与EHK组(P<0.05),CON组与EHK组菌落数差异不显著(P>0.05)。
同时对结肠内容物中肠球菌、乳杆菌和大肠杆菌的数量进行荧光定量PCR检测,发现各组之间肠球菌、乳杆菌和大肠杆菌的数量(图2)差异不显著(P>0.05)。

图2 屎肠球菌G2对小鼠结肠内容物细菌数量的影响
2.2 屎肠球菌G2对小鼠结肠形态的影响 对屎肠球菌G2各处理组小鼠结肠形态的H&E染色切片进行病理学评分,结果见图3,肠道病理学评分总分各处理组之间差异不显著。ENT组杯状细胞数量大于CON组与EHK组,但差异并不显著(P>0.05)。CON组隐窝深度显著小于ENT组(P<0.05),说明屎肠球菌G2可以显著影响小鼠结肠隐窝深度。

图3 结肠病理学评分
2.3 屎肠球菌G2对小鼠器官指数的影响 小鼠器官指数的结果见表3。小鼠器官指数的结果表明,试验各组器官指数无显著性差异(P>0.05);相同的,小鼠肝脏指数、脾脏指数各组间均不存在显著性差异(P>0.05)。
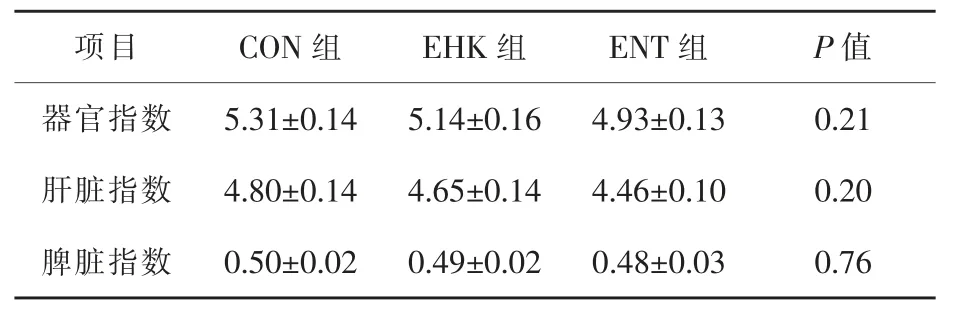
表3 屎肠球菌G2对小鼠器官指数的影响
2.4 屎肠球菌G2对小鼠肠道免疫功能的影响如图4所示,小鼠结肠抗菌肽Reg3β和Reg3γ基因mRNA表达量各组之间差异不显著(P>0.05)。ENT组TNF-αmRNA的表达水平显著低于CON组(P=0.024),表明灌胃屎肠球菌G2菌液一定程度上有缓解小鼠体内炎症反应的作用。
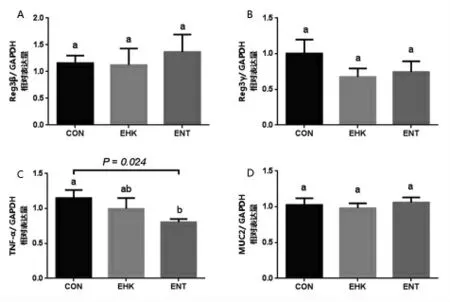
图4 肠道免疫因子的表达
3 讨论
3.1 屎肠球菌G2对小鼠肠道微生物的影响 研究发现,益生菌可以影响肠道菌群的组成及其丰度,提高有益菌的含量降低有害菌,其作用途径主要是菌膜屏障,分泌抑菌素和有机酸以抑制有害菌的生长,与有害菌竞争黏附位点等(谯仕彦等,2014;王永等,2013)。候成立等(2011)研究发现,在断奶仔猪基础日粮中添加植物乳酸杆菌可以增加乳酸菌的数量,显著降低大肠杆菌的数量。方伟(2017)也得到相似结果。董晓丽(2013)研究发现,枯草芽孢杆菌B27对断奶仔猪粪便中乳酸菌、芽孢杆菌数量无显著性影响,但大肠杆菌数量显著降低。本研究发现,对健康小鼠灌胃肠球菌活菌能够显著增加小鼠肠道益生菌乳酸菌的数量,但随着时间的推移,肠道乳酸菌的数量又会回归到正常水平,结肠内容物中肠球菌、乳杆菌和大肠杆菌的数量没有显著改变。以上结果说明,屎肠球菌G2只能在短暂时间内增加肠道益生菌乳酸菌的数量,而对肠道有害菌大肠杆菌的数量没有影响,这表明屎肠球菌G2符合过路菌的特征,其不具备持续影响肠道菌群结构的能力,即屎肠球菌G2并未在小鼠肠道中定植或并未形成优势菌群,故对健康小鼠肠道菌群的构成无显著影响。
3.2 屎肠球菌G2对小鼠肠道形态的影响 研究表明,乳酸菌有助于改善肠道结构,提高动物机体消化和吸收效率。粪肠球菌等乳酸菌能够降低肉鸡的肠道隐窝深度,促进肉仔鸡小肠绒毛生长(王利红,2014;徐基利,2011)。王晓成(2017)研究发现,益生菌能显著降低小鼠隐窝深度。本研究发现,灌胃肠球菌活菌或热灭活菌对健康小鼠的肠道病理学方面没有产生显著影响,灌胃肠球菌活菌能增加小鼠肠道杯状细胞的数量,但不存在显著性。而在结肠隐窝深度方面,灌胃屎肠球菌活菌显著增加了健康小鼠的隐窝深度。隐窝深度与肠上皮细胞的增殖和凋亡两个过程的速率有关系。隐窝变深可能是肠上皮细胞增殖速率加快,凋亡速率变慢,使细胞熟度增加、细胞分泌能力增强(王晓成,2017;李雨宸,2015)。因此,屎肠球菌G2有可能会增强肠黏膜上皮的分泌功能。Yan等(2007)研究发现,益生菌产生的可溶性蛋白能间接作用于结肠上皮细胞,抑制上皮细胞凋亡,促进上皮细胞生长,促使隐窝加深。因此,屎肠球菌G2促进小鼠肠道隐窝加深的机理仍有待验证。
3.3 屎肠球菌G2对小鼠肠道免疫功能的影响肝脏不仅仅是一个消化代谢的器官,还是一个重要的免疫器官,含有丰富的免疫细胞(闫蕾等,2009),脾脏是机体最大的免疫器官,肝、脾器官指数可以反映机体的免疫水平。关于益生菌对动物机体器官指数影响的报道不尽相同,唐志刚(2010)研究发现,肉鸡日粮中添加益生菌可以显著提高肉鸡的脾脏指数。朱惠(2016)研究发现,牦牛源肠球菌Swun3对小鼠脏器指数无显著影响。本试验结果表明,灌胃屎肠球菌活菌对健康小鼠器官指数、肝脏指数有一定程度的影响但不显著。造成这一差异的原因可能与试验所用菌种和施加剂量不同有关。
肠道不仅仅是消化吸收营养物质的器官,同时具有内分泌和免疫的功能(邹立军等,2017)。益生菌对肠道免疫因子的分泌有不同程度的影响。肠免疫系统受到刺激后,肠相关淋巴组织能分泌免疫球蛋白、白介素等分子来维持肠道环境的稳态(谯仕彦等,2014)。这其中胰岛再生源蛋白(Reg)、肿瘤坏死因子(TNF-α)与黏蛋白(Mucin)在肠道黏膜免疫中发挥着重要的作用。Reg与肠道炎症的发生有着紧密的联系(李雨辰,2015)。李雨辰(2015)研究表明,乳酸菌可以增强肠道上皮细胞Reg3γ的分泌,且一定剂量的乳酸菌干预结肠炎小鼠可以缓解小鼠体内的炎症水平。TNF-α主要由单核-巨噬细胞产生,是典型的促炎因子。黄怡(2012)研究发现,断奶前仔猪灌服屎肠球菌EF1可以显著增加空肠黏膜TNF-α表达量,并且能显著降低回肠黏膜TNF-α的表达量。MUC2由肠道杯状细胞分泌,是肠道中最丰富的黏蛋白,可以抑制病原微生物的黏附定植(谯仕彦等,2014;杨利娜等,2014)。Reg3β与Reg3γ是小鼠肠道抗菌肽,在炎症状态下表达量显著增加以起到抑制炎性反应的作用。本试验结果中,灌胃屎肠球菌G2活菌对健康小鼠抗菌肽Reg3β和Reg3γ表达量没有影响,说明肠球菌G2对肠道无免疫刺激的作用。而促炎因子TNF-α表达量显著降低,表明肠球菌G2能一定程度缓解炎症,增强健康小鼠肠道黏膜免疫耐受作用,具备益生特性。试验处理各组小鼠黏蛋白MUC2表达量不存在差异,这与结果中所涉及的杯状细胞数量各组差异不显著的结果相符。综上所述,牦牛肠黏膜来源屎肠球菌G2能在一定程度上降低健康小鼠肠道炎性反应水平,并具备促进肠道健康的益生效果。结肠抗菌肽Reg3β、Reg3γ和黏蛋白MUC2在短期急性试验中并没有表现出明显的差异,可能屎肠球菌G2在炎症模型小鼠身上会有较好的益生表现,这方面仍需后续试验继续验证。
4 结论
牦牛肠黏膜源屎肠球菌G2在短期灌胃后能显著增加小鼠肠道乳酸菌总菌的数量,增加肠黏膜隐窝深度,并降低肠道促炎性细胞因子TNF-α的mRNA表达水平,在一定程度上具有改善肠道形态和促进肠道健康的作用。

