Y染色体微缺失人群中Y-STR等位基因缺失模式分析
王燕超,马晓燕,孙筱放,冼嘉嘉,李少英,何文智,王晓蔓,黎青
Y染色体微缺失人群中Y-STR等位基因缺失模式分析
王燕超,马晓燕,孙筱放,冼嘉嘉,李少英,何文智,王晓蔓,黎青
广州医科大学附属第三医院妇产科研究所实验部,广东省普通高校生殖与遗传重点实验室,广州 510150
Y染色体短串联重复序列(Y-short tandem repeats, Y-STRs)已被广泛应用到DNA检验领域。然而,由于Y染色体存在较高的结构突变率,可能会导致部分Y-STR等位基因丢失甚至产生特殊的缺失模式,从而影响其在法医学中的应用。位于Y染色体长臂的无精子症因子(azoospermia factor,)与精子发生有关,该区域微缺失可导致不育症。然而Y染色体微缺失人群是否存在特殊的Y-STR缺失模式仍有待研究。本文利用法医学上常用17个Y-STR探讨了85例Y染色体微缺失患者的Y-STR缺失模式。结果显示,单纯区缺失样本,均存在基因座无效扩增情况;单纯区或单纯区缺失样本存在基因座无效扩增;复合区缺失样本存在基因座无效扩增;复合区缺失样本存在基因座无效扩增。因此,本研究结果提示Y-STR缺失模式与Y染色体微缺失有对应关系。
Y染色体微缺失;缺失;Y-STR等位基因缺失;不育症
人类Y染色体第二代遗传标记——Y染色体短串联重复序列(Y chromosomal short tandem repeats, Y-STRs )在DNA检验中已被广泛应用[1,2]。特别是对于男女混合检材,Y-STR可以帮助研究者区分样本中的男性个体,因而成为个体识别的有效手段。 2003年,美国ABI公司推出的AmpFSTR@YfilerTM荧光标记复合扩增系统,可实现同步扩增检测17个Y-STR基因座,该技术已得到广泛认可和应用[3]。无精子症因子(azoospermia factor, AZF)编码基因位于Yq11,且与精子发生相关[4,5]。该基因序列被分为4个(、、和)亚区[6~8],包含与精子发生有关的一系列基因[9~11]。且视缺失区域的不同,可引起不同程度的精液质量下降[12~15]。基于STR技术的性别判断基因(amelogenin Y)含有2个等位基因座(和),位于Xp22.1-22.3,位于Yp11.2[16,17],目前均已被广泛应用到人类商业化试剂盒中。研究发现,部分Y-STR和基因表现出等位基因“丢失”(无效扩增)现象,这种等位基因“丢失”现象与Y染色体部分缺失有密切关系[18~21]。同时,基因“丢失”现象,与某些特定的Y-STR无效扩增同时发生[20,22]。然而由于样本的多样性、取材过程的不确定性和实验过程的复杂性(如样本DNA降解、含量极低和扩增技术等),实验本身可能得到“不完整”的Y-STR分型结果。因此,这些特殊的基因型将会限制Y-STR的应用和干扰实验室的数据解读,同时影响了法庭科学DNA检验在此类遗传缺陷人群中的应用。本研究分析85例AZF基因缺失患者的Y-STR基因座缺失类型,为此类遗传缺陷人群的遗传标记缺失提供科学解释,以期帮助DNA检验实验室对异常数据做出正确的解读和判断。
1 材料与方法
1.1 研究对象
收集2016年3月~2018年3月于本院就诊的男性不育症患者抗凝血85例。纳入标准:(1)经Y染色体微缺失试剂盒检测存在AZF区域缺失的男性不育患者。排除标准:(1)感染性梗阻性无精子症;(2)特发性低促性腺激素性性腺功能减退症。所有参与者均签署知情同意。
1.2 基因组DNA提取
采用Qiagen微量DNA提取试剂盒(Qiagen公司,德国),按照说明书提取基因组DNA。
1.3 AZF微缺失STS检测
采用Y染色体微缺失试剂盒(Y chromosome deletion detection system kit version 2.0,Promega公司,美国)检测20个序列标签位点(sequence-tagged sites, STS)。本试剂盒包含5组引物复合物(共20对),通过5组多重PCR扩增技术(Multiplex PCR)对样本全基因组进行扩增。其中包含了《欧洲Y染色体微缺失分子诊断指南2014版本》[23]推荐的6个序列标签位点。A组扩增片段包含:SY254、SY157、SY81、SY130和SY182;B组扩增片段包含:SYPR3、SY127、SY242和SY208;C组扩增片段包含:SY128、SY121、SY145和SY255;D组扩增片段包含:SY133、SY152和SY124;E组扩增片段包含:SY14、SY134、SY86和SY84。A~D组选取X 连锁的区域SMCX作为内对照,E组选取男性和女性共有的特异性区域ZFX/ZFY(zinc-finger-Y gene,)作为内对照。正常男性DNA为阳性对照,去离子水为空白对照。
取10 μL PCR扩增产物,GoldViewTM染色,经4%琼脂糖凝胶电泳,根据以下标准,进行基因缺失类型判断。区:SY81、SY86、SY84和SY182;区:SY121、SYPR3、SY124、SY127、SY128、SY130、SY133和SY134;区:SY145和SY152;区:SY145、SY152、SY242、SY208、SY254、SY255和SY157。
1.4 Y-STR和AMEL基因分型检测
采用AmpFSTR@YfilerTM荧光标记复合扩增系统(Applied Biosystems公司,美国)对Y染色体上17个STR基因座(和)进行基因分型。采用PowerPlex 21荧光标记复合扩增检测试剂(Promega公司,美国)检测基因分型。使用9700型基因扩增仪(Applied Biosystems公司,美国)和3500 xl Dx型号遗传分析仪(Applied Biosystems公司,美国)进行扩增和毛细管电泳。PCR扩增反应体系总体积为10 μL,扩增体系和扩增条件参照试剂盒说明书。每批样本均采用C2800男性DNA (Promega公司,美国)和超纯水分别作阳性对照和阴性对照。采用Gene Mapper ID-X软件进行数据分析。
2 结果与分析
2.1 Y染色体微缺失
通过20个STS检测,发现单纯区缺失7例(8.235%),其中2例a区(SY86)部分缺失,另5例a区(SY86+SY84)连续缺失;单纯区缺失2例(2.353%),其中1例b区(SY134)部分缺失,1例b区(SY121+SYPR3+SY124+SY127+SY128+SY130+SY134)连续缺失;单纯区缺失60例(70.588%);区复合缺失10例(11.765%);区复合缺失6例(7.059%) (表1,图1)。

表1 AZF缺失类型和缺失的序列标签位点
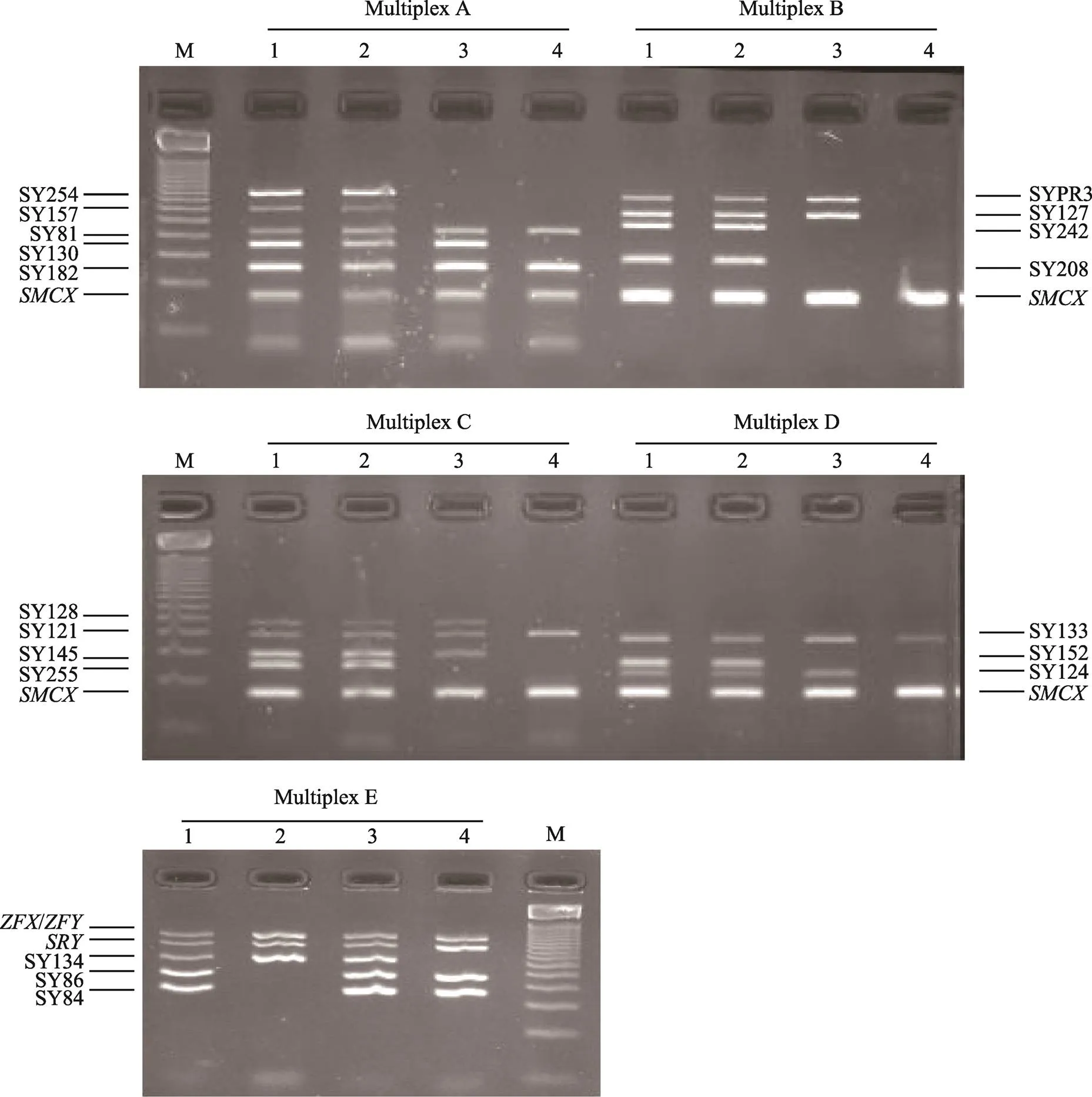
图1 Multiplex PCR结合琼脂糖凝胶电泳结果示意图
M:Marker; 1:正常人样本;2:a2亚组样本;3:c1亚组样本;4:bcd3亚组样本。
2.2 Y-STR和AMEL基因无效扩增
通过检测17个Y-STR基因座,发现27例(31.765%) Y染色体微缺失患者存在Y-STR基因座无效扩增,且与STS缺失位点相关(图2,图3)。
2.2.1基因座无效扩增
在共检出的7例区缺失中,本研究按照缺失类型将其分为a1 (SY86缺失)和a2 (SY86+SY84缺失)两组,其中2例a1亚组样本Y-STR结果均显示基因座无效扩增;5例a2亚组样本Y-STR结果均显示基因座无效扩增(表2;图2,A和B)。
2.2.2基因座无效扩增
在检出的60例区缺失中,按照缺失类型将其分为c1和c2两个组,其中2例c1组样本(No. E6和No. I3) Y-STR结果显示基因座无效扩增。另外58例样本17个Y-STR结果均正常。

图2 样本部分Y-STR无效扩增示意图
A:a1亚组(样本:A3);B:a2亚组(样本:C5);C:b1亚组(样本:F2);D:bcd2亚组(样本:C1)。A:基因座无效扩增;B:基因座无效扩增;C:基因座无效扩增;D:基因座无效扩增(黑色箭头标记出无效扩增位点)。
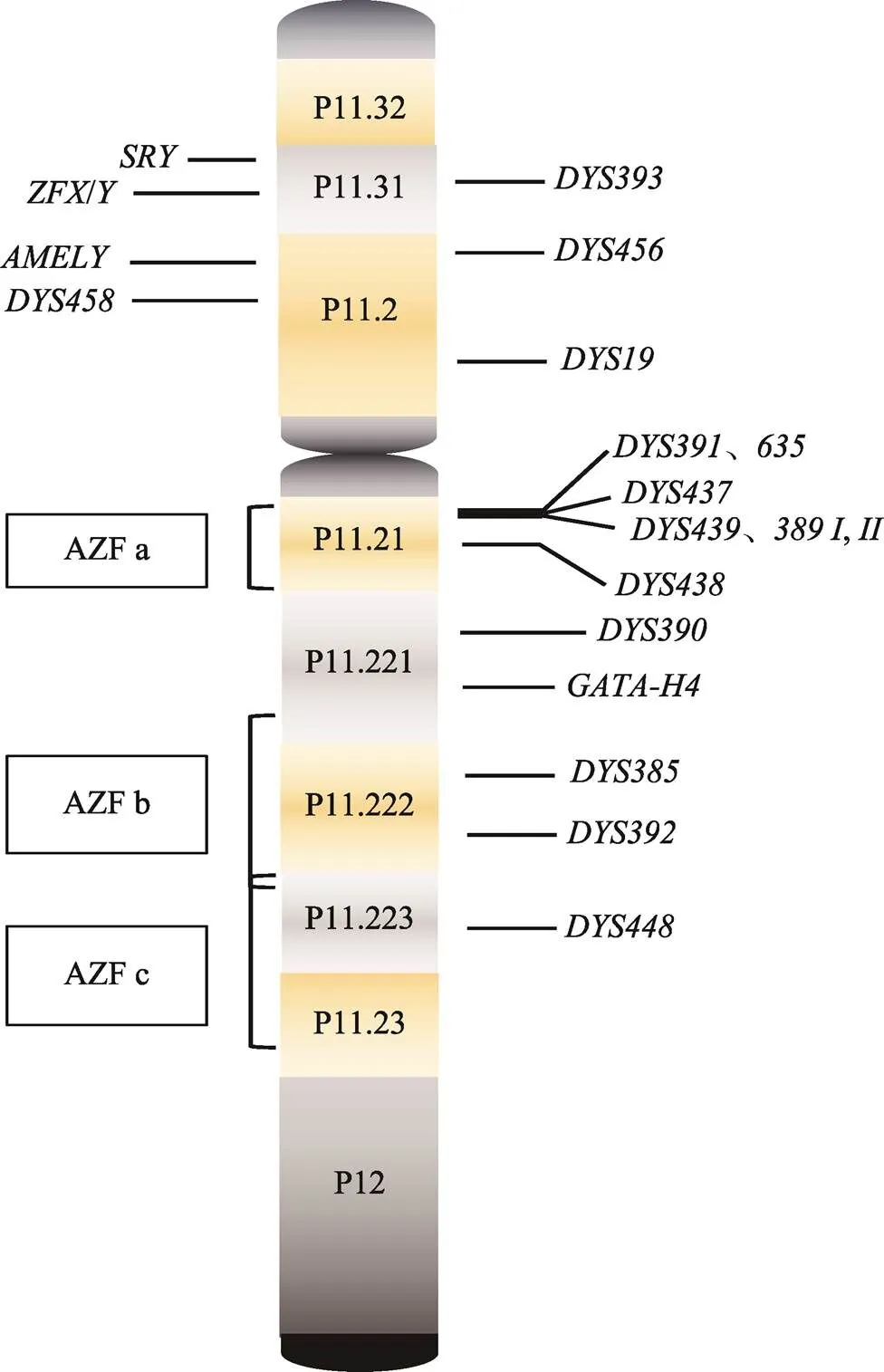
图3 Y染色体结构示意图
在检出的2例区缺失中,按照缺失类型将其分为b1 (SY134缺失)和b2 (SY121+SYPR3+ SY124+SY127+SY128+SY130+SY134缺失)两组,其中b1组样本基因座无效扩增(图2C);b2组样本结果基因座无效扩增,且无效扩增位点与区复合缺失样本相同(表2)。
2.2.3基因座无效扩增
在检出的10例区复合缺失中,按照缺失类型将其分为3组:bcd1、bcd2和bcd3,其中10例样本均显示基因座无效扩增,另1例bcd2组样本显示基因座无效扩增(表2, 图2D)。
2.2.4基因座无效扩增
在共检出的6例区复合缺失中,我们按照缺失类型将其分为4组:abcd1、abcd2、abcd3和abcd4,所有样本基因座均扩增成功,而基因座均无效扩增(表3)。
2.2.5基因座无效扩增和异常扩增
考虑到AZF大片段缺失可能影响其位置邻近的性别相关基因,于是研究者将6例区复合缺失组样本进行常染色体STR检测,观察其和基因座。结果表明3例男性abcd4组样本基因扩增“丢失”,常染色体STR性别基因显示为(XX),1例abcd3组样本基因扩增异常,显示为(XYY)。另2例样本常染色体性别相关基因显示为(XY) (图4)。
3 讨论
Y染色体作为男性独有的性染色体,可分为两端的拟常染色质区((pseudoautosomal region, PAR)和男性特异性区域 (male-specific region of Y chromosome, MSY)。在减数分裂中,两端的拟常染区(PAR1和PAR2)常与X染色体发生重组,而MSY区域不发生重组,呈父系单倍体遗传。而Y-STR正位于其非重组区[3,24,25]。除突变外,同一家族中所有男性个体的Y-STR 分型结果理论上应完全一致。鉴于其在同一父系家族的特异性,研究者可直接获得男女混合检材样本中的男性Y染色体遗传信息而不受女性样本的影响。其特殊的遗传模式,在法庭科学应用中有其独特的优势[26,27]。同时,Y染色体的非重组区(non-recombining region of Y, NPY)含有大量高度同源的重复序列,导致该区域具备了高度的结构不稳定性,较容易发生染色体内非等位的同源性重组(non-allelic homologous recombination, NAHR),导致Y染色体出现结构重排,如缺失、倒置和重复等[28~31],从而可能对Y-STR基因的稳定性产生影响。

表2 AZF部分缺失样本和Y-STR等位基因分型
“/”代表该位点等位基因扩增失败。
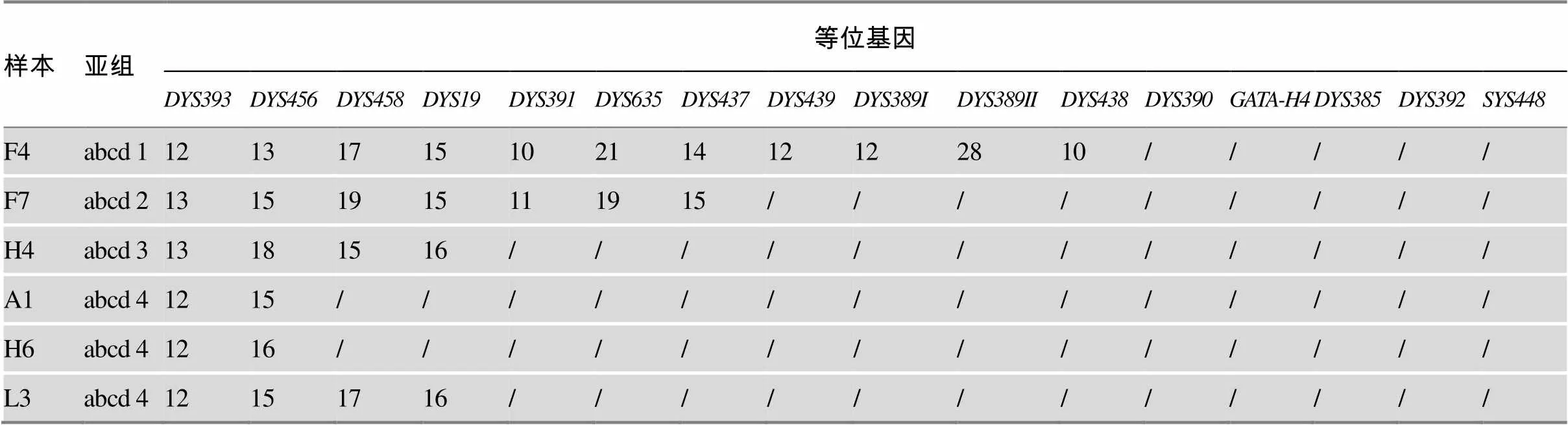
表3 AZF a+b+c+d区缺失样本的Y-STR等位基因分型
“/”代表该位点等位基因扩增失败。
研究表明,精子的发生调控与Y染色体无精子因子AZF密切相关,且该区也位于Y染色体的非重组区[32~35]。AZF基因缺失引起的生精障碍是导致男性不育的重要原因,表现为原发性无精子症和少精症[36]。国内有研究表明了男性不育人群部分Y-STR无效等位基因情况,然而由于样本数量有限,部分缺失型别未能全面涉及[18]。本研究采用美国Promega 公司的20个STS位点(SY81、SY86、SY84、SY182、SY121、SYPR3、SY124、SY127、SY128、SY130、SY133、SY134、SY145、SY152、SY242、SY208、SY254、SY255和SY157)的Y染色体缺失检测商业试剂盒,将基因缺失类型分为5组。同时根据缺失位点将每组细分为1~4个亚组,以保证分析结果的准确性。结果显示单纯区缺失7例(8.235%),包括a区部分缺失和连续缺失两个亚组;单纯区单纯缺失2例(2.353%),包括 b区部分缺失和连续缺失两个亚组;单纯区连续缺失60例(70.588%);区复合缺失10例(11.765%),包括连续缺失和不连续缺失3个亚组;区复合缺失6例(7.059%),依据缺失复杂程度分为4个亚组。
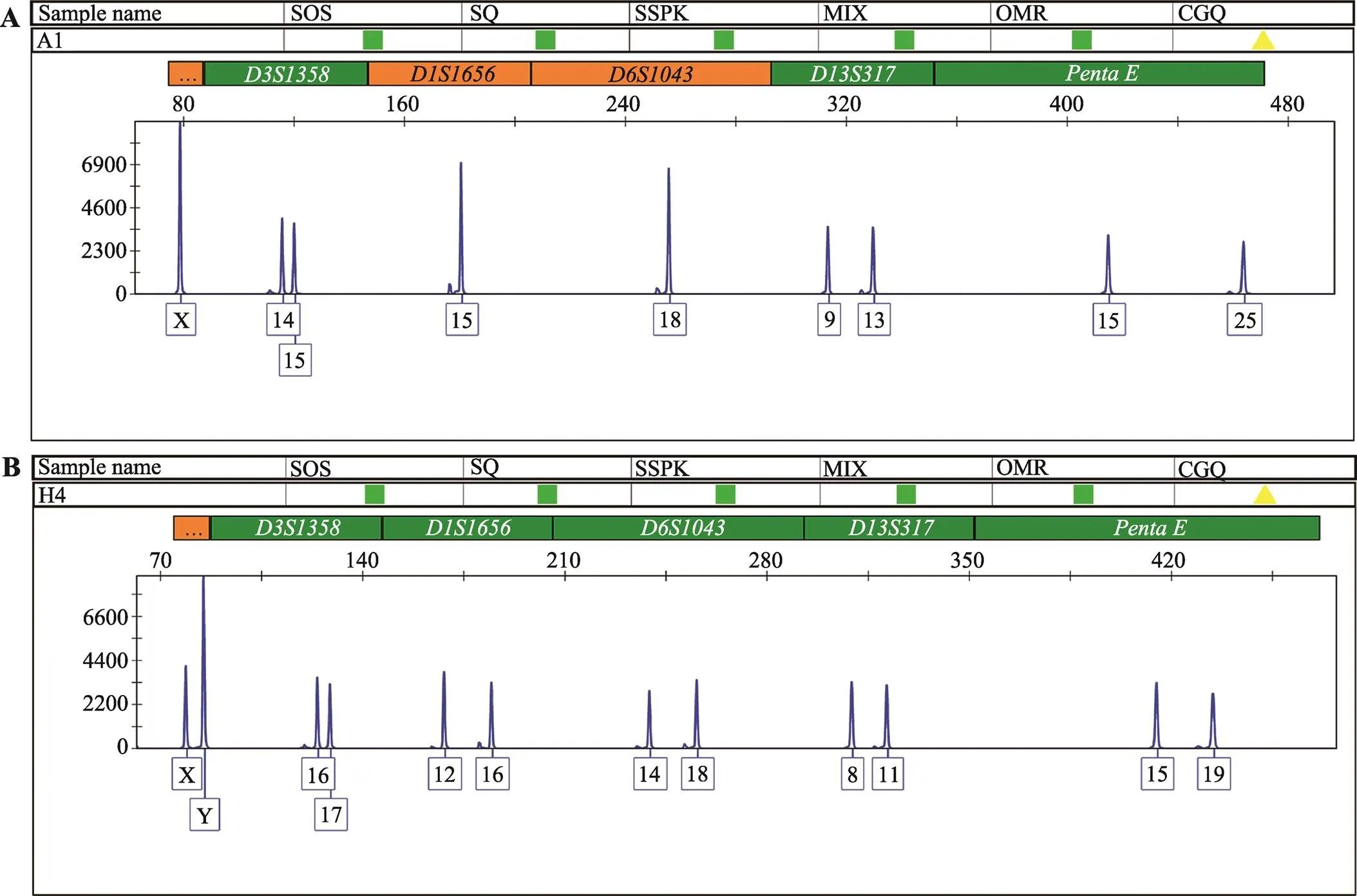
图4 样本AMELY等位基因无效扩增和异常扩增结果
A:男性样本无Y峰(样本:A1、H6、L3);B:Y峰峰高异常(样本:H4)。
本研究结果显示,在Y-STR等位基因缺失模式上面,不同缺失亚组表现出独特的缺失特点(图2,图3):(1)在1亚组(SY86缺失)中,Y-STR等位基因表现为基因座无效扩增(图2A);在AZF a2亚组(SY86+SY84缺失)中Y-STR等位基因表现为基因座无效扩增(图2B)。因此推测基因座无效扩增可能与SY86缺失有关;基因座无效扩增可能与SY84缺失有关,但由于此缺失类型在人群中的发生率较低,该组的样本量较少,该结论普适性有待进一步扩大样本量验证。(2)在组和组中,所有样本均表现为基因座无效扩增。其中区缺失的Y-STR等位基因无效扩增与之前研究结果不完全一致,原因可能是由于样本选择不同而造成的差异[18]。本研究的亚组仅为SY134缺失,因此仅表现为基因座无效扩增(图2C)。目前研究结果显示, 大部分的男性Y染色体微缺失表现为区缺 失[36,37],有研究报道了区缺失与基因座无效扩增有关,但实验样本量较少,可能产生偏倚[18,38,39]。而在本研究的60例c区缺失样本中仅有2例表现为基因座无效扩增(3.333%),结果偏低。基因座无效扩增是否与区缺失有关,亦或为引物结合区基因突变而导致的等位基因无效扩增,尚有待进一步研究。(3)区复合缺失全部样本均表现为基因座无效扩增,与2组缺失的Y-STR基因座相同,因此推测:基因座无效扩增可能与(SYPR3+SY124+SY127+SY128+ SY130+SY134)缺失有关。(4)区复合缺失全部样本均表现为基因座无效扩增,根据以上结果推测基因座无效扩增与SY182缺失有关。(5) 3例样本4亚组等位基因“丢失”,DNA检测表现为XX。与之前报道的Y染色体长臂大片段缺失导致丢失结果一致[20,40,41]。其机制可能为:此类大片段缺失始于Yp11.2并涵盖了整个Y染色体长臂,以致和及整条长臂遗传标记物丢失,与此同时,靠近拟常染色质区的Y染色体短臂标记物如与X染色体发生重组,导致Y染色体短臂部分标记物如SRY基因(性别决定基因)重新定位到X染色体短臂,而造成个体发育成男性特征[22,40]。然而此种缺失-重定位理论无法合理解释样本L3的分型结果(阴性,阳性),有待后续对其机制进行更深入的研究。综上所述,本研究阐明了和在基因缺失人群的遗传异质性,为此类遗传缺陷人群的遗传标记缺失提供了科学解释和理论依据,提高实验室对异常Y-STR数据解读能力。
[1] Kayser M. Forensic use of Y-chromosome DNA: a general overview., 2017, 136(5): 621–635.
[2] Willems T, Gymrek M, Poznik GD, Tyler-Smith C, The 1000 Genomes Project Chromosome Y Group, Erlich Y. Population-Scale sequencing data enable precise estimates of Y-STR mutation rates., 2016, 98(5): 919–933.
[3] Liu H. Establishment of fluorescence labeled 24 Y-STRs loci multiplex PCR system and its application in forensic medicine (thesis)[D]. Southern Medical University, 2012.刘宏. 24个Y-STR基因座荧光标记复合检测体系的建立及其法医学应用[学位论文]. 南方医科大学, 2012.
[4] Tiepolo L, Zuffardi O. Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm., 1976, 34(2): 119–124.
[5] Liu XG, Hu HY, Guo YH, Sun YP. Correlation between Y chromosome microdeletion and male infertility., 2016, 15(2).
[6] Vogt PH, Edelmann A, Kirsch S, Henegariu O, Hirschmann P, Kiesewetter F, Köhn FM, Schill WB, Farah S, Ramos C, Hartmann M, Hartschuh W, Meschede D, Behre HM, Castel A, Nieschlag E, Weidner W, Gröne HJ, Jung A, Engel W, Haidl G. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11., 1996, 5(7): 933–943.
[7] Kent-First M, Muallem A, Shultz J, Pryor J, Roberts K, Nolten W, Meisner L, Chandley A, Gouchy G, Jorgensen L, Havighurst T, Grosch J. Defining regions of the Y-chromosome responsible for male infertility and identification of a fourth AZF region (AZFd) by Y-chromosome microdeletion detection., 1999, 53(1): 27–41.
[8] Ataei M, Akbarian F, Talebi MA, Dolati P, Mobaraki M, Faraji A, Houshmand M. Analysis of partial AZFc (gr/gr, b1/b3, and b2/b3) deletions in Iranian oligozoospermia candidates for intracytoplasmic sperm injection (ICSI)., 2018, 48(2): 251–256.
[9] Sen S, Pasi AR, Dada R, Shamsi MB, Modi D. Y chromosome microdeletions in infertile men: Prevalence, phenotypes and screening markers for the Indian population., 2013, 30(3): 413–422.
[10] Foresta C, Moro E, Rossi A, Rossato M, Garolla A, Ferlin A. Role of the AZFa candidate genes in male infertility., 2000, 23(10): 646–651.
[11] Sen S, Ambulkar P, Hinduja I, Zaveri K, Gokral J, Pal A, Modi D. Susceptibility of gr/gr rearrangements to azoospermia or oligozoospermia is dependent on DAZ and CDY1 gene copy deletions., 2015, 32(9): 1333–1341.
[12] Liu XY, Wang RX, Fu Y, Luo LL, Guo W, Liu RZ. Outcomes of intracytoplasmic sperm injection in oligozoospermic men with Y chromosome AZFb or AZFc microdeletions., 2017, 49(1): e12602
[13] Zhang YS, Li LL, Xue LT, Zhang H, Zhu YY, Liu RZ. Complete azoospermia factor b deletion of Y chromosome in an infertile male with severe oligoasthenozoospermia: Case report and literature review., 2017, 102: 111–115.
[14] Liu XH, Qiao J, Li R, Yan LY, Chen LX. Y chromosome AZFc microdeletion may not affect the outcomes of ICSI for infertile males with fresh ejaculated sperm.,2013, 30(6): 813–819.
[15] Fu L, Xiong DK, Ding XP, Li C, Zhang LY, Ding M, Nie SS, Quan Q. Genetic screening for chromosomal abnormalities and Y chromosome microdeletions in Chinese infertile men., 2012, 29(6): 521–527.
[16] Nakahori Y, Takenaka O, Nakagome Y. A human X-Y homologous region encodes "amelogenin"., 1991, 9(2): 264–269.
[17] Sullivan KM, Mannucci A, Kimpton CP, Gill P. A rapid and quantitative DNA sex test: fluorescence-based PCR analysis of X-Y homologous gene amelogenin., 1993, 15(4): 636–638, 640–641.
[18] Ye JJ, Li ZF, Chen YX, Ma L, Li M, Wang YL, Yang LJ, Chen BW. Analysis of null alleles for 17 Y chromosome- short tandem repeat loci in infertile males., 2013, 30(3): 330–334.叶峻杰, 李宗芳, 陈燕祥, 马丽, 李貌, 郭海, 王跃力, 杨丽娟, 程宝文. 男性不育人群17个Y染色体短串联重复基因座无效等位基因分析. 中华医学遗传学杂志, 2013, 30(3): 330–334.
[19] Wang YL, Ye JJ, Li ZF, Zheng S, Ma L, Guo H,Yang LJ, Chen BW. Identification of null and duplicated alleles for forensic DYS549, DYS527 and DYS459 in male infertility population., 2014, 36(8): 786–792.王跃力, 叶峻杰, 李宗芳, 郑水, 马丽, 郭海, 杨丽娟, 程宝文. 对法医学相关的DYS549、DYS527、DYS459基因座在男性不育症人群中的缺失、重复调查. 遗传, 2014, 36(8): 786–792.
[20] Ma Y, Kuang JZ, Zhang J, Wang GM, Wang YJ, Jin WM, Hou YP. Y chromosome interstitial deletion induced Y-STR allele dropout in AMELY-negative individuals., 2012, 126(5): 713–724.
[21] Takayama T, Takada N, Suzuki R, Nagaoka S, Watanabe Y, Kumagai R, Aoki Y, Butler JM. Determination of deleted regions from Yp11.2 of an amelogenin negative male., 2009, 11(Suppl.1): S578–S580.
[22] Davis C, Illescas M, Tirado C, Lopez R, Budowle B, Cruz TD. A case of amelogenin Y-null: a simple primer binding site mutation or unusual genetic anomaly?,2012, 146): 320–323.
[23] Krausz C, Hoefsloot L, Simoni M, Tüttelmann F. European Academy of Andrology, European Molecular Genetics Quality Network. EAA/EMQN best practice guidelines for molecular diagnosis of Y-chromosomal microdeletions: state-of-the-art 2013., 2014, 2(1): 05–19
[24] Shang L, Mo XT, Yang F, Zhang J, Yu ZL, Ma X, Zhao XC, Li WS. Progress towards forensic research and application of Multi-copied Y-STR loci., 2018, 43(2): 97–103.尚蕾, 莫晓婷, 杨帆, 张建, 余政梁, 马新, 赵兴春, 李万水. 多拷贝Y-STR基因座在法庭科学领域的研究. 刑事技术. 2018, 43(2): 97–103.
[25] Yannic G, Basset P, Hausser J. A new perspective on the evolutionary history of western European Sorex araneus group revealed by paternal and maternal molecular markers., 2008, 47(1): 237–250.
[26] Zhang WQ, Liu YX, Huang DX. Y-STR mutation and forensic application of rapidly mutating Y-STRs., 2015, 30(4): 380–383.张文琼, 刘宇轩, 黄代新. Y-STR突变及快速突变Y-STR的法医学应用价值. 中国法医学杂志, 2015, 30(4): 380– 383.
[27] Ballantyne KN, Keerl V, Wollstein A, Choi Y, Zuniga SB, Ralf A, Vermeulen M, de Knijff P, Kayser M. A new future of forensic Y-chromosome analysis: Rapidly mutating Y-STRs for differentiating male relatives and paternal lineages., 2012, 6(2): 208–218.
[28] Repping S, Skaletsky H, Lange J, Silber S, Van Der Veen F, Oates RD, Page DC, Rozen S. Recombination between palindromes P5 and P1 on the human Y chromosome causes massive deletions and spermatogenic failure., 2002, 71(4): 906–922.
[29] Yang Y, Zhang SZ, Y chromosome variations and male infertility., 2010, 27(3): 276–281.杨元, 张思仲. Y染色体变异与男性不育. 中华医学遗传学杂志, 2010, 27(3): 276–281.
[30] Ballantyne KN, Goedbloed M, Fang R, Schaap O, Lao O, Wollstein A, Choi Y, van Duijn K, Vermeulen M, Brauer S, Decorte R, Poetsch M, von Wurmb-Schwark N, de Knijff P, Labuda D, Vézina H, Knoblauch H, Lessig R, Roewer L, Ploski R, Dobosz T, Henke L, Henke J, Furtado MR, Kayser M. Mutability of Y-chromosomal microsatellites: rates, characteristics, molecular bases, and forensic implications., 2010, 87(3): 341–353.
[31] Goedbloed M, Vermeulen M, Fang RN, Lembring M, Wollstein A, Ballantyne K, Lao O, Brauer S, Krüger C, Roewer L, Lessig R, Ploski R, Dobosz T, Henke L, Henke J, Furtado MR, Kayser M. Comprehensive mutation analysis of 17 Y-chromosomal short tandem repeat polymorphisms included in the AmpFlSTR Yfiler PCR amplification kit., 2009, 123(6): 471–482.
[32] Colaco S, Modi D. Genetics of the human Y chromosome and its association with male infertility., 2018, 16(1): 14.
[33] Sen S, Ambulkar P, Hinduja I, Zaveri K, Gokral J, Pal A, Modi D. Susceptibility of gr/gr rearrangements to azoospermia or oligozoospermia is dependent on DAZ and CDY1 gene copy deletions., 2015, 32(9): 1333–1341.
[34] Zhang YS, Li LL, Xue LT, Zhang H, Zhu YY, Liu RZ. Complete Azoospermia Factor b deletion of Y chromosome in an infertile male with severe oligoasthenozoospermia: case report and literature review., 2017, 102: 111– 115.
[35] Yousefi-Razin E, Nasiri MJ, Omrani MD. Frequency of Y chromosome microdeletions among Iranian infertile men with azoospermia and severe oligozoospermia: a meta-analysis., 2016, 17(4): 208–212.
[36] Zhang YS, Dai RL, Wang RX, Zhang HG, Chen S, Liu RZ. Analysis of y chromosome microdeletion in 1738 infertile men from Northeastern China.,2013, 83(3): 584– 588.
[37] Akınsal EC, Baydilli N, Dündar M, Ekmekçioğlu O. The frequencies of Y chromosome microdeletions in infertile males., 2018, 44(5): 389–392.
[38] Balaresque P, Bowden GR, Parkin EJ, Omran GA, Heyer E, Quintana-Murci L, Roewer L, Stoneking M, Nasidze I, Carvalho-Silva DR, Tyler-Smith C, de Knijff P, Jobling MA. Dynamic nature of the proximal AZFc region of the human Y chromosome: multiple independent deletion and duplication events revealed by microsatellite analysis., 2008, 29(10): 1171–1180.
[39] Turrina S, Caratti S, Ferrian M, De Leo D. Deletion and duplication at DYS448 and DYS626 loci: unexpected patterns within the AZFc region of the Y-chromosome., 2015, 129(3): 449–455.
[40] Chang YM, Perumal R, Keat PY, Yong RY, Kuehn DL, Burgoyne L. A distinct Y-STR haplotype for Amelogenin negative males characterized by a large Y(p)11.2 (DYS458-MSY1-AMEL-Y) deletion., 2007, 166(2–3): 115–120.
[41] Ou X, Chen W, Chen H, Zhao F, Zheng J, Tong D, Chen Y, Chen A, Sun H. Null alleles of the X and Y chromosomal amelogenin gene in a Chinese population., 2012, 126(4): 513–518.
Alleles dropout patterns of Y-short tandem repeats in infertile males with Y chromosome microdeletions
Yanchao Wang, Xiaoyan Ma, Xiaofang Sun, Jiajia Xian, Shaoying Li, Wenzhi He, Xiaoman Wang, Qing Li
Y chromosomal short tandem repeat (Y-STR) typing is the most commonly used genetic technique in forensic studies. However, there may be a limit to the application of Y-STR in forensic science as Y-STR loci are subject to loss or variation caused by the higher chromosomal structures’ spontaneous mutation rate. Located in the long arm of the Y chromosome, azoospermia factor () have been shown to participate in spermatogenesis and its deletion could cause infertility. However, little is known about the Y-STR dropout pattern in individuals with Y chromosome microdeletions. In this study, 85 infertile males with Y chromosome interstitial deletion were identified and special Y-STR allele dropout patterns were analyzed by employing a Y-STR Commercial Kit and a Y chromosome Deletion Kit. Results demonstrate thatregion deletion are related toalleles dropout, whileregion orregion deletions correlate toallele dropout. Nullalleles were observed inregion deletion individuals. While nullalleles were observed inlarge region deletion individuals. Our data suggest that Y chromosome microdeletions may indicate specific Y-STR locus dropout patterns.
Y chromosomal microdeletions; AZF deletion; Y chromosomal short tandem repeats alleles dropout; infertility
2018-10-09;
2018-12-25
广东省科技计划项目(编号:2016A20214011)资助[Supported by Science and Technology Planning Project of Guangdong Province (No. 2016A20214011)]
王燕超,硕士研究生,技师,研究方向:分子遗传学。E-mail: wycsusan12@163.com
黎青,博士,主任医师,主管技师,研究方向:分子遗传学,生殖遗传学,法医遗传学。E-mail: 81292522@163.com
10.16288/j.yczz.18-235
2019/1/14 13:15:29
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190114.1315.009.html
(责任编委: 杨昭庆)

