RhoA蛋白及驱动蛋白KIF2A与卵巢癌临床病理特征的相关性研究
管文华,项锋钢
(青岛大学基础医学院 病理学系,山东 青岛 266021)
卵巢癌是妇科常见的一种恶性肿瘤,卵巢癌的5年生存率较低,约在25%~30%[1],卵巢癌具有高的增殖及转移潜力,但发病机制尚不完全清楚。研究卵巢癌的恶性生物学行为机制,寻找新的治疗靶点,已经成为亟待解决的问题。
有研究提示,驱动蛋白KIF2A的表达与多种肿瘤的增殖和转移密切相关[2]。Rho家族蛋白是Ras超家族中的一类小分子G蛋白,具有GTP酶活性,在细胞信号传导中起着重要作用,与肿瘤新生血管生成、细胞凋亡、肿瘤转移、肿瘤侵袭以及肿瘤生长增殖等有着十分密切的关联。相关研究报道中明确提出,RhoA在许多肿瘤中表达增加[3]。但KIF2A和RhoA在卵巢癌中的研究尚少见报道。另外,同是促癌基因,两者在卵巢癌中的表达有无相关性,两者间是否存在调控关系,两者可否作为卵巢癌靶向治疗的新靶点,这些问题目前均无准确答案。
本研究通过检测RhoA和KIF2A蛋白在正常卵巢、卵巢上皮良性肿瘤及卵巢癌组织中的表达情况,了解RhoA和KIF2A蛋白与卵巢癌临床病理特征的关系及两者间的相关性,为临床治疗卵巢癌提供实验依据。
1 资料与方法
1.1 一般资料
选取2014年6月—2016年6月青岛大学附属医院手术切除的卵巢癌患者45例、卵巢上皮良性肿瘤患者25例及正常卵巢组织患者20例。年龄26~69岁,平均(48.7±10.07)岁。所有患者在切除卵巢组织标本前均未进行化疗或放疗,正常卵巢组织取自子宫病变同时切除正常卵巢者,所有患者经手术后病理检查确诊。卵巢癌病理类型:浆液性21例,子宫内膜样15例,黏液性9例;病理分级:低分化16例,高中分化29例;FIGO分期为Ⅰ、Ⅱ期26例,Ⅲ、Ⅳ期19例;术中清扫淋巴结发现有转移者15例。
1.2 试剂
KIF2A小鼠单克隆抗体、RhoA小鼠单克隆抗体均购自英国Abcam公司,置入-20℃冰箱冷冻保存,工作浓度均为1∶100,链霉菌抗生物素蛋白——过氧化酶(SP)法试剂盒、DAB(3,3,-diaminobenzidine 3,3,-二氨基联苯胺)酶底物显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色
10%中性甲醛对实验标本予以固定,常规石蜡包埋,连续切片,4 μm厚,每份标本留5张,其中1张进行HE染色,其余行免疫组织化学实验。阳性对照物选取已知阳性组织切片,阴性对照物选取PBS代替一抗,采用SP法检测,蜡块切片经过脱蜡、水化后,滴加3%过氧化氢H2O2孵育10 min阻断内源性过氧化物酶,滴加枸橼酸钠缓冲液(pH 6.0)进行抗原修复,切片上滴加封闭用正常山羊血清液(室温下孵育20 min)。滴加一抗,4℃过夜,PBS洗涤,对生物素标记二抗(于37℃环境内予以孵育,孵育时间30 min)予以滴加,滴加1滴;PBS洗涤后,对辣根酶标记链霉卵白索工作液(37℃环境内予以孵育,孵育时间20 min)予以滴加,滴加1滴。PBS洗涤,对新鲜配制的DAB予以滴加显色,显色时间控制在6 min左右,于显微镜视野下观察染色程度,充分水洗;水洗完成后选取苏木精复染,二甲苯透明5 min,梯度乙醇脱水,中性树脂封片,于显微镜视野下观察。
1.4 免疫组织化学结果的判定
染色细胞浆中对KIF2A和RhoA予以染色处理,呈浅黄色—棕黄色,弥漫分布。判定主要依据阳性细胞百分比与染色强度[4],每张切片对典型肿瘤细胞视野予以随机选取,共选取10个,每一个视野对100个肿瘤予以计数,并计算阳性细胞百分数。按照着色细胞阳性百分比予以评分:①4分为75%以上;②3分为51%~75%,弥散;③2分为26%~50%,局部;④1分为5%~25%,散发;⑤0分为5%以下,阴性。同时,按照染色强度予以评分,即:①强着色代表3分,中度着色代表2分,弱着色代表1分,不着色代表0分。将染色强度评分与着色细胞阳性百分比相乘,RhoA、KIF2A评分(0~12)分别对应4种表达强度,即:①强阳性(+++):9~12分;②中度阳性(++):5~8分;③弱阳性(+):2~4分;④阴性(-):0~1分。
1.5 统计学方法
数据分析采用SPSS 21.0统计软件,计数资料采用例(%)表示,两独立样本采用Mann-WhitneyU检验,多个独立样本的比较采用Kruskal-WallisH检验,在有统计学意义的基础上,两两比较采用Nemenyi法,采用Spearman做相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 正常卵巢、卵巢上皮良性肿瘤及卵巢癌组织中KIF2A、RhoA的表达
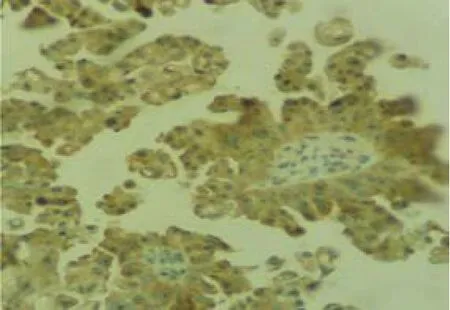
图1 KIF2A在卵巢癌中的高表达 (SP×400)
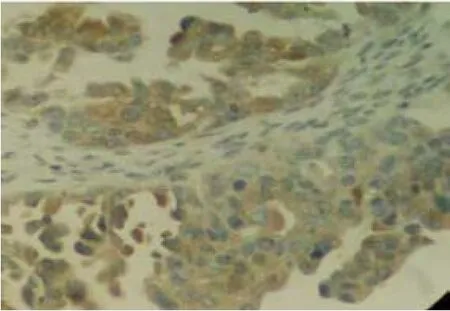
图2 RhoA在卵巢癌中的高表达 (SP×400)
KIF2A和RhoA主要定位于细胞浆中(见图1、2),免疫组织化学染色呈浅黄色—棕黄色(+)~(+++)。KIF2A在正常卵巢组织和卵巢上皮良性肿瘤组织中的阳性率分别为15.0%(3/20)和20.0%(5/25),在卵巢癌组织中阳性率为77.8%(35/45),3组比较差异有统计学意义(H=40.834,P=0.000);其中KIF2A在正常卵巢组织和卵巢上皮良性肿瘤组织中的阳性率比较差异无统计学意义(H=0.043,P=0.979);与卵巢上皮良性肿瘤组织、正常卵巢组织比较,卵巢癌组织中KIF2A的阳性率更高(H=27.931和26.397,均P=0.000)。见表1。
RhoA在正常卵巢组织和卵巢上皮良性肿瘤组织中的阳性率分别为10.0%(2/20)和16.0%(4/25),卵巢癌组织中阳性率为62.0%(28/45),3组比较差异有统计学意义(H=27.513,P=0.000);RhoA在卵巢正常组织和卵巢上皮良性肿瘤组织中的阳性率比较差异无统计学意义(H=0.090,P=0.960);与卵巢上皮良性肿瘤组织、正常卵巢组织比较,卵巢癌组织中RhoA的阳性表达更高(H=18.190和18.440,均P=0.000)。见表1。
2.2 卵巢癌组织中KIF2A、RhoA的表达与临床病理特征的关系
Ⅰ、Ⅱ期卵巢癌KIF2A的表达较Ⅲ、Ⅳ期低,淋巴结转移者KIF2A的表达较未转移者高,差异均有统计学意义(P<0.05)。而不同年龄、不同组织学分级及不同病理类型KIF2A的表达差异无统计学意义(P>0.05)。见表2。
低分化卵巢癌较高分化者RhoA蛋白表达高,淋巴结转移者RhoA蛋白较未转移者表达高,差异有统计学意义(P<0.05)。而不同年龄、临床分期及病理类型RhoA蛋白的表达差异无统计学意义(P>0.05)。见表3。
2.3 卵巢癌组织中KIF2A、RhoA表达的相关性
Spearman等级相关性分析结果表明,KIF2A、RhoA在卵巢癌中的表达呈正相关(rs=0.801,P =0.000)。见表4。
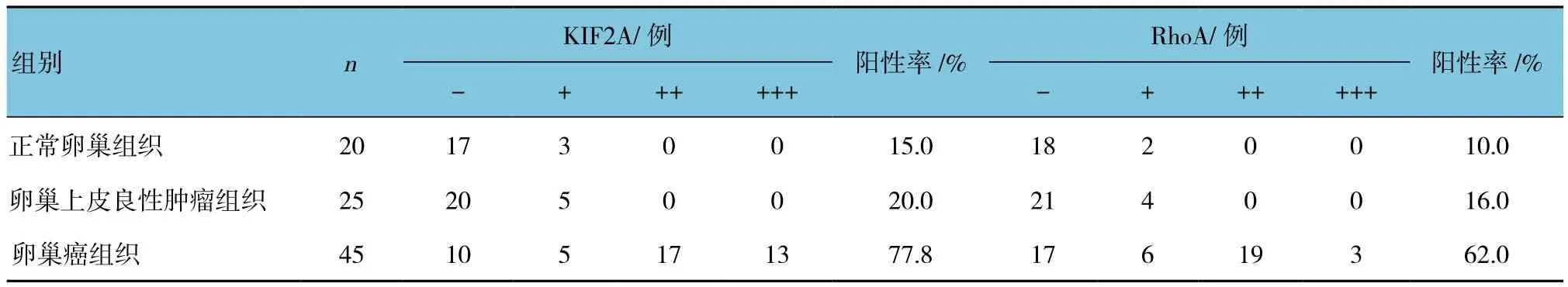
表1 KIF2A、RhoA蛋白在正常卵巢、良性上皮卵巢肿瘤及卵巢癌组织中的表达
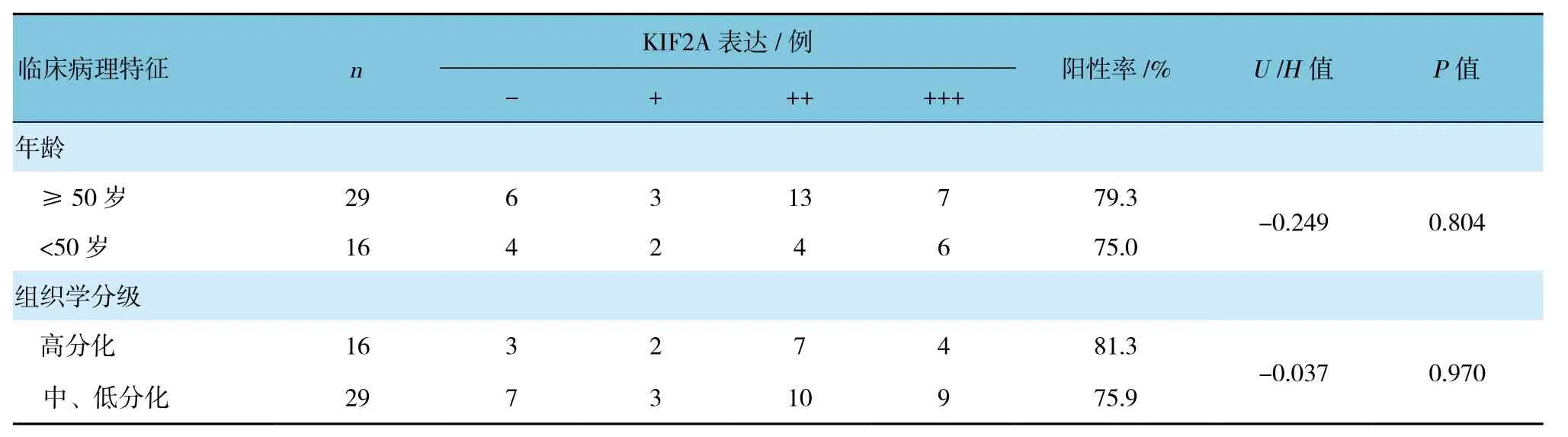
表2 KIF2A的表达与卵巢癌临床病理特征的关系
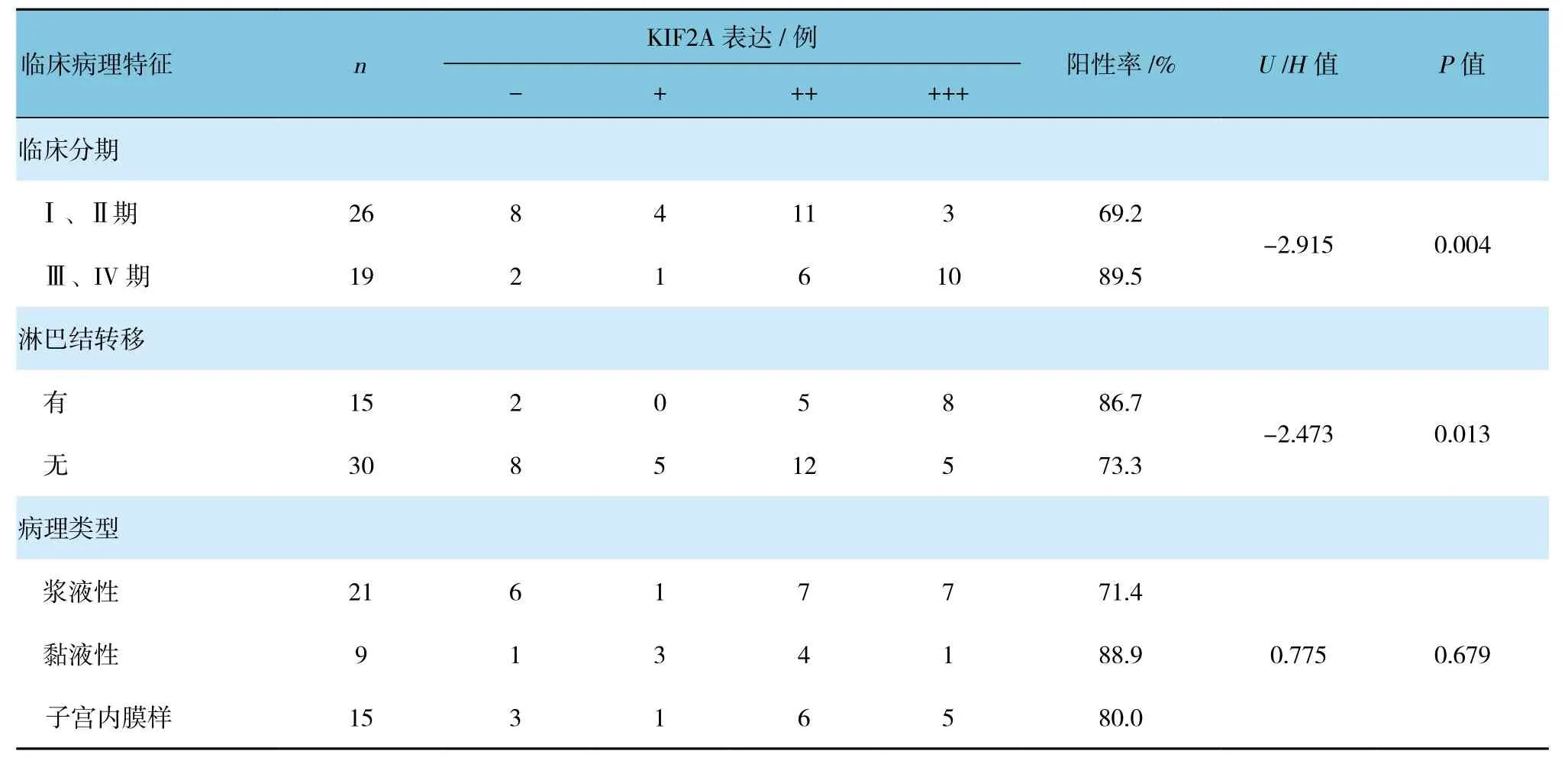
续表2
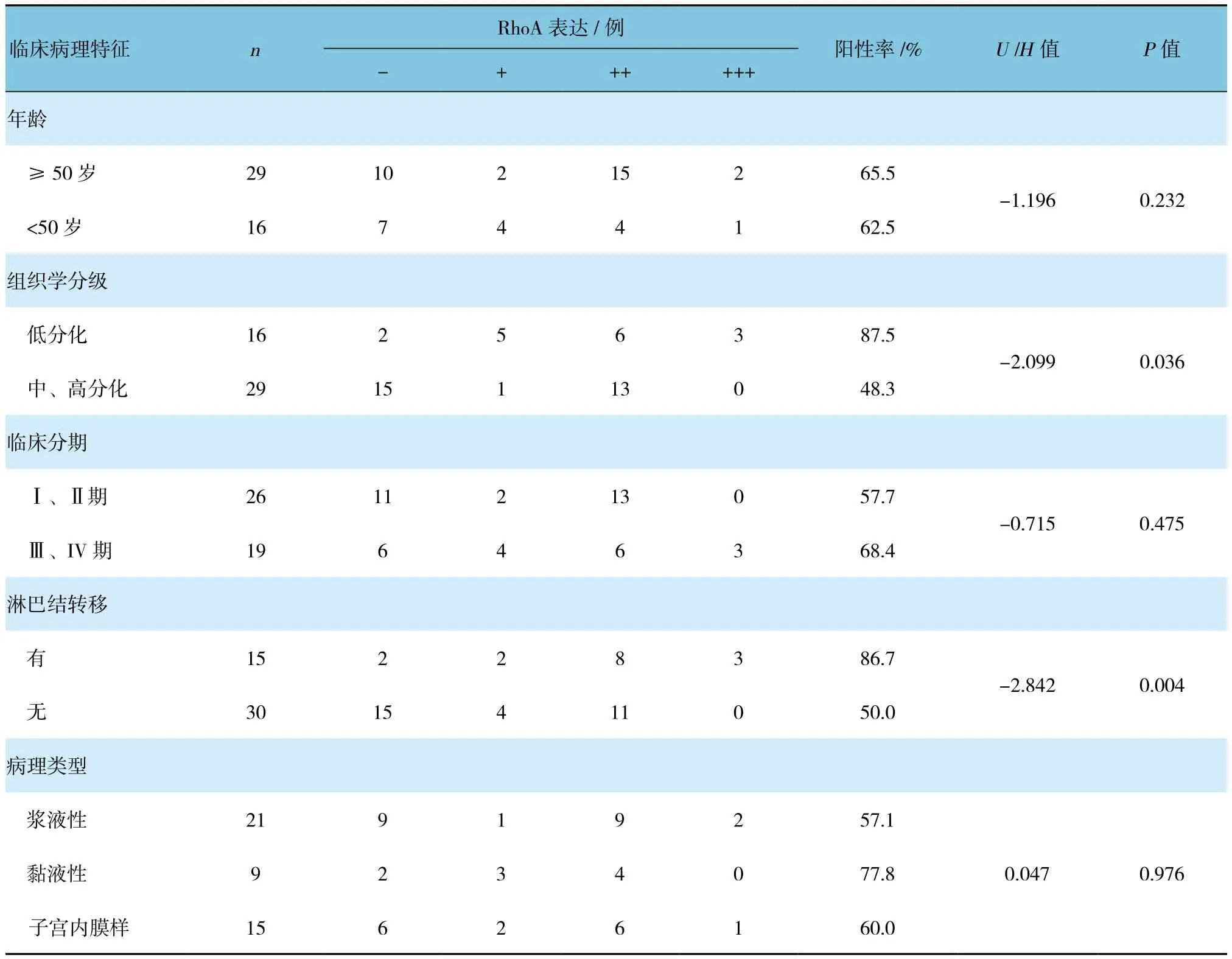
表3 RhoA的表达与卵巢癌临床病理特征的关系
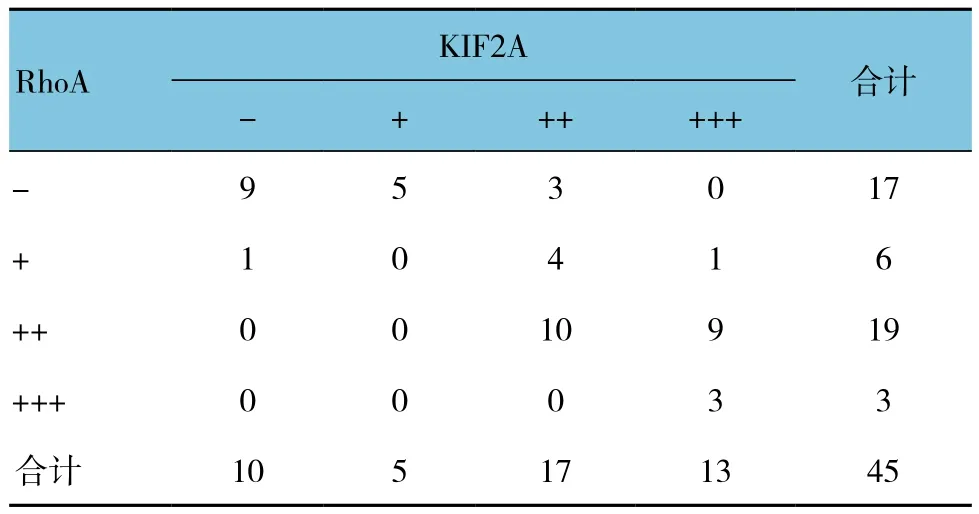
表4 卵巢癌组织中KIF2A与RhoA表达的相关性 例
3 讨论
卵巢癌具有肿瘤细胞过度增殖、转移和侵袭的特点,预后较差。近年来人们开始关注和研究微管驱动蛋白与肿瘤发生的关系,驱动蛋白在细胞有丝分裂中促进染色体移动的微管解聚过程中发挥重要作用[5],其功能异常可能引起基因组不均衡,造成子细胞中染色体异常,出现非整倍体、多倍体及肿瘤的发生[6-8]。KIF2A是驱动蛋白-13家族成员之一,具有催化解聚微管的作用,参与细胞有丝分裂,当KIF2A出现异常抑制或者异常激活状况的时候,可对微管长度予以改变,导致中心染色体出现紊乱状况,造成有丝分裂异常,最终对正常细胞增殖过程产生不良影响[9]。
本研究中,KIF2A在卵巢癌组织中表达增高,卵巢上皮良性肿瘤及正常卵巢组织中表达低,推测KIF2A异常高表达可能使微管发生动力学改变,微管解聚增强,加快促进细胞的分裂增殖,因此KIF2A可能参与卵巢癌细胞的增殖过程。另外本研究发现卵巢癌中KIF2A的高表达出现在临床分期晚及有淋巴结转移的癌组织中,推测可能因微管的减少和解聚与肿瘤周围的局部浸润和远处转移相关[10-12],驱动蛋白KIF2A高表达可能使微管解聚增加,细胞骨架不稳定,促进卵巢癌的局部浸润和转移过程。
近年来发现,RhoA蛋白与肿瘤的发生、发展存在重要关系。Rho活性在人类肿瘤中经常出现失调,可对肿瘤细胞浸润、生长予以促进[13-14]。本研究发现在卵巢癌组织中RhoA高表达,而良性卵巢肿瘤及正常卵巢组织中为低表达,推测RhoA在卵巢癌的发生发展过程中可能通过对细胞骨架予以调节,对卵巢癌细胞增殖予以促进,使细胞间黏附作用下降,促进细胞外基质降解,促进卵巢癌的发生、发展。另外本研究显示,RhoA在有淋巴结转移的癌组织中表达高,在组织学分化低的癌组织中表达高,提示RhoA可能通过破坏肿瘤细胞间的黏附作用,促进细胞外基质降解,促进肿瘤血管形成参与了卵巢癌的浸润和转移。这与SHEPELEV等[3]的研究结果相一致。
KIF2A和RhoA在卵巢癌的侵袭和转移过程中是否存在关联机制尚不明确,尚无相关文献报道。WANG等[15]在相关研究报道中明确提出,敲除KIF2A基因后,口腔鳞癌细胞内MMP-9基因水平会明显下降,KIF2A不仅能够通过对细胞骨架予以改变,对细胞运动能力产生影响,还可能与MMP-9有相互作用,进一步增强突变细胞的迁徙、入侵基膜能力,在此基础上对肿瘤细胞转移、侵袭予以合理调控。而RhoA和RhoC则同属于Rho亚家族成员,可影响基质金属蛋白酶活性。
本实验结果表明,在卵巢组织中KIF2A和RhoA的表达呈正相关,且同是促癌基因,提示KIF2A和RhoA可能协同参与卵巢癌的发生、发展及转移过程。实验结果可能受实验样本、方法、条件的限制。两者间的关系需要更多的理论和数据支持。探讨两者在卵巢癌发生、发展中的相互作用,有助于了解卵巢癌发生转移的分子生物学机制,为临床靶向治疗提供新的实验依据。

