梨的微繁技术
冉昆,左新学,王少敏*
(1.山东省果树研究所,山东泰安 271000;2.冠县梁堂镇林业站)
微繁技术(Micropropagation)又称快速无性繁殖技术,是指通过植物的胚、组织或器官等进行离体无菌培养,迅速获得大量试管苗的技术。微繁技术具有繁殖周期短、繁殖数量大、可集约化培养等优点。梨的微繁过程包括茎尖培养、增殖、诱导生根及炼苗、移栽等环节,目前已广泛用于西洋梨、白梨、砂梨、秋子梨和新疆梨等。笔者总结了梨的微繁技术方案,供参考。
1 培养基类型
梨树的微繁多采用全量或1/2 MS基本培养基或其改良培养基,也有研究使用LP(Lepoivre)、DKW(Driver-Kuniyuki Walnut)或WPM(Woody Plant Medium)培养基。LP、DKW或WPM培养基与MS培养基主要区别在于NH4+和NO3-的离子浓度及总离子浓度的差异。影响梨微繁效率的5种主要矿质营养因子包括NH4NO3、KNO3、中量营养元素(Ca-Mg-Cl-Mn-SO4-PO4)、微量元素(Zn、Mn、Cu、Co、Mo、B、I)和乙二胺四乙酸铁(Fe-EDTA)。通过对不同基因型梨的分析,确定了对不同性状影响最大的因子分别为品质(中量营养元素、Fe),叶斑/坏死(中量营养元素),叶片大小(中量营养元素),芽的数量(NH4NO3、Fe)和芽的长度(Fe)。通过比较组培苗的生长状态,确定了梨微繁的最佳增殖培养基,命名为梨培养基1和梨培养基2(表1,表2)。

表1 培养基的母液成分及浓度
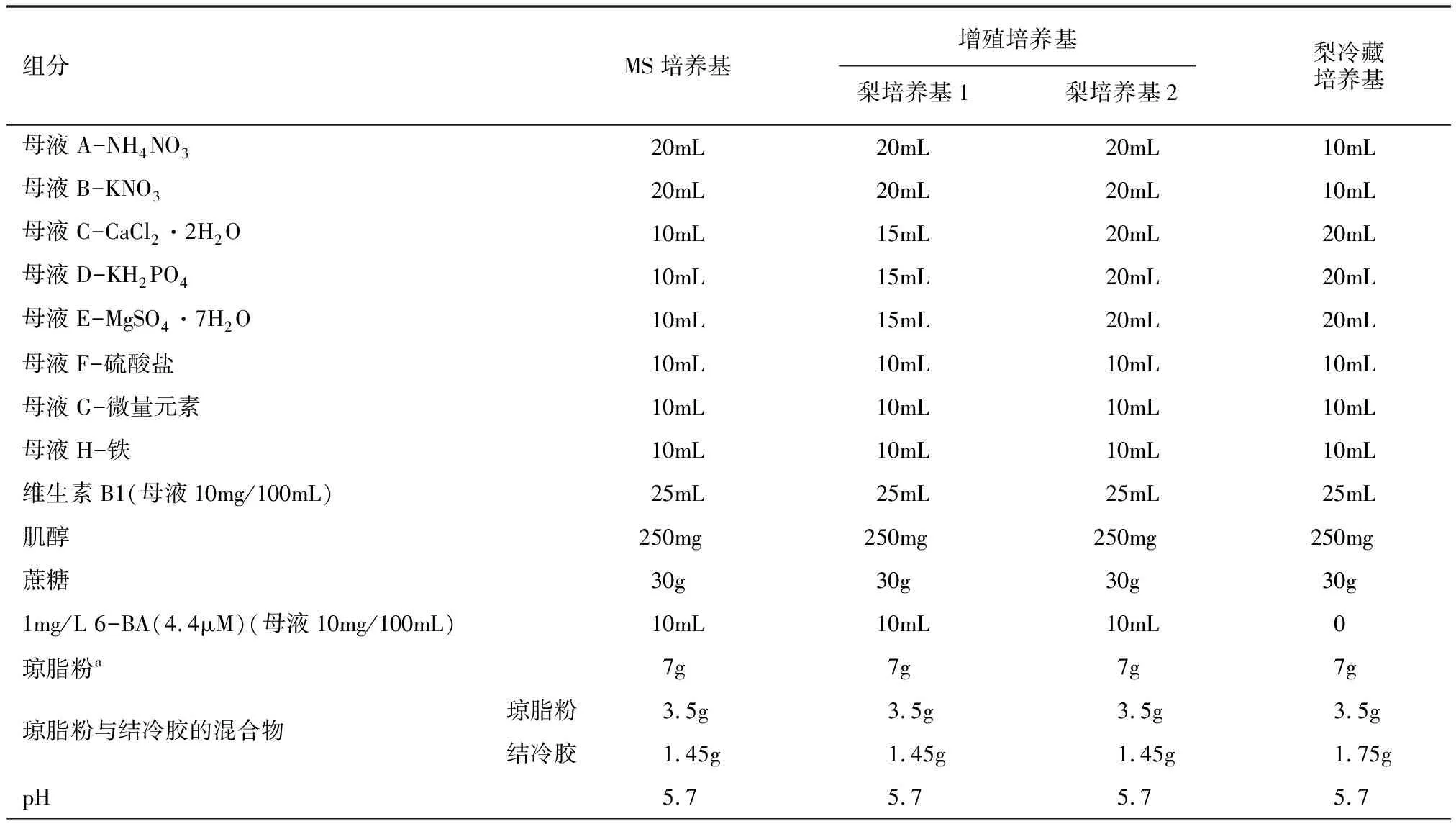
表2 MS培养基、梨增殖培养基和梨冷藏培养基配方
注:a表示可以用琼脂粉和结冷胶混合物替代。
2 材料
2.1 外植体
休眠期快结束时采集已满足需冷量的枝条,做好标记,4℃保存备用,用于催芽或作为接穗嫁接在砧木上,或在生长季的早期,从温室生长的植株上取幼嫩茎尖。
2.2 所需工具及设备
100mL烧杯、125mL三角瓶、组培瓶、医用纱布、橡皮筋、旋转摇荡器。组培设备和工具(超净工作台、解剖刀、解剖剪、镊子、工具消毒器等)。20%漂白剂(含6%NaOCl或5.7%有效氯)和吐温20(Tween20)。润湿剂(40L水或液体餐具洗涤剂中加入2mL润湿液Siltwet L-77)。50℃热水和20℃冷水。杀菌剂NuCop 50,浓度15mL/4L。保鲜剂Floralife。1L三角瓶(用于催芽)。
2.3 培养基
①1/2液体MS培养基[不含PGRs(植物生长调节剂),pH6.9],带盖污染物检测试管16mm×100mm,管内含5mL。②污染物检测培养基,9cm培养皿中加入营养琼脂(NA)。③增殖培养基,每个16mm×100mm试管中加入5mL。④增殖培养基,每个组培瓶中加入40mL。⑤不含PGRs的冷藏培养基。⑥生根培养基,每个组培瓶中加入40mL。
2.4 茎段冷藏
茎段培养至约5cm,转移至半透明塑料组培袋(StarPac袋)、试管或三角瓶中,接种于不含PGRs的冷藏培养基上。低温驯化(-1℃ 16小时黑暗/22℃ 8小时光照)后,置于培养箱或低温室中冷藏(1~4℃)。
2.5 驯化材料
无菌灌封的混合或预制培养基。雾床、透明玻璃试管或玻璃瓶。用于微嫁接的砧木苗。
2.6 微嫁接材料
与微繁茎段具有相同干径的幼苗。微嫁接后用于覆盖植株的玻璃瓶或塑料杯。嫁接刀或手术刀。
2.7 冷冻保存材料
①植株在-1℃16小时、22℃8小时条件下驯化1~4周。②装有预处理培养基(含5% DMSO和8%琼脂的MS培养基)的培养皿。③精细解剖工具及双目低倍显微镜、无菌烧杯和培养皿、2mL无菌移液器、无菌过滤瓶、无菌滤纸。④MS液体培养基(含2M甘油和0.4M蔗糖)。⑤MS液体培养基(含1.2M蔗糖,pH5.8)。⑥恢复培养基(在小培养皿或多孔板中使用不含生长素的标准生长培养基)。⑦冻存管、冻存管架(在冰块或碎冰中预冷)、杜瓦(Dewar)瓶(用于盛装液氮)。
3 梨的微繁方法
梨的微繁效率很大程度上取决于基因型,但也遵循一些适用原则。首先,材料一定要健康、不携带病虫卵;茎段生长活跃、无病症。其次,采集茎段后,对外植体进行细菌和真菌污染物检测,选择无污染的茎段进行增殖。再次,确定合适的生长培养基、冷藏条件、生根步骤及炼苗条件,最终培养出健壮的生根苗。
3.1 培养基配制和灭菌
3.1.1 细菌检测培养基 液体MS检测培养基。配制不含PGRs的1/2 MS培养基(pH 6.9),取5ml加入16mm×100mm试管。轻微盖上盖,不要盖紧,121℃高压灭菌20分钟后,将盖彻底盖紧。营养琼脂(Nutrient Agar ,NA)检测培养基。配制添加1g/L酵母提取物和10g/L葡萄糖NA培养基。灭菌后微冷却后,倒入9cm培养皿中,培养皿盖半开,冷却45分钟,使多余水分蒸发。平板可在室温下倒置保存2个月。
3.1.2 梨增殖培养基 在烧杯中加入1/2体积的蒸馏水或去离子水,依次加入矿质元素、维生素、蔗糖和PGRs,每次加入后搅拌至完全溶解。用蒸馏水或去离子水定容,混匀。用NaOH或H3PO4调节pH至5.7。加入琼脂等固化剂,加热至琼脂完全融化,分装到高压灭菌的容器中。每个16mm×100mm离心管中加入5mL培养基用于芽的诱导,每个组培瓶中加入40mL培养基用于芽的增殖。盖子先不盖紧,121℃高压灭菌20分钟后,盖子彻底盖紧。将增殖培养基保存在干净的环境于2周内使用。
3.1.3 梨冷藏培养基 冷藏培养基为含1/2 MS氮源、加1g/L琼脂、不含PGRs的梨培养基2。
3.1.4 梨生根培养基的配制 采用快速浸渍的方法生根,配制不含PGRs的标准培养基;若在含生长素的培养基上生根,按注意事项⑥所述的PGRs浓度配制MS培养基。
3.2 外植体采集及消毒
3.2.1 接穗茎段 在休眠期将结束时采集已满足需冷量的接穗,于4℃保存。在晚冬或早春用劈接法嫁接到砧木幼苗上。嫁接后的植株置于温室中,生长至5~10cm时,采集茎段做外植体。
3.2.2 催芽 从冷库中取出接穗,用软刷在自来水下轻轻刷洗。在含润湿剂(2mL/40L)的50℃循环水中浸泡10分钟,立即转移到自来水(-20°C)中水浴10分钟。然后用流动的自来水冲洗,稍晾干,在杀菌剂NuCop 50中(15mL/4L)浸一下(浸铜处理),彻底吸干水分(浸铜处理时要戴手套)。使用蒸馏水或去离子水稀释FloraLife保鲜剂至10g/L,在1L三角瓶中加入500ml。用对角剪切的方式修剪茎段基部后,接种到组培瓶中,每次剪切后剪子浸在20%漂白水中消毒。将组培瓶置于温室中培养,每周更换1次保鲜液。芽长至5~10cm时,切下3~5cm的茎尖进行表面消毒。
3.2.3 外植体的表面消毒 剪下的茎尖放入100mL烧杯中,烧杯口覆盖纱布,用橡皮筋绑好。烧杯放在塑料盘中,用流动的自来水冲洗10分钟后倒掉水,去除纱布。在装有外植体的烧杯中加入漂白液(10%漂白粉加入3滴吐温-20),放在摇床上摇动10分钟(转速25~30rpm)。把茎段转移到含无菌水的烧瓶中,漩涡2分钟后,换新的无菌水浸泡2分钟。
3.2.4 外植体修剪及污染物检测 将消毒过的茎段置于无菌滤纸上修剪基部,修剪后置于新的无菌滤纸上。将茎段接种在含1/2液体MS细菌检测培养基的试管中,做好标记。将试管放在培养室中,弱光下培养1周,丢弃染菌的茎段。若1周后培养基无污染,取出外植体,修剪茎段的基部。将茎尖接种到含固体增殖培养基的试管中。剪下的基部在细菌检测平板上划线,留下一部分接种到NA培养基上。平板做好标记并放置3周,观察细菌或真菌的生长状况。如果NA平板3周后没有污染,将外植体转移到含增殖培养基的组培瓶中。如已污染,丢弃所有材料。
3.3 增殖
将茎段分为2或3段(3~5cm),接种至增殖培养基上,每3周更换1次。根据需要在NA平板上检测是否存在细菌污染。培养条件25℃,16小时光照,70~100μE/m2·s。
3.4 生根
生根前茎段长至5cm。剪去茎段的基部,接种到生根培养基上。若采用蘸根的方法,剪去基部,在10mM IBA或NAA中浸渍5秒后,接种到不含PGRs的培养基中,至根系长至3~5cm。若不生根,在生根剂中浸泡一下,然后移至温室中生长。若仍不生根,将茎段微嫁接于干径相同的砧木上。
3.5 炼苗
组培瓶移至温室的前2天,打开瓶盖,便于空气流动。从琼脂培养基中取出已生根的幼苗,用清水将附着的琼脂冲洗干净后,栽植于营养钵中并置于雾床上,或用透明的塑料袋、塑料杯或玻璃瓶覆盖保湿, 2~4周后移至温室组培架上。
3.6 茎段冷藏
梨的茎段低温驯化后可在1~4℃条件下保存1~4年,中间不需更换培养基。将茎段接种到MS培养基上培养1个生长周期(3周),然后转移至装有新鲜冷藏培养基的热密封塑料组培袋中。在生长室中培养1周后,在低温条件下驯化1周。驯化条件:1~4℃,低光强(10~20μE/m2·s)或黑暗条件下放置12小时。一般情况下,茎段的保存时间为2~3年。保存时间因基因型而异,所以每隔4~6个月需对保存材料进行1次评估,视情况需要重新繁殖。
3.7 冷冻保存(玻璃化程序)
冷冻保存前2天,从低温驯化的茎段上剪下0.8mm茎尖,并接种到预处理培养基中[含5%DMSO(二甲基亚砜)、增加1g/L琼脂的标准生长培养基],在培养箱中培养2天(-1℃16小时,22℃8小时)。冷冻保存当天,配制冷冻保护剂PVS2(在MS液体培养基中加入30%甘油、15%乙二醇、15% DMSO、0.8M蔗糖,调节pH至5.8),使用前过滤除菌,于4℃保存。注意在试验当天将冷冻保护剂混匀并过滤除菌,试验完成后不要存放。在冻存管中加入1mL上样溶液(含2M甘油和0.4M蔗糖的MS液体培养基),将预处理培养基中的茎尖取出,接种到冻存管中的上样溶液中,冰浴20分钟。
玻璃化程序。在小杜瓦瓶中装满液氮,用2mL无菌移液器小心吸出冻存管中的上样溶液,将茎尖留在冻存管中。在冻存管中加入1mL PVS2,准确计时,处理20分钟(0℃),注意处理时间不要过长,否则对茎尖会产生毒害作用。处理结束时,将冻存管的盖子轻轻盖上(不要太紧,否则液氮会进入冻存管中),用镊子将冻存管在液氮中浸15秒。
复温程序。从液氮中取出1或2个冻存管,45℃水浴1分钟,同时搅拌。然后25℃水浴(无菌水或干净的自来水)1~2分钟。打开盖子之前先擦干冻存管外壁的水分,用2mL无菌移液器快速吸除1/2体积的PVS2。立即加入1.2M的蔗糖漂洗培养基。去除冻存管中的溶液,并用漂洗培养基重洗2次。将茎尖转移到滤纸上,然后置于恢复培养基中。茎尖在黑暗中生长1周后,转移到有光照的组培架上培养。
4 注意事项
①蔗糖是组培中最常用的碳源;琼脂通常用作培养基的固化剂,也可使用琼脂和结冷胶(PhytagelTM或GelriteTM)或玉米淀粉和结冷胶的混合物。在培养基中加入2~10μM的6-BA可以诱导腋芽生长。通常情况下,增殖培养基中加入0.01~0.05μM的IBA或NAA,但一般不用GA3,因为GA3可能抑制某些基因型的增殖或生根。②在所有组培步骤中,作为外植体的母本质量最为重要。应选择健康、无病症、活跃生长的茎段。催芽时,每周换水,茎段用干净的剪刀修剪。从之前的嫁接株采集外植体很难成功,而且更易产生细菌污染。嫁接接穗的童性能保持长达两年。③尽早检测污染,以免污染源从一个植株传到其他植株。将外植体放在含有液体检测培养基(1/2 MS,pH 6.9)的试管中培养1周。如果试管变浑浊,说明材料已染菌,丢弃不用;若试管不变浑浊,用外植体的基部在NA平板上划线,将材料转移至含固体生长培养基的试管中培养3周。NA平板用于检测其他污染,如观察到污染,将茎段丢弃;如3周后无污染,则茎段可用于增殖。④使用梨培养基1进行芽的诱导。基因型不同,增殖培养基配方也不同。建议先用梨培养基1,若生长缓慢,再换用梨培养基2。⑤低温驯化可延长茎段的保存时间。多数情况下,22℃,8小时光照(10μE/m2·s)和-1℃,16小时黑暗培养1~2周,对于多数基因型效果显著,可以延长保存时间。⑥一般情况下,梨组培苗的生根都需生长素处理。研究表明,在10mM IBA溶液浸泡15秒对18份梨种质都有效果;12份梨种质先在含10mM IBA的培养基上生长1周后,转移至不含PGRs的培养基上培养3周均可生根;对其他28份种质而言,用IBA生根困难,但用10mM NAA浸泡15秒对其中的8种基因型有效;10份种质可在含10μM NAA的培养基上生根。⑦可通过微嫁接的方法将茎段转移到温室中培养。将茎段(1.5~3.5cm)从培养容器中取出,用改良劈接法嫁接。砧木可以是嫩枝,也可以木质化,但其粗度应与接穗的粗度差不多。砧木在距基部合适的距离剪断,用嫁接刀在砧木干径中央切0.5cm深的切口,在接穗基部剪一个V形切口,将接穗插入砧木中,然后用封口膜捆绑好嫁接口后,必须在上面套一个试管保湿或置于雾床上培养3周,直至嫁接口愈合。之后去除套管,使之适应温室环境。⑧低氮源培养基对梨茎段的保存至关重要。在保存之前的最后一个生长周期保持低氮、低营养,之后的保存培养基中低氮、高营养,保存时间最长。⑨PVS2溶液可使细胞脱水,细胞内残留的水分与液氮接触将玻璃化。置于PVS2中时间过长,细胞将因过度脱水而死亡;而接触时间不足,又会导致细胞内形成晶体而杀死细胞。因此,确定最佳的接触时间是冷冻保存成功的关键。
5 小结
梨的微繁过程包括茎尖培养、增殖、诱导生根及炼苗移栽等环节。先在1/2 MS培养基(pH6.9)或营养琼脂上划线培养1周,以检测茎段是否存在污染。在梨专用培养基上茎段的增殖和生长效果更好;与MS培养基相比,梨专用培养基中含4.4μM的6-BA,而且CaCl2、KH2PO4、MgSO4的浓度更高。多数情况下梨的茎段难以生根。由于基因型的差异,目前尚没有一种适用于所有梨品种组培苗生根的方法;通常在10mM IBA或NAA中浸渍5秒后,接种到不含植物生长调节剂的基本培养基上,可以诱导生根。生根的试管苗可在雾床上进行炼苗后移栽。
注:本文摘译自Reed B M, DeNoma J,Wada S,et al. Micropropagation of pear (Pyrussp.). In: Lambardi M, Ozudogru E, Jain S. Protocols for micropropagation of selected economically-important horticultural plants. Methods in Molecular Biology (Methods and Protocols), 2012, 994. Humana Press, Totowa, N J. 参考文献略。

