中华蜜蜂Apidaecin的重组表达及其抗菌活性
陈文凤,王红芳,刘振国,张卫星,郗学鹏,胥保华
中华蜜蜂Apidaecin的重组表达及其抗菌活性
陈文凤,王红芳,刘振国,张卫星,郗学鹏,胥保华
(山东农业大学动物科技学院,山东泰安 271018)
【目的】研究中华蜜蜂()抗菌肽Apidaecin在枯草芽孢杆菌()中的重组表达,并验证纯化后的重组抗菌肽Apidaecin在体内和体外是否具有抗菌活性,为开发新型、安全具有抗菌和免疫调节功能的抗菌肽制剂提供理论依据。【方法】以意大利蜜蜂()Apidaecin为模板,克隆出中华蜜蜂抗菌肽Apidaecin,成功构建his-pHT43/Apidaecin表达载体,并参照MoBiTec所提供的制备方法成功制得枯草芽孢杆菌感受态细胞,现配现用,以保证其活性并得以在枯草芽孢杆菌表达系统中重组表达。使用His标签蛋白纯化试剂盒(可溶性蛋白)进行表达蛋白的分离纯化,使用Easy II Protein Quantitative Kit(BCA)试剂盒测定浓度。纯化得到的重组抗菌肽Apidaecin作用于大肠杆菌K88,在体外进行抑菌圈试验和最小浓度抑菌法测定;在体内,以小鼠为试验动物模型,试验组小鼠腹腔注射重组抗菌肽Apidaecin,阴性对照组注射相同体积的生理盐水,阳性对照组注射相同体积的头孢霉素,然后人为感染大肠杆菌K88,感染24 h后对小鼠进行解剖,取得肠道样品和血液样品,并从肠道屏障和免疫功能两个方面探讨重组抗菌肽Apidaecin对感染大肠杆菌K88小鼠的保护作用。使用ELISA试剂盒对染菌小鼠血清免疫球蛋白(IgA、IgG、IgM)与肠道sIgA水平进行测定,采用qRT-PCR法对小鼠肠道紧密连接蛋白基因(claudin-1、ZO-2)以及小鼠肠道细胞因子(促炎因子TNF-、IFN-、IL6和抑炎因子IL10)的转录水平进行测定。【结果】克隆得到的中华蜜蜂含有183 bp的碱基,编码60个氨基酸,包含Apidaecin的信号肽序列、一个基础的RR二肽以及抗菌肽Apidaecin的氨基酸序列(内含高度保守的8个氨基酸序列),编码的蛋白质命名为AccApidaecin,其分子量为15.6 kD,等电点为5.33。在IPTG终浓度为3 mmol·L-1,诱导温度为30℃,诱导表达12 h后,可从1 L表达上清中纯化得到约20 mg抗菌肽。药敏试验显示,重组抗菌肽Apidaecin在体外与阴性对照相比有明显抑菌圈出现,且测得的最小抑菌浓度为10 mg·L-1;在小鼠体内,腹腔注射重组抗菌肽Apidaecin的染菌试验组与注射生理盐水的染菌试验组相比免疫球蛋白含量差异显著(<0.05),说明腹腔注射重组抗菌肽Apidaecin能够有效缓解由大肠杆菌K88引起的小鼠免疫球蛋白含量的增加;同时,小鼠肠道相关蛋白的基因表达量也差异显著(<0.05),说明重组抗菌肽Apidaecin能够有效保护被大肠杆菌K88侵染的小鼠肠道。【结论】在枯草芽孢杆菌中能够成功重组表达中华蜜蜂抗菌肽Apidaecin,并且纯化后的中华蜜蜂抗菌肽Apidaecin在体外对大肠杆菌K88有良好的抗菌效果;经腹腔注射进入小鼠体内,能够提高小鼠的免疫机能,有效抵抗大肠杆菌K88对小鼠的侵染。
中华蜜蜂;抗菌肽;重组表达;大肠杆菌;抗菌活性
0 引言
【研究意义】抗生素对于人类的健康和社会的发展具有重要作用,但目前抗生素滥用现象已引起国内外的密切关注,并且抗菌药物的耐药性已被视为全球最危害公众健康的问题之一。为了应对耐药性菌株感染,研究者一方面在对传统抗生素进行结构改造降低病原菌耐药性,提高药物疗效,另一方面也在不断研究和开发新型抗菌药物。自第一个昆虫源的抗菌肽报道以来,抗菌肽作为一种潜在的替代药物立即引起了人们的高度关注。蜜蜂是各种作物的有效传粉者,对农业和生态环境中都具有至关重要的作用,同时蜜蜂也经常暴露于各种病原体的胁迫环境中。在长期与外来病原物作斗争的过程中,蜜蜂形成了与之相对应的分子进化策略,发展出反应灵敏且高表达的Apidaecin抗菌肽基因家族以及其他抗菌肽家族,由于其具有天然的抗菌活性,有望成为抗生素的替代品。从天然组织中分离抗菌肽工作量大,难度高,且获得的量很少;化学合成虽然能提供大量的抗菌肽,但价格昂贵,无法满足研究和潜在应用的需求。随着现代基因工程技术的不断发展,使大规模生产抗菌肽并降低生产成本具备了可行性,因此探索适合的基因表达系统表达出大量具有活性的抗菌肽具有重要意义。【前人研究进展】在过去几十年的研究中,人们对大肠杆菌()系统的遗传学、生物化学和分子生物学方面有了充分的认识,使之成为许多外源蛋白的首选表达系统。大肠杆菌遗传图谱明确,易培养、周期短、费用低[1],对许多蛋白质有较强的耐受能力,能较高水平地表达多种蛋白[2],所以成为应用于DNA重组技术的主要宿主细菌。然而抗菌肽的抗菌特性使得它们对宿主菌具有潜在的致命毒性,这成为抗菌肽在大肠杆菌中重组表达面临的巨大挑战。酵母具有比大肠杆菌更完备的基因表达调控机制和对表达产物的加工修饰和分泌能力,并且不会产生内毒素,是基因工程中良好的真核基因受体菌[3],但发酵周期相对较长。枯草芽孢杆菌()属于芽孢杆菌属,是一类好氧型、内生抗逆性孢子的革兰氏阳性菌。对于饲用抗菌制剂的开发,枯草芽孢杆菌表达系统拥有独特的优点。与大肠杆菌表达系统相比较,枯草芽孢杆菌细胞壁不含内毒素,是被公认的安全微生物,可直接添加于饲料中;与酵母表达系统相比较,枯草芽孢杆菌发酵周期短,操作简单,没有明显的密码子偏好性;枯草芽孢杆菌对培养基的要求远低于酵母,生产成本低[4-6]。此外,枯草芽孢杆菌是猪等动物肠道中的一种益生菌,对维持动物肠道健康具有重要作用。同时蛋白酶缺陷型菌株的构建提高了目的蛋白的表达水平,新型载体的设计提高了质粒的稳定性等[7]。因此,枯草芽孢杆菌表达系统适于大多数饲用抗菌肽的重组表达。蜜蜂抗菌肽是蜜蜂在受到病原物感染后,其脂肪体迅速合成的一些具有抗菌活性的肽类,然后释放到血淋巴中发挥抑制细菌、真菌、病毒的作用[8]。蜜蜂抗菌肽属于先天免疫,在体液内有4个基因家族:Apidaecin[9]、Abaecin[10]、Hymenoptaecin[11]、Defensin[12]。其中,Apidaecin是蜜蜂体液中最早被研究的一种抗菌肽,主要对革兰氏阴性菌起作用。另外,独特的前体结构使受到极少量的病原物刺激后即迅速表达[9]。并且自然界中的野生中华蜜蜂()种群由于一直受到相对较强的环境选择压力,从而保持了中华蜜蜂原有的抗菌肽基因的多样性,长期的家养驯化使得意大利蜜蜂()抗菌肽基因退化。【本研究切入点】抗菌肽作为昆虫体液免疫系统的重要成分,为昆虫抵御病原物的侵袭建立了坚固的屏障。但目前有关蜜蜂抗菌肽的研究报道几乎都集中于意大利蜜蜂,中华蜜蜂的相关报道很少,其中对于中华蜜蜂重组抗菌肽抗菌活性的研究更少。【拟解决的关键问题】通过基因工程技术,利用枯草芽孢杆菌表达系统表达中华蜜蜂抗菌肽Apidaecin,并对其进行体内和体外抗菌活性的验证,为开发新型、安全具有抗菌和免疫调节功能的抗菌肽制剂提供理论依据。
1 材料与方法
试验于2016—2017年在山东农业大学动物科技学院完成。
1.1 材料
供试昆虫:中华蜜蜂取自山东农业大学试验蜂群。供试小鼠为屏障环境SPF级KM小鼠。
主要试剂:总RNA提取试剂盒(Trizol)、大肠杆菌感受态DH5购自北京全式金公司;原核表达载体Pet-30a(+)由笔者实验室提供;DNA分子质量标准(DNA marker DL2000)、M-MLV反转录酶及SYBR Green Ⅱ定量试剂均购自日本Takara公司;异丙基硫代半乳糖苷(IPTG)、dNTP、LA-Taq DNA聚合酶及凝胶回收试剂盒均购自美国PUEX公司;枯草芽孢杆菌WB800N以及枯草芽孢杆菌表达载体his-pHT43购自于淼灵质粒平台(http://www.miaolingbio.com/);血清免疫球蛋白试剂盒以及肠道分泌型免疫球蛋白IgA试剂盒购自于科诺迪生物;His标签蛋白纯化试剂盒(可溶性蛋白)购自于康为世纪生物科技有限公司;Easy II Protein Quantitative Kit (BCA)试剂盒购自北京全式金公司。
1.2 方法
1.2.1 总RNA提取及cDNA的合成 Trizol法提取蜜蜂以及小鼠肠道样品的总RNA,紫外分光光度计测定总RNA浓度和纯度。用反转录试剂盒对总RNA进行反转录,反转录反应条件:体系混匀后,42℃反应40 min,75℃灭活5 min。反转录产物保存于-20℃。
1.2.2 中华蜜蜂引物设计、PCR扩增、克隆、测序以及诱导表达 引物设计:由于中华蜜蜂和意大利蜜蜂为两个亲缘关系最近的物种,同一基因的序列在这两个物种间变异很小,因此,根据GenBank中意大利蜜蜂基因序列(GenBank登录号LOC406115),利用Primer 5.0软件,设计基因序列引物,引物序列见表1,引物由上海生工生物工程技术有限公司(简称上海生工)合成。
在PCR扩增中,反应体系(25 μL):5 μL cDNA、2.5 μL 10×PCR缓冲液、1 μL dNTP、1 μL模板,上下游引物各1 μL、0.25 μL LA-Taq DNA聚合酶,18.25 μL双蒸水。扩增程序:94℃预变性4 min;94℃变性40 s,50℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min;4℃保存待测。将PCR产物经1%琼脂糖凝胶电泳并割胶纯化,克隆于T1载体内,最后将鉴定的阳性克隆菌送至上海生工进行测序。
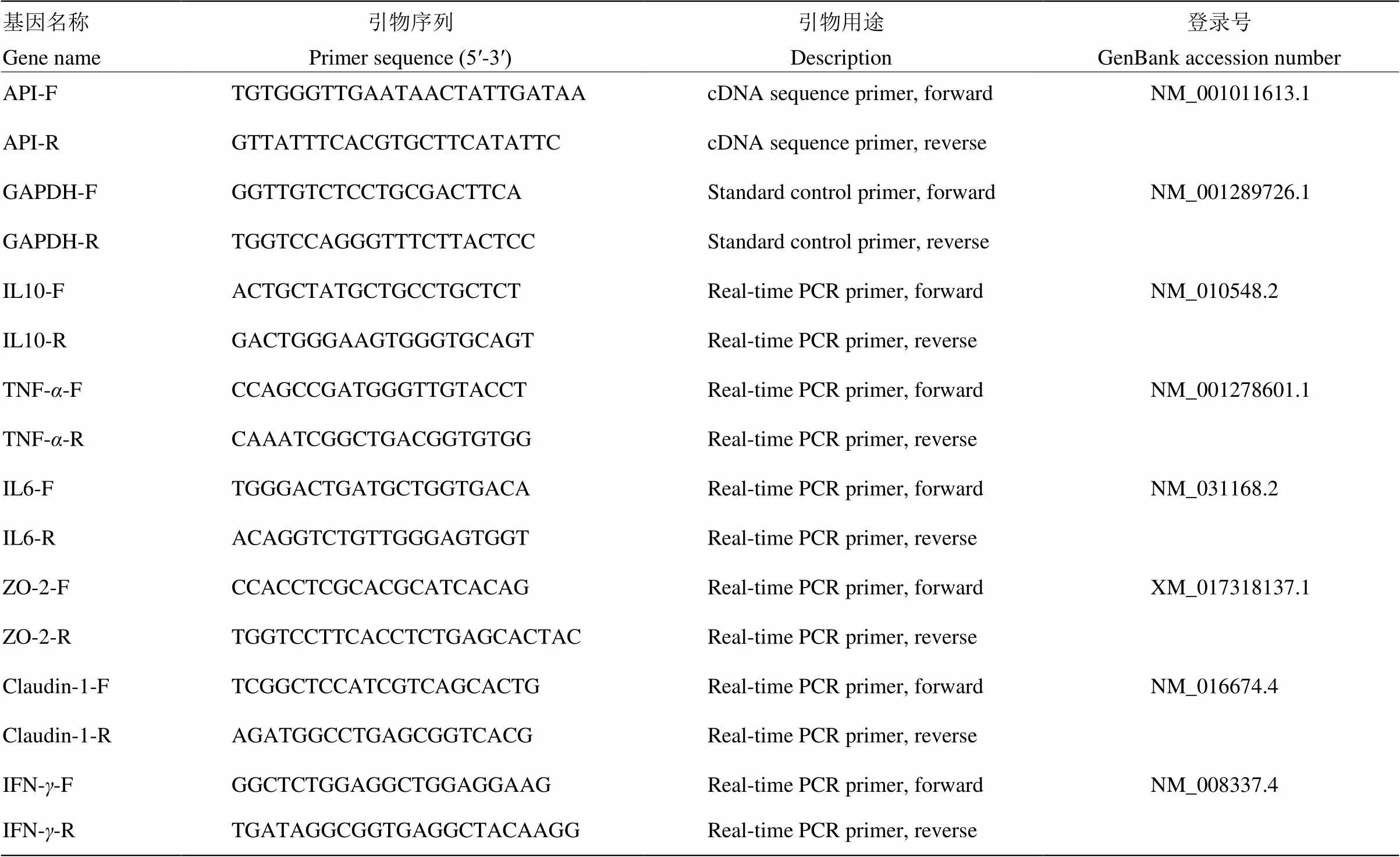
表1 基因引物序列
根据测序结果和比对结果,选择比对后的特异性序列,然后将含特异性序列的菌液送至上海生工并由其克隆至载体pHT43。
1.2.3 菌株转化、蛋白诱导表达纯化以及蛋白浓度测定 枯草芽孢杆菌感受态细胞的制备和转化以及诱导表达参见MoBiTec所提供的制备方法(https://www. mobitec.com/cms/products/bio/04_vector_sys/bacillus_subtilis_expression.html),获得的枯草芽孢杆菌感受态细胞应立即使用,以保证最高的转化效率。在IPTG终浓度为3 mmol·L-1,诱导温度为30℃,诱导表达12 h后进行分离纯化。收集菌体,超声破碎,4℃,12 000 r/min离心15 min,收集上清,按His标签蛋白纯化试剂盒(可溶性蛋白)操作说明书进行蛋白的纯化,并使用BCA蛋白定量方法测定纯化后的蛋白浓度。
1.2.4 实时荧光定量PCR(qRT-PCR) 取1 μL cDNA加入到20 μL荧光定量体系中,按照荧光定量试剂盒(TaKaRa)操作指南,用7500 real-time PCR仪(ABI 7500,USA)检测目的基因相对表达量。反应程序:预变性95℃,10 s;变性95℃,5 s;退火60℃40 s,40个循环,熔解曲线添加,1个循环。目的基因引物设计参考序列来自于NCBI数据库,以为内参,采用Primer 5.0进行引物设计,委托上海生工合成引物,引物序列如表1所示。
1.2.5 小鼠分组与处理 18—20 g体重的雄性小鼠60只,随机分成6组,每组10只,购自济南朋悦实验动物繁育有限公司;小鼠日粮为小鼠SPF级大小鼠维持饲料,购自华阜康生物有限公司;饲养环境:屏障系统,温度控制在22—25℃,相对湿度40%—60%,黑暗12 h,光照12 h。6组不同处理参考小鼠试验分组(表2),接菌后,取肠道相关样品进行试验。
1.2.6 抑菌圈检测重组抗菌肽的抗菌活性 环划线接种大肠杆菌于琼脂平板,37℃生化培养箱过夜培养至长出单菌落。挑取单菌落接种于5 mL新鲜肉汤培养基中,于37℃摇床中恒温振荡培养过夜;将上述过夜培养菌悬液50 μL转接至5 mL新鲜肉汤培养基中,于37℃恒温振荡培养2—3 h至吸光值OD600=0.5左右。取100 μL菌悬液均匀涂布于固体培养基上,将纸片轻轻放置于涂布好菌液的培养基上,滴加3—4 μL相应的液体,设置阴性(灭菌水)和阳性(头孢霉素)对照,按照同样的方法和步骤,设置4个重复的固体培养基,倒置于37℃恒温培养箱中过夜,观察并拍照记录结果。
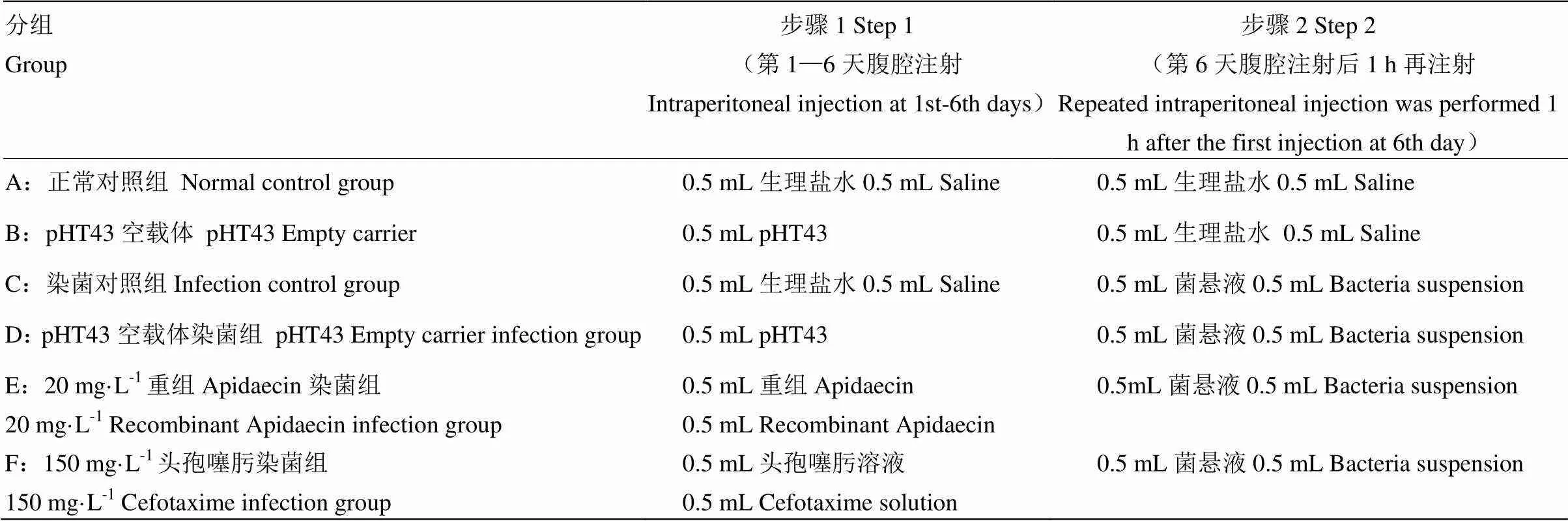
表2 重组抗菌肽Apidaecin对小鼠感染大肠杆菌K88保护作用试验分组
菌悬液指OD600=0.5的大肠杆菌K88[13]菌悬液The bacteria suspension refers to theK88 suspension of OD600=0.5
1.2.7 最小抑菌浓度法(MIC)检测重组抗菌肽的抗菌活性 将同1.2.6方法培养的OD600=0.5的菌悬液10 μL转接至10 mL新鲜肉汤培养基中,涡旋振荡混匀;此时细菌密度在1×105cfu/mL,用于MIC的测定。将抗菌肽与抗生素进行梯度稀释,至终浓度为2 560、1 280、640、320、160、40、20、10、5和2.5 μg·mL-1系列浓度稀释液;向无菌96孔圆底板中加入90 μL制备好的菌悬液,再逐一加入10 μL相应浓度的抗菌肽稀释液或抗生素稀释液,待测终浓度分别为256、128、64、32、16、8、4、2、1、0.5、0.25 μg·mL-1;设菌悬液为阳性对照孔,肉汤培养基为阴性对照,重组抗菌肽和抗生素(头孢菌素)均设3次重复,将96孔板置于37℃生化培养箱中保湿静置培养18—24 h,培养后观察各孔底部是否有细菌沉淀产生,无肉眼可见细菌沉淀的最小浓度可判定为该抗菌物质的MIC。
1.3 数据分析
数据采用SAS 9.2软件进行单因素方差分析(one- way ANOVA)和Turkey检验进行比较分析,结果表示为平均值±标准差。<0.05表示差异显著。
2 结果
2.1 中华蜜蜂Apidaecin cDNA的克隆以及序列分析
以中华蜜蜂总RNA反转录的cDNA为模板,利用引物API-F/ API-R进行PCR扩增,获得一条183 bp特异性片段(图1),通过ExPASy网站(http://www. expasy.cn)进行分析获得中华蜜蜂,含有183 bp的碱基,编码60个氨基酸,编码蛋白质命名为AccApidaecin,其分子量为15.6 kD,等电点为5.33。其氨基酸序列分析如图2所示。
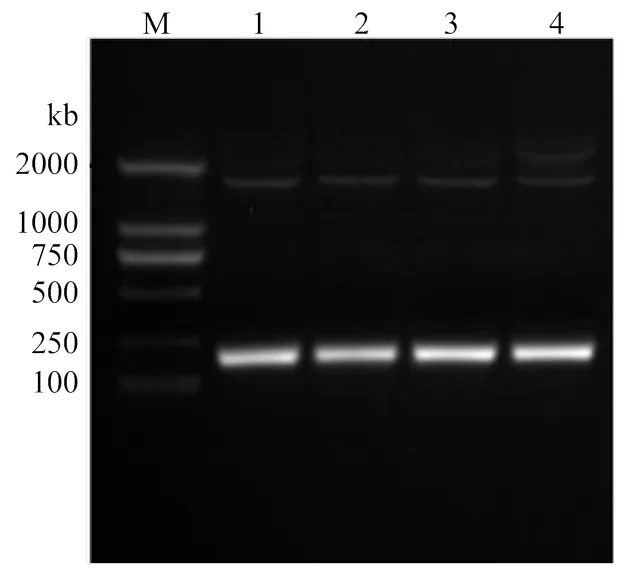
M:DL 2000 DNA Marker;1—4:基因扩增产物Product of genome walking
2.2 AccApidaecin蛋白的纯化与分离
在枯草芽孢杆菌中重组表达了具有活性的AccApidaecin。在IPTG终浓度为3 mmol·L-1,诱导温度为30℃,诱导表达12 h后进行分离纯化。抗菌肽主要分布在胞外,分泌效率高。通过His标签蛋白纯化试剂盒(可溶性蛋白)从1 L表达上清中纯化得到了约20 mg抗菌肽,图3为SDS-PAGE电泳结果。
2.3 抑菌圈检测重组抗菌肽的抗菌活性
将OD600=0.5的K88均匀涂布于固体培养基上,5个0.5 cm的纸片上分别滴加3 μL的灭菌双蒸水、10 mg·L-1重组AccApidaecin、20 mg·L-1的重组AccApidaecin、10 mg·L-1的头孢霉素和100 mg·L-1的头孢霉素,涂好的培养基放于37℃培养箱中培养12 h。结果如图4所示,与阴性对照1号相比,其余均有明显抑菌圈出现,表明重组抗菌肽在体外具有良好的抗菌活性。
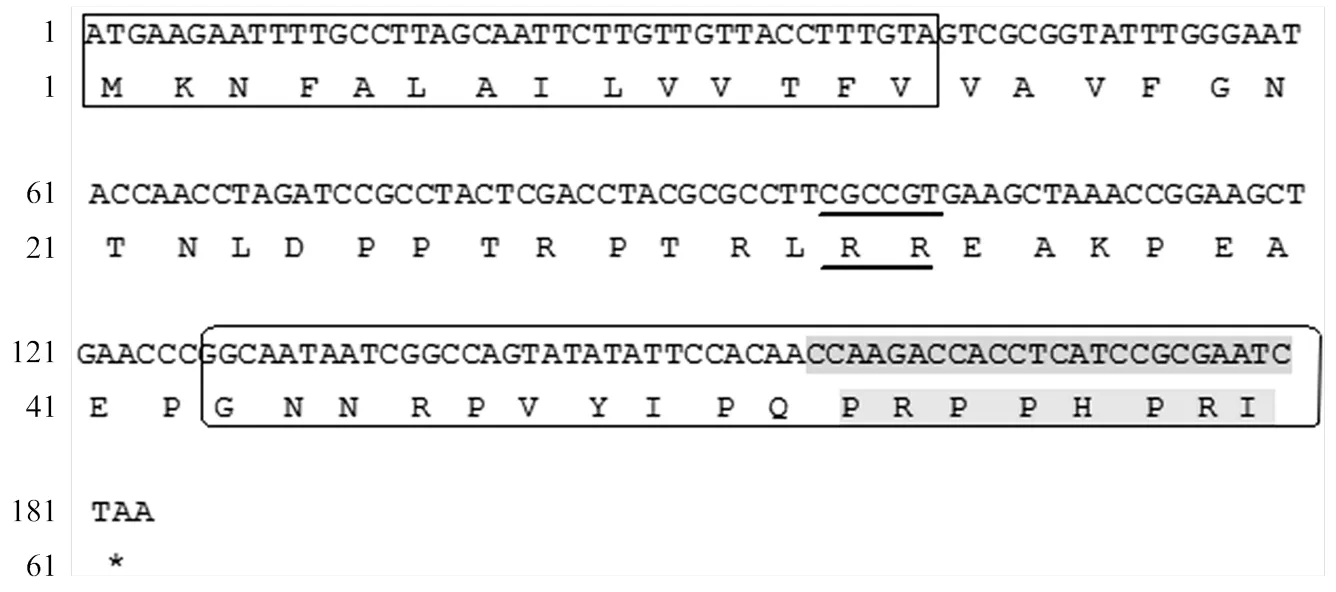
方框表示AccApidaecin的信号肽序列;下划线部分为一个基础的RR二肽;椭圆形边框表示抗菌肽AccApidaecin氨基酸序列,阴影部分为高度保守的8个氨基酸序列The box indicates signal peptide sequence of AccApidaecin; The underlined part represents a basic RR dipeptide; The oval border represents the amino acid sequence of AccApidaecin, and the shaded part is a highly conservative sequence of 8 amino acids
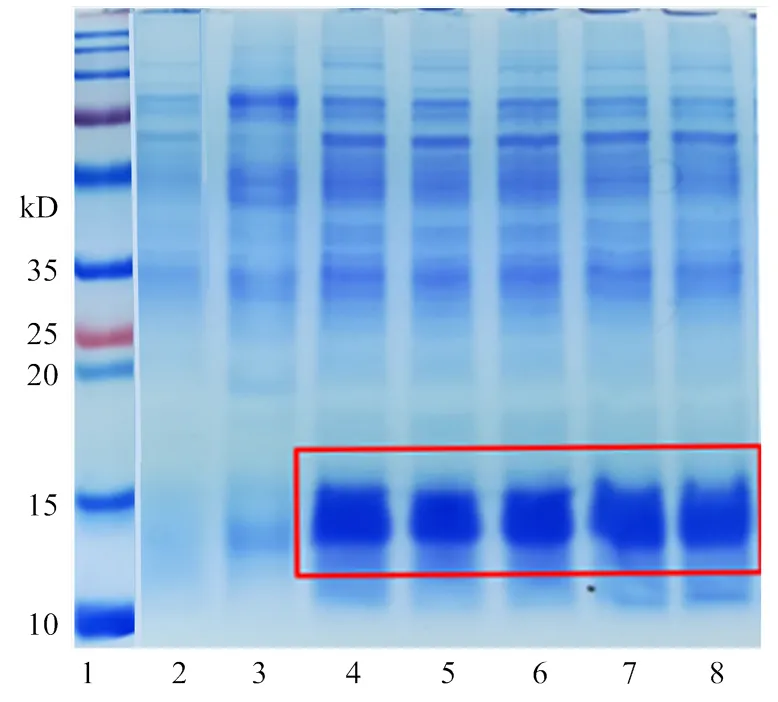
1:蛋白Marker protein marker;2:诱导表达的pHT43空载体induced overexpression of pHT43;3:未诱导表达的pHT43(+)-AccApidaecin non-induced overexpression of pHT43(+)-AccApidaecin;4—8:诱导表达的pHT43(+)-AccApidaecin Induced overexpression of pHT43(+)- AccApidaecin
2.4 最小浓度抑菌法检测重组抗菌肽的抗菌活性
重组抗菌肽AccApidaecin对K88的最小抑菌浓度为10 mg·L-1,头孢噻肟(Cafotaxime Na salt)对K88的最小抑菌浓度为5 mg·L-1。
2.5 重组抗菌肽对染菌小鼠血清免疫球蛋白含量与肠道sIgA水平的影响
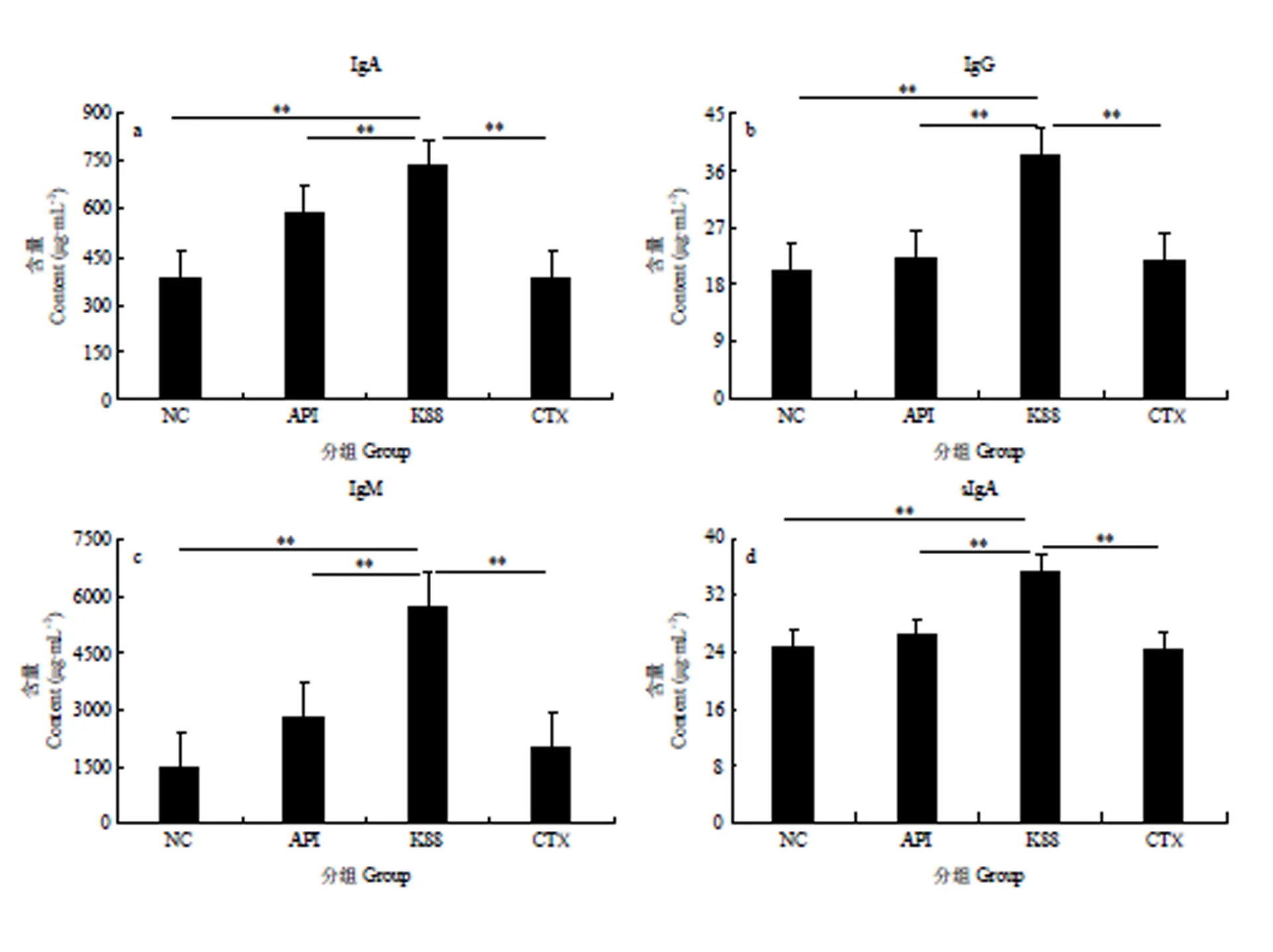
如图5所示,染菌对照组免疫球蛋白含量与肠道sIgA水平最高,并与其他各组差异显著。血清IgA、IgG和IgM水平变化与sIgA—致,表明重组抗菌肽AccApidaecin显著缓解由于染菌导致的血清和肠道免疫球蛋白含量的升高。
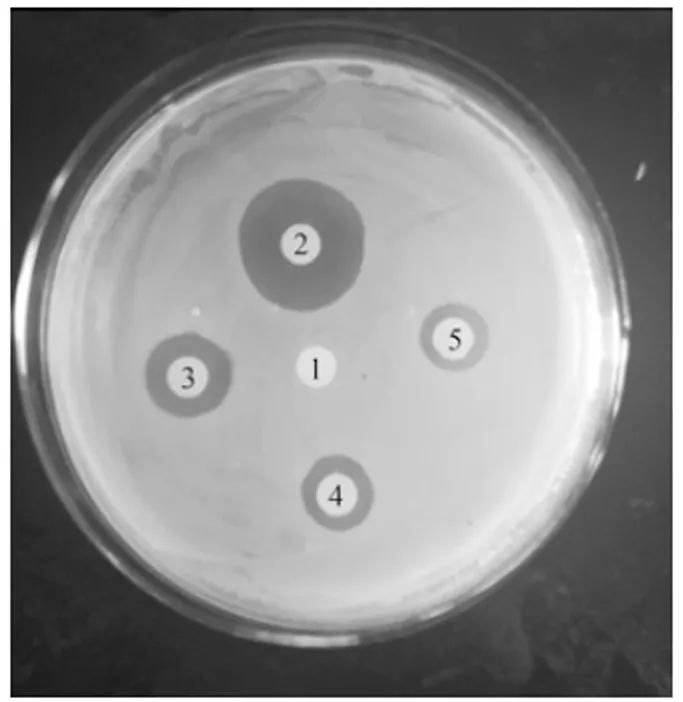
1:灭菌双蒸水Sterilized double distilled water;2:100 mg·L-1的头孢霉素Cafotaxime (100 mg·L-1);3:20 mg·L-1的重组Apidaecin recombinant Apidaecin (20 mg·L-1);4:10 mg·L-1的头孢噻肟Cafotaxime (10 mg·L-1);5:10 mg·L-1重组AccApidaecin Recombinant AccApidaecin (10 mg·L-1)
2.6 重组抗菌肽对染菌小鼠肠道相关蛋白基因表达的影响
采用qRT-PCR法对小鼠肠道紧密连接蛋白基因(claudin-1、ZO-2)以及小鼠肠道细胞因子(促炎因子TNF-、IFN-、IL6和抑炎因子IL10)的表达水平进行了测定,结果表明染菌后TNF-、IL6和IL10表达水平显著升高(<0.05),而claudin-1、ZO-2和IFN-表达水平显著降低(<0.05)(图6-a、6-b);然而染菌后,注射了重组抗菌肽和头孢霉素的试验组,都显著抑制TNF-、IL6和IL10表达水平的升高以及claudin-1、ZO-2和IFN-表达水平的降低(<0.05)(图6-c、6-d、6-e、6-f)。综合来看,重组抗菌肽Apidaecin能够有效保护大肠杆菌K88侵染后的小鼠肠道。
NC:正常对照组Normal control group;API:20 mg·L-1重组Apidaecin染菌组20 mg·L-1 Recombinant Apidaecin infection group;K88:染菌对照组Infection control group;CTX:150 mg·L-1头孢噻肟染菌组150 mg·L-1Cefotaxime infection group。图6同The same as Fig. 6
3 讨论
Casteels-Josson等[14]分析发现一个Apidaecin前体蛋白可加工生产最多可达12个Apidaecin的单元,即有重复单元的现象,导致的直接结果是可以迅速地增强昆虫本身的免疫应答,产生超量的蜜蜂肽。具有生物活性的Apidaecin是由两个加工序列EAEPEAEP(变异体)和RR连接在一起的。如图2所示,对克隆得到的序列进行分析,GNNRPVYIPQPRPPHPRI是Apidaecin的18个氨基酸序列,Apidaecin是富含脯氨酸的短肽,在C端具有高度保守的8个氨基酸(PRPPHPRL/I),而它们的N-末端是可变区,与其抗菌活性息息相关。目前,抗菌肽已在很多表达系统运用各种表达策略成功表达,例如大肠杆菌中的融合表达[15-17]和杂合表达[18-20]、毕赤酵母菌表达系统[21]、乳酸乳球菌表达系统[22]等,但对于重组抗菌肽的抗菌活性并没有进一步的研究与验证。
Apidaecin对革兰氏阴性菌效果显著,与细菌表面结合,然后转运到细胞质中,最后与靶蛋白结合(主要是热休克蛋白DnaK)。由于这种靶向特异性,Apidaecin对哺乳动物细胞是无毒的和非溶血的,因此被认为是新的抗生素候选药物[23]。本研究以大肠杆菌K88作为致病原对重组抗菌肽体外抗菌活性以及小鼠的体内抗菌活性进行验证,抑菌圈试验结果表明重组抗菌肽Apidaecin在体外具有良好的抗菌活性,重组抗菌肽Apidaecin对大肠杆菌K88的最小抑菌浓度为10 mg·L-1。
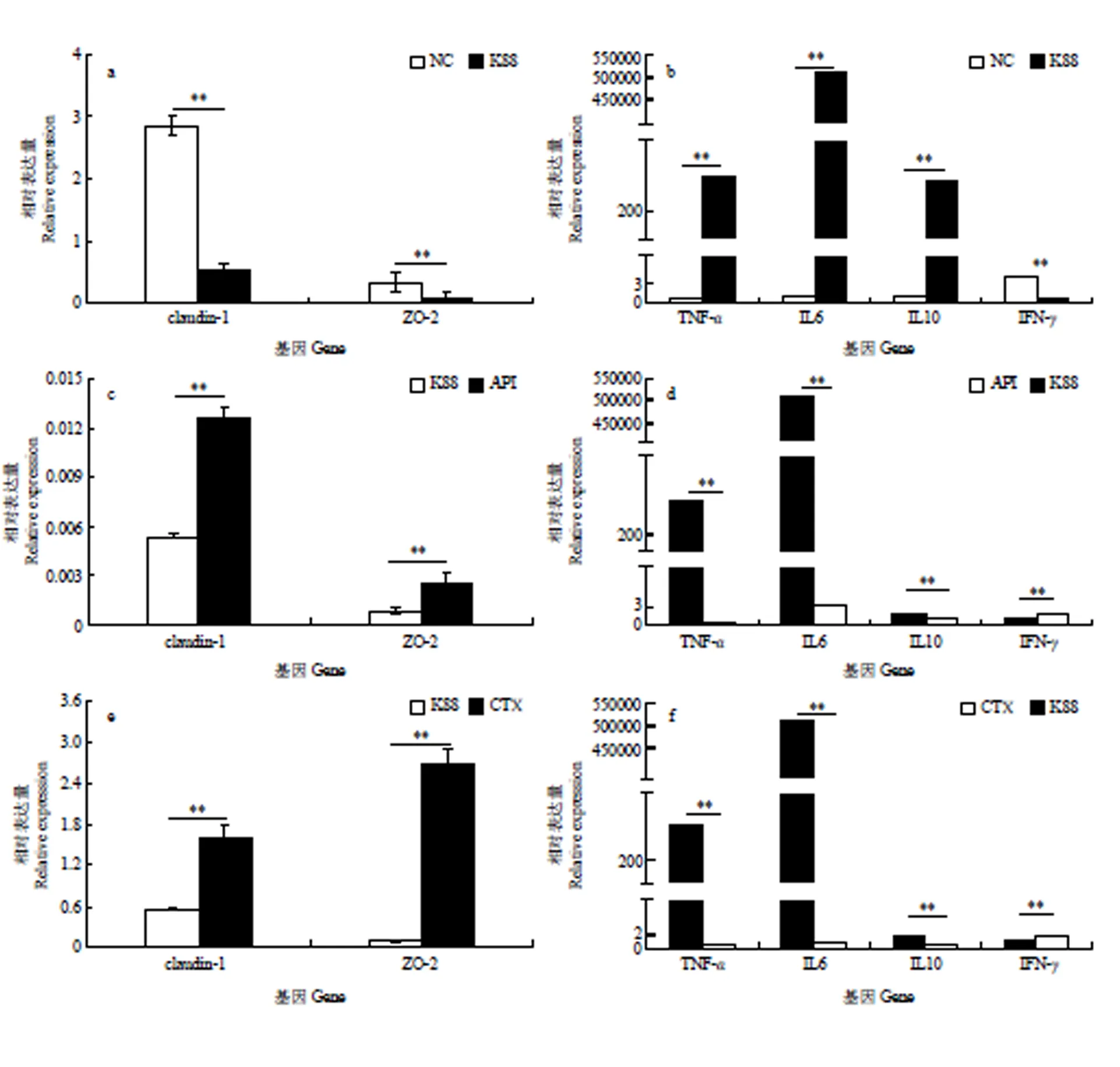
图6 重组抗菌肽对染菌小鼠肠道相关蛋白基因表达的影响
重组抗菌肽Apidaecin在体外具有良好的抗菌活性,但体内环境远比体外环境复杂。体内pH、离子强度以及宿主的蛋白酶等都会对抗菌肽造成影响。因此,本试验在获得重组抗菌肽的基础上,以小鼠为试验动物模型,从肠道屏障和免疫功能两个方面探讨重组抗菌肽Apidaecin对感染大肠杆菌K88小鼠的保护作用。紧密连接是肠黏膜机械屏障的重要组成部分,主要由跨膜蛋白和胞质蛋白组成,其中跨膜蛋白包括occludin、claudin-1、连接黏附分子等;胞质蛋白主要为ZO家族,与紧密连接结构的其他蛋白以及细胞骨架相连。紧密连接具有物质大小和电荷选择性,是决定肠道通透性的关键因素,维持紧密连接形态和功能的完整性对保护肠黏膜屏障、防止细菌移位有着重要意义[24]。小鼠肠道细胞因子(促炎因子和抑炎因子)平衡失调被认为是肠道炎症性疾病的一个重要发病机制,细胞因子异常表达与结肠炎的发生和发展密切相关[25]。本试验采用qRT-PCR法对小鼠肠道紧密连接蛋白基因(claudin-1、ZO-2)以及小鼠肠道细胞因子(促炎因子TNF-、IFN-、IL6和抑炎因子IL10)的表达水平进行了测定,结果发现大肠杆菌K88侵染小鼠后,导致claudin-1、ZO-2和IFN-表达水平显著低于正常对照组,而TNF-、IL6和IL10表达水平显著升高,与齐珂珂等[26]的研究相一致。而腹腔注射重组抗菌肽Apidaecin以及头孢霉素皆可以有效抵御大肠杆菌K88侵染小鼠带来的一系列炎症反应,表明重组抗菌肽Apidaecin 能够有效保护大肠杆菌K88侵染后的小鼠肠道。
本试验还检测了血清中免疫球蛋白(IgA、IgG、IgM)以及肠道中sIgA的含量,结果显示染菌组显著高于正常对照组,与之前余树培[27]报道的大肠杆菌K88可导致小鼠腹泻相符,表明大肠杆菌K88可导致小鼠染病并激起机体的免疫应答。空载体正常组与染菌组相比差异不明显,而重组抗菌肽Apidaecin以及头孢霉素的正常组与染菌组相比差异显著,这几种免疫球蛋白或细胞因子的水平在一定程度上反应了免疫功能[27-29],表明腹腔注射的重组抗菌肽Apidaecin能提高小鼠的免疫机能,从而抵抗大肠杆菌K88对小鼠的侵染。
目前,关于抗菌肽的抗菌机制有众多的猜想,但是抗菌肽抗菌机制研究只针对了个别几种,所以还没有一个能够涵盖所有种类抗菌肽作用机理的假说,而且也不确定哪种假说更接近真实情况[30]。常见的抗菌肽作用机制有桶板模型[31]、毯式模型[32]、环形孔模型[33]、凝聚模型以及其他作用机制[34]。对于重组抗菌肽Apidaecin的抗菌机制,还需要进一步深入研究。
4 结论
在枯草芽孢杆菌中成功重组表达得到了中华蜜蜂抗菌肽Apidaecin,其在体内/体外均对大肠杆菌K88有良好的抗菌效果,并且能够提高小鼠的免疫机能,抵抗大肠杆菌K88对小鼠的侵染。
[1] Parachin N S, Mulder K C, Viana A A, Dias S C, Franco O L. Expression systems for heterologous production of antimicrobial peptides., 2012, 38(2): 446-456.
[2] Sørensen H P, Mortensen K K. Advanced genetic strategies for recombinant protein expression in., 2005, 115(2): 113-128.
[3] Digan M E, Tschopp J, Grinna L, LAIR S V, CRAIG W S, VELICELEBI G, SIEGEL R, DAVIS G R, THILL G P. Secretion of heterologous proteins from the methylotrophic yeast,., 1988, 29: 59-65.
[4] Li W, Zhou X, Lu P. Bottlenecks in the expression and secretion of heterologous proteins in., 2004, 155(8): 605-610.
[5] VAN Dijl J M, HECKER M.: from soil bacterium to super-secreting cell factory., 2013, 12: 3.
[6] Westers L, Westers H, Quax W J., as cell factory for pharmaceutical proteins: a biotechnological approach to optimize the host organism., 2004, 1694(1/3): 299-310.
[7] BIEN T L T, TSUJI S, TANAKA K, TAKENAKA S, YOSHIDA K I. Secretion of heterologous thermostable cellulases in., 2014, 60(5): 175-182.
[8] 华婷. 蜜蜂抗菌肽Apidaecins在不同表达系统中融合表达的研究[D]. 北京: 中国农业科学院, 2017.
HUA T. Study on the fusion expression of antibacterial peptide apidaecins in various expression systems[D]. Beijing: Chinese academy of agricultural sciences, 2017. (in Chinese)
[9] Casteels P, AMPE C, JACOBS F, VAECK M, TEMPST P. Apidaecins: antibacterial peptides from honeybees., 1989, 8(8): 2387-2391.
[10] Casteels P, Ampe C, Riviere L, VAN Damme J, ELICONE C, FLEMING M, JACOBS F, TEMPST P. Isolation and characterization of abaecin, a major antibacterial response peptide in the honeybee ()., 1990, 187(2): 381-386.
[11] Casteels P, Ampe C, Jacobs F, TEMPST P. Functional and chemical characterization of hymenoptaecin, an antibacterial polypeptide that is infection-inducible in the honeybee ()., 1993, 268(10): 7044-7054.
[12] Casteels P, Tempst P. Apidaecin-type peptide antibiotics function through a non-poreforming mechanism involving stereospecificity., 1994, 199(1): 339-345.
[13] Wang K, Qi Y, Yi S, PEI Z, PAN N, HU G. Mouse duodenum as a model of inflammation induced by enterotoxigenicK88., 2016, 60(1): 19-23.
[14] Casteels-josson K, Capaci T, Casteels P, TEMPST P. Apidaecin multipeptide precursor structure: a putative mechanism for amplification of the insect antibacterial response., 1993, 12(4): 1569-1578.
[15] Aitken R, Gilchrist J, Sinclair M C. Vectors to facilitate the creation of translational fusions to the maltose-binding protein of., 1994, 144(1): 69-73.
[16] Murthy T V S. Expression of GST-fused kinase domain of human Csk homologous kinase from, facilitates easy purification., 2004, 26(5): 443-449.
[17] Peng C C, Chen J C, Shyu D J, CHEN M J, TZEN J T. A system for purification of recombinant proteins invia artificial oil bodies constituted with their oleosin-fused polypeptides., 2004, 111(1): 51-57.
[18] Xu X, Jin F, Yu X, REN S, HU J, ZHANG W. High-level expression of the recombinant hybrid peptide cecropinA (1-8)-magainin2 (1-12) with an ubiquitin fusion partner in., 2007, 55(1): 175-182.
[19] Bang S K, Kang C S, Han M D, BANG I S. Expression of recombinant hybrid peptide hinnavin II/-melanocyte-stimulating hormone in: Purification and characterization., 2010, 48(1): 24-29.
[20] Feng X, LIU C, GUO J, SONG X, LI J, XU W, LI Z. Recombinant expression, purification, and antimicrobial activity of a novel hybrid antimicrobial peptide LFT33.y, 2012, 95(5): 1191-1198.
[21] 施文, 马瑞, 周建业, 陈莉娅, 马媛媛, 黄慧敏, 张小凤, 易根云, 李志强. Apidaecin型抗菌肽在毕赤酵母菌中的基因工程表达. 口腔医学研究, 2017, 33(5): 471-474.
SHI W, MA R, ZHOU J Y, CHEN L Y, MA Y Y, HUANG H M, ZHANG X F, YI G Y, LI Z Q. Expression and identification of Apidaecin in.,2017, 33(5): 471-474. (in Chinese)
[22] 黄玉明. 中华蜜蜂apidaecin基因在乳酸乳球菌中的融合表达[D]. 广州: 中山大学, 2006.
HUANG Y M. Fusion expression ofapidaecin gene in[D]. Guangzhou: Sun Yat-Sen University, 2006. (in Chinese)
[23] Li W F, Ma G X, Zhou X X. Apidaecin-type peptides: biodiversity, structure-function relationships and mode of action., 2006, 27(9): 2350-2359.
[24] 马军宏, 于向阳, 张楠, 周振理. 紧密连接蛋白与肠黏膜屏障损伤研究进展. 中国中西医结合外科杂志, 2015, 21(1): 104-105.
MA J H, YU X Y, ZHANG N, ZHOU Z L. The progress of closely connected protein and intestinal mucosal barrier damage.,2015, 21(1): 104-105. (in Chinese)
[25] Torres M I, Ríos A. Current view of the immunopathogenesis in inflammatory bowel disease and its implications for therapy., 2008, 14(13): 1972-1980.
[26] 齐珂珂, 吴杰, 徐子伟. 聚乙二醇修饰猪胰高血糖素样肽-2对试验性结肠炎小鼠肠道紧密连接蛋白和炎性因子基因表达的影响. 动物营养学报, 2014, 26(9): 2745-2751.
QI K K, WU J, XU Z W. Effects of polyethylene glycosylation porcine glucagon-like peptide-2 on gene expression of tight junction proteins and inflammatory cytokines in a murine model of experimental colitis.,2014, 26(9): 2745-2751. (in Chinese)
[27] 余树培. K88ac+大肠杆菌减毒株的构建及其在小鼠体内的初步应用[D]. 扬州: 扬州大学, 2016.
YU S P. Construction of k88ac+ETEC attenuated strain and its preliminary applicationof mouse[D]. Yangzhou: Yangzhou University, 2016. (in Chinese)
[28] 罗献梅, 陈代文, 张克英. 乳铁蛋白及其活性肽的营养生理作用及应用前景. 饲料工业, 2005, 26(2): 5-9.
LUO X M, CHEN D W, ZHANG K Y. Nutritional functions and application prospect of lactoferrin and active polypeptide., 2005, 26(2): 5-9. (in Chinese)
[29] 单体中, 汪以真. 重组猪乳铁蛋白(rPLF)对断奶仔猪血清IL-1、IL-2水平的影响. 中国兽药杂志, 2005, 39(10): 6-8.
SHAN T Z, WANG Y Z. Effects of the recombinant porcine lactoferrin on the interleukin-1 and interleukin-2 in serum of weanling pigs., 2005, 39(10): 6-8. (in Chinese)
[30] Harandi A M, Holmgren J. CpG oligodeoxynucleotides and mobilization of innate mucosal immunity: tasks and tactics., 2006, 24(Suppl. 2): S48-S49.
[31] Choi H, Rangarajan N, Weisshaar J C. Lights, camera, action! Antimicrobial peptide mechanisms imaged in space and time., 2016, 24(2): 111-122.
[32] Nguyen L T, Haney E F, Vogel H J. The expanding scope of antimicrobial peptide structures and their modes of action., 2011, 29(9): 464-472.
[33] Dagan A, Efron L, Gaidukov L, MOR A, GINSBURG H.antiplasmodium effects of dermaseptin S4 derivatives., 2002, 46(4): 1059-1066.
[34] Yoneyama F, Imura Y, Ohno K, ZENDO T, NAKAYAMA J, MATSUZAKI K, SONOMOTO K. Peptide-lipid huge toroidal pore, a new antimicrobial mechanism mediated by a lactococcal bacteriocin, lacticin Q., 2009, 53(8): 3211-3217.
(责任编辑 岳梅)
Recombinant expression and antimicrobial activity of Apidaecin in
CHEN WenFeng, WANG HongFang, LIU ZhenGuo, ZHANG WeiXing, CHI XuePeng, XU BaoHua
(College of Animal Science and Technology, Shandong Agricultural University, Taian 271018, Shandong)
【Objective】In order to study the recombinant expression of antimicrobial peptide apidaecin ofin, verify whether the purified recombinant antimicrobial peptide Apidaecin has antibacterial activityandor not, and to provide a theoretical basis for the development of new antimicrobial peptide preparations with safe antibacterial and immunomodulatory functions.【Method】The experiment usedApidaecin inas templates to clone the antimicrobial peptide Apidaecin in, and his-pHT43/Apidaecin expression vector was successfully constructed. In addition, the competentcells were successfully prepared according to the method provided by MoBiTec. The cells were prepared and used on demand to ensure the activity. Protein was isolated and purified using 6×His-Tagged Protein Purification Kit (soluble protein), and the Easy II Protein Quantitative Kit (BCA) was used for concentration determination. The purified recombinant antimicrobial peptide Apidaecin acted onK88. The disk diffusion test and minimum inhibitory concentration (MIC) were conducted., mice were used as experimental animal models, mice in the experimental group were injected with recombinant antibacterial peptide Apidaecin by intraperitoneal injection, mice in the negative control group were injected with normal saline of the same volume, and the positive control group was injected with the same volume of cefotaxime, then artificially infected withK88. After 24 hours of infection, the mice were dissected, intestinal samples and blood samples were obtained, and the protective effect of Apidaecin on the mice infected withK88 was discussed from the perspective of intestinal barrier and immune function. Serum immunoglobulin (IgA, IgG, IgM) and intestinal sIgA levels were determined by using ELISA kit in the experiment. In addition, the expression levels of intestinal tightly-connected protein genes (claudin-1, ZO-2) and intestinal cytokines (proinflammatory cytokines TNF-, IFN-, IL6 and anti-inflammatory factor IL10) were determined by qRT-pcr. 【Result】Theinwas cloned, containing 183 bp, encoding 60 amino acids, including signal peptide sequence of Apidaecin, a basic RR dipeptide and amino acid sequence of Apidaecin (containing 8 highly conserved amino acid sequences). The protein encoded is named AccApidaecin, its molecular weight is 15.6 kD and isoelectric point is 5.33. About 20 mg antimicrobial peptides could be purified from 1 L supernatant at the concentration of IPTG was 3 mmol·L-1, induction temperature was 30℃, and inducing time was 12 h. The recombinant antibacterial peptide Apidaecin showed obvious antibacterial ringcompared with the negative control, and the measured MIC was 10 mg·L-1. In mice, there were significant differences in immunoglobulin between the bacterial test group injected with recombinant antimicrobial peptide apidaecin by intraperitoneal injection and the bacterial test group injected with saline (<0.05), which indicated that recombinant Apidaecin could effectively alleviate the increase of immunoglobulin content in mice caused byK88. The gene expression level of intestinal related proteins in mice was also significantly different (<0.05), which indicated that the recombinant Apidaecin could effectively protect the intestinal tract of mice infected withK88.【Conclusion】The antimicrobial peptide apidaecin inwas successfully expressed in. The purified antibacterial peptide apidaecin inhas a good antibacterial effect onK88. In addition, it can be injected into mice through abdominal cavity to improve the immune function of mice and effectively resist the infection ofK88 to mice.
; antimicrobial peptide; recombinant expression;; antimicrobial activity
10.3864/j.issn.0578-1752.2019.04.016
2018-09-04;
2018-10-09
国家蜂产业技术体系建设专项(CARS-44)、国家自然科学基金(31572470)、山东省农业良种工程(南种北繁)(2017LZN006)
陈文凤,E-mail:269099781@qq.com。通信作者胥保华,E-mail:bhxu@sdau.edu.cn

