茶园土壤中优势菌株毛霉菌的分离、纯化及鉴定
周小露,刘丽明,宋加艳,宋丽莎,田茂燕,王利荣,周才碧
(1.湖南农业大学园艺园林学院,湖南长沙 410000;2.黔南民族师范学院生物科学与农学院,贵州都匀 558000;3.黔南州广播电视大学物理系,贵州都匀 558000)
贵州是我国唯一兼具低纬度、高海拔、寡日照、多云雾、无污染、全境高原的茶区,截至2017年底,全省茶园面积为47.84万hm2,其中,黔南州的种植面积为10.73万hm2,占贵州省茶园总面积的21%,是重要茶区之一。黔南州《关于进一步加快推进茶产业发展的意见》中提出了有机茶的发展方向,其关键是增加茶树专用有机肥的使用。
目前,使用化肥已造成贵州部分地区茶园土壤酸化以及茶树植株矮小、产量降低等问题[1-2]。农作物秸秆内含有大量的有机物,不仅可以增加土壤的有机含量、补充大量元素,而且是最常见的能作为生物有机肥的原料之一。生物有机肥制作使用的是天然原料,比如秸秆、微生物、腐殖质等,通过有效菌种发酵产生的多种可溶性生理活性物质,如有机酸、维生素等,能被植物迅速吸收,从而达到改善土壤质量的目的。施用有机肥[3-7]可降低土壤的酸化程度,有利于加快土壤中氮、磷等元素循环[8-11],有助于缓解土壤酸化趋势[12-14],减少Cd等[15]重金属的累积;促进茶树提早萌发[16],茶叶长势良好,芽叶密度大,百芽质量明显增加,还可增加茶鲜叶中的茶多酚、咖啡碱、水浸出物、可溶性糖的含量,明显降低茶叶氟含量。
土壤是植物吸收养分的主要来源之一,通过施肥能改良茶树因缺少大量元素带来的叶片发黄等问题。茶树专用有机肥既可作基肥又可作追肥,速效与缓效养分协调、肥料利用率高,可减轻土壤中硝酸盐积累以及磷钾肥造成的重金属污染。因此,茶园专用有机肥的研制具有非常重要的意义。
本试验以黔南州茶园优质土壤为材料,分离、纯化得到优势菌株,利用形态学和分子生物学方法鉴定,旨在明确优势菌株的种属关系,为茶园专用有机肥的开发提供参考。
1 材料和方法
1.1 试验材料
供试材料为土样,采集于贵州省黔南州都匀市三江堰茶园。
1.2 试剂与仪器
蔗糖、七水合硫酸镁、七水合硫酸亚铁、磷酸二氢钾(寿光市艾益农生物科技有限公司),硝酸钠(北京化工厂),氯化钾(天津市福晨化学试剂厂),均为分析纯;琼脂粉(寿光市艾益农生物科技有限公司)。
试验仪器为电子显微镜(XSP-8C,德卡精密量仪有限公司);电子天平(LTI000B,常熟市天量仪器有限责任公司);恒温培养箱(BIC-250,德卡精密量仪有限公司);超净工作台(SW-CJ1FDA,德卡精密量仪有限公司);高压蒸汽灭菌锅(GI54DS,致微仪器有限公司);冰箱(BCD-251WBSV,常熟市天量仪器有限责任公司)等。
1.3 试验方法
1.3.1 培养基配制 参考周才碧等[17]的方法,按试验要求进行适当修改。PDA培养基:葡萄糖20 g,马铃薯200 g,蒸馏水1 000 mL,琼脂粉20 g。WA培养基:琼脂粉13 g,蒸馏水1 000 mL。
1.3.2 菌株分离培养 称取20 g茶园土样放入三角瓶,加入80 mL无菌水,摇匀制备成菌种悬液,并将其稀释成不同浓度菌种溶液,备用。再用接种环蘸取不同稀释浓度的菌种悬浮液1~2滴,采用涂布法接种于PDA培养基上,每个稀释浓度做6个重复;将PDA培养基放入28℃恒温培养箱中,培养6~7 d,有菌落形成时,即对菌株进行纯化处理。
1.3.3 菌株纯化培养 待培养基上的菌落培养6 d、可以明显观察到菌落时,挑选生长旺盛菌落,用平板划线法接种到PDA培养基上;并将培养基放入培养箱继续培养,待菌落长出较多时,继续划线纯化,直到纯化出单一菌落。
1.3.4 菌株形态特征观察 利用电子显微镜对菌种菌落的孢子囊、分生孢子、厚垣孢子及生长速率等形态特征进行观察记录,以对该菌种菌落的类型进行初步判断。
1.3.5 菌株生长速率测定 在无菌环境下,把优势菌株打成直径为5 mm的菌饼,再转移至25℃培养箱中,培养7 d,量取菌落直径并再次记录其特征。
1.3.6 菌株分子生物学鉴定
1.3.6.1 DNA的提取 挑取约1 mg优势种菌丝,研磨,依次加入 500 μL 裂解液,150 μL KAC,50 μL异丙醇,反复离心15 min;收取上清液,加等体积70%的乙醇,离心10 min;等待水分散失,加0.1×TE 30 μL,收集上清液得优势种菌丝DNA。用1.0%琼脂糖凝胶电泳检测DNA的完整性,紫外分光光度法检测DNA的浓度,再稀释至30~50 ng/μL,备用。
1.3.6.2 PCR扩增 用于引物筛选的PCR扩增反应的总体积为 25 μL:1 μL DNA 模板,10×buffer的缓冲液体 2.5 μL,dNTPs2 μL,正反向引物各 1 μL,ExTaq DNA聚合酶 0.1 μL,ddH2O17.4 μL。PCR 扩增反应程序:94℃预变性5 min;94℃变性30 s,50~60℃退火30 s,72℃延伸1 min,循环32次;最后72℃延伸5min;12℃保存备用。以通用引物ITS4(5′-TCCT CCGC TTAT TGAT ATGC-3′,苏州金唯智生物技术有限公司合成)进行PCR扩增,4℃冰箱保存PCR扩增产物。扩增产物经1.2%琼脂糖凝胶电泳分离检测,将PCR扩增产物送到测序公司进行测序。
1.4 数据统计
所得序列提交到National Center for Biotechnology Information(NCBI)核酸数据库,通过 BLAST 程序,将28SrDNA序列与GeneBank中的核酸序列进行对照,并从数据库中获得相关序列。采用MEGA 6.0软件进行多序列比对,并利用Neighbor-Joining方法构建进化树,确定菌株类别。
2 结果与分析
2.1 目标菌株的分离、纯化
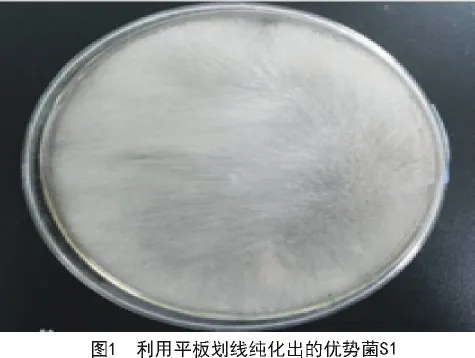
以茶园优质土壤为材料,利用稀释涂布分离得到5种菌;进一步利用平板划线纯化该菌株,最终得到优势菌株S1(图1),该菌株在25℃,PDA培养基中生长旺盛,生长周期较长。
2.2 目标菌株的鉴定
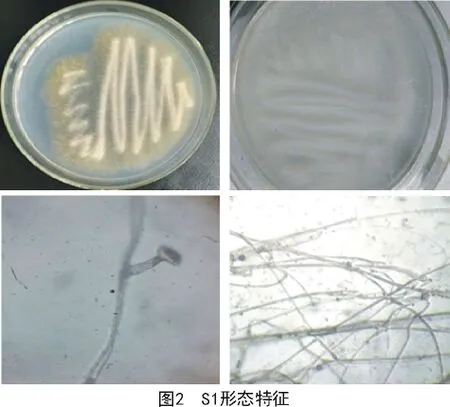
2.2.1 形态鉴定 利用传统形态学鉴定的方法,对2.1分离、纯化得到的菌株S1进行观察。利用电子显微镜观察,优势菌S1特征鲜明,易识别,菌落大、质地疏松、不透明、白色绒毛、菌丝无隔、多核、分枝状,孢子呈椭圆形,在培养基内广泛蔓延。根据菌株S1的菌落和孢子形态等特征,初步推断该菌属为毛霉菌(图 2)。
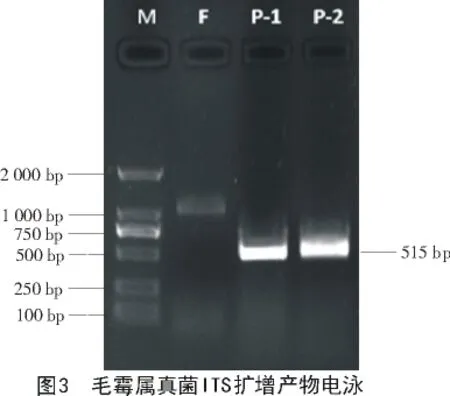
2.2.2 分子鉴定 提取菌株S1的DNA,进行凝胶电泳及PCR扩增,得到1条515bp的清晰条带(图3);将此PCR产物测序后提交到 GenBank中,经BLAST比对后发现,优势菌S1的rDNA-ITS序列与Rhizomucor(KX343955.1)的序列相似度高达 99%。依据比对结果构建系统进化树(图4),结果表明,该菌应归为Rhizomucor,结合形态学与分子生物学鉴定,确定从茶园土壤中分离纯化出的菌为毛霉菌。

毛霉菌(Mucor)的具体分类地位如下:
——真菌界Mycota
——接合菌亚门Zygomycoina
——接合菌纲Zygomycetes
——毛霉目Mucorales
——毛霉属Rhizomucor
——毛霉菌Mucor
3 结论与讨论
以黔南州茶园优质土壤为材料,进行稀释,并将样品悬液涂布于培养皿培养得到多种菌种,又对菌种进行分离,再挑取菌种纯化得到优势菌株。
为了明确优势菌株的种属关系[18],本研究对于优势菌株的鉴定首先采用传统的生物形态学鉴定法,利用电子显微镜进行观察,初步确定该优势菌株为毛霉属;其次,对于优势菌株采用ITS序列(分子)鉴定法,确定其为毛霉菌。
毛霉菌可有效地转化腺嘌呤[19]、产生脂肪酶[20]和不对称还原4-甲基苯乙酮[21],在工农业上有着极高的利用价值,且分解能力较强,是有机肥目标菌株之一。

