黄精种子萌发及组培技术研究
张 瑜,包康佳,倪 穗*,朱宏芬
(1.宁波大学 海洋学院,浙江 宁波315211; 2. 宁波市农业科学研究院,浙江 宁波315211)
多花黄精(PolygonatumcyrtonemaHua)是百合科(Liliaceae)黄精属(Polygonatum)的多年生草本植物。其性味甘甜、食用爽口,在中国的南方不仅是老百姓喜欢的食物而且还把该植物用做药用黄精使用。多花黄精的根状茎肉质肥厚,含有大量的淀粉、糖分、脂肪、蛋白质、维生素、胡萝卜素和多种其他的营养成分,不管是生食还是炖服都够能达到充饥和健身的作用。多花黄精果实中还含有丰富的维生素B1,既可以用来加工制成干果又可以酿造成果酒或加工成不同风味的罐头和饮料,如黄精蜜饯、黄精饮料、黄精保健酒等等[1-6]。
随着多花黄精的药用价值和保健价值被人们认识,对于多花黄精原料的需求量也越来越大,价格也不断上扬,从而导致了山区农民对野生多花黄精的大量掠夺性的采挖,使得多花黄精自然资源迅速枯竭,给多花黄精的开发利用和可持续发展带来不利影响。与此同时,由于多花黄精在生产上大多采用了分根繁殖,繁殖系数低,种根茎用量大,既不经济又限制了多花黄精的规模化种植,而且长期的分根繁殖很容易引起多花黄精品种的退化,尤其是其活性成分的改变。种苗生产的问题已经成为多花黄精人工大面积种植的一大瓶颈。
为了更好的利用及可持续开发多花黄精这一种药用植物资源,本文开展了多花黄精种子萌发及组培技术的探索,以期在短时间内获得大量优质的多花黄精种苗,满足人工大面积种植多花黄精的生产需求[7-18]。
1 试验材料与预处理
1.1 多花黄精种子
2015年10月采收种植在浙江慈溪市新大山黄精基地的多花黄精已成熟的果实。
采收回来的种子不用清洗,直接将果实放置于塑料袋中发酵10 d,10 d后将发酵好的果实放在12目的筛子上进行揉搓,再用清水进行冲洗,揉搓漂洗干净至完全去掉果皮和果肉。处理完后将种子放置在盘子里平铺摊开,置干燥通风处阴干。置于干燥通风处储藏,并且短时间内进行使用[19-20]。
1.2 多花黄精块茎
2015年12月取浙江慈溪市新大山黄精基地的多花黄精当年生块茎,用细软的毛刷除去表面泥土(尤其是节与节之间的连接点),除去泥土后再用自来水冲洗2 h,晾干以后放置在干净的容器里备用[21]。
2 试验方法
2.1 种子萌发
进行实验前先用3%的H2O2对多花黄精种子进行15 min的消毒,再用蒸馏水清洗2~3次后,放置在干净的容器里备用。
在室温下用不同浓度梯度的GA3和6-BA溶液浸种24 h(见表1),共有25组不同浓度激素的配比。每组处理25粒种子,3次重复。先在25 ℃下浸泡24 h。种子在浸泡24 h后,再用蒸馏水冲洗,重复2~3次,将清洗过后的种子放置于铺有3层滤纸的培养皿内,喷淋适量的水,在25 ℃的人工培养箱中培养。
发芽期限设定为60 d,每天观察种子的发芽情况,以突破种皮的下胚轴长度超过种子自身的长度视为发芽,以发芽率、发芽势为测定的指标[22-23]。
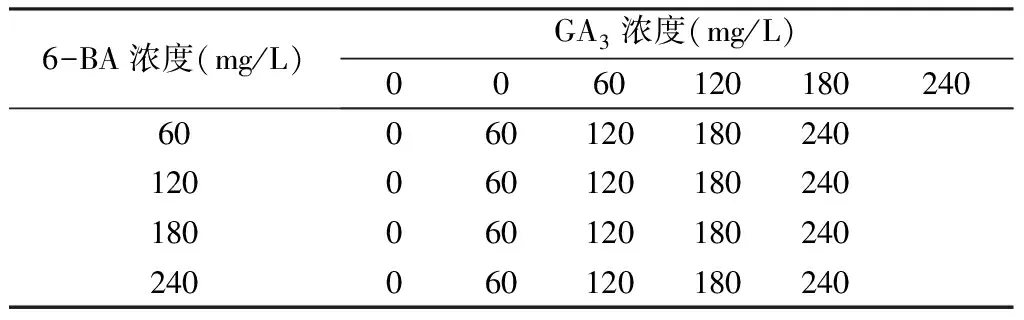
表1 不同浓度和种类的激素配比
2.2 组培技术
2.2.1 培养基的配置及培养条件
基本培养基为MS,先配制母液再对其进行稀释,添加30.0 mg/L的蔗糖和5.0 mg/L的琼脂粉,添加不同种类和浓度的激素,调节pH到5.8,进行分装,在121 ℃下进行高压蒸汽灭菌30 min。冷却到室温后在无菌室的接种台上接种外植体,然后放入温度为(25±2) ℃、照度为2 000~2 500 lx、湿度为65%的培养室进行培养,光照时间为8:00到20:00,12个小时。
生根基本培养基为1/2MS,按微量元素减半的配比配制母液并对其进行稀释,添加20.0 mg/L的蔗糖和5.0 mg/L的琼脂粉,添加不同种类和浓度的激素,调节pH到5.8,进行分装,在121 ℃下进行高压蒸汽灭菌30 min。冷却到室温后在无菌室的接种台上进行接种后,放入温度为(25±2)℃,照度为2 000~2 500 lx,湿度为65%的培养室进行培养,光照时间为8:00到20:00,12个小时[24]。
2.2.2 无菌多花黄精块茎处理
将洗净晾干的多花黄精块茎,用75%的酒精处理5 s后,再用0.1% HgCl2溶液进行浸泡杀菌[24],灭菌时间设置了4个处理,见表2。杀菌后用无菌水浸泡冲洗3次,每次浸泡冲洗30 s,再用无菌滤纸将其表面吸干,切成大小约0.5 cm3的块段,接种在6-BA 2.0 mg/L+NAA 0.2 mg/L的MS培养基上。每个处理接种50瓶,每瓶1块,一共接种200块。统计外植体的污染和死亡的情况,计算30 d后的存活率。

表2 灭菌时间
2.2.3 多花黄精块茎愈伤组织的诱导
将之前处理好的多花黄精无菌材料切成大约0.5 cm3的小块,转接于添加了不同浓度激素配比的诱导培养基上。诱导培养基设置了6个处理,见表3。每个处理3次重复,一共18组,每组接种5个培养基,每个培养基接种5块,一共接种450块。培养45 d后观察不同培养基愈伤组织诱导情况并进行记录。

表3 愈伤组织诱导培养基配置表
2.2.4 多花黄精愈伤组织继代培养
将诱导出的生长健康的多花黄精愈伤组织转接入含有2.0 mg/L的6-BA和0.4 mg/L的2,4-D的MS培养基上进行继代培养,45 d为一个继代周期(一般会一直进行继代培养直至整个试验结束,以备实验过程中需要)。
2.2.5 多花黄精愈伤组织不定芽诱导
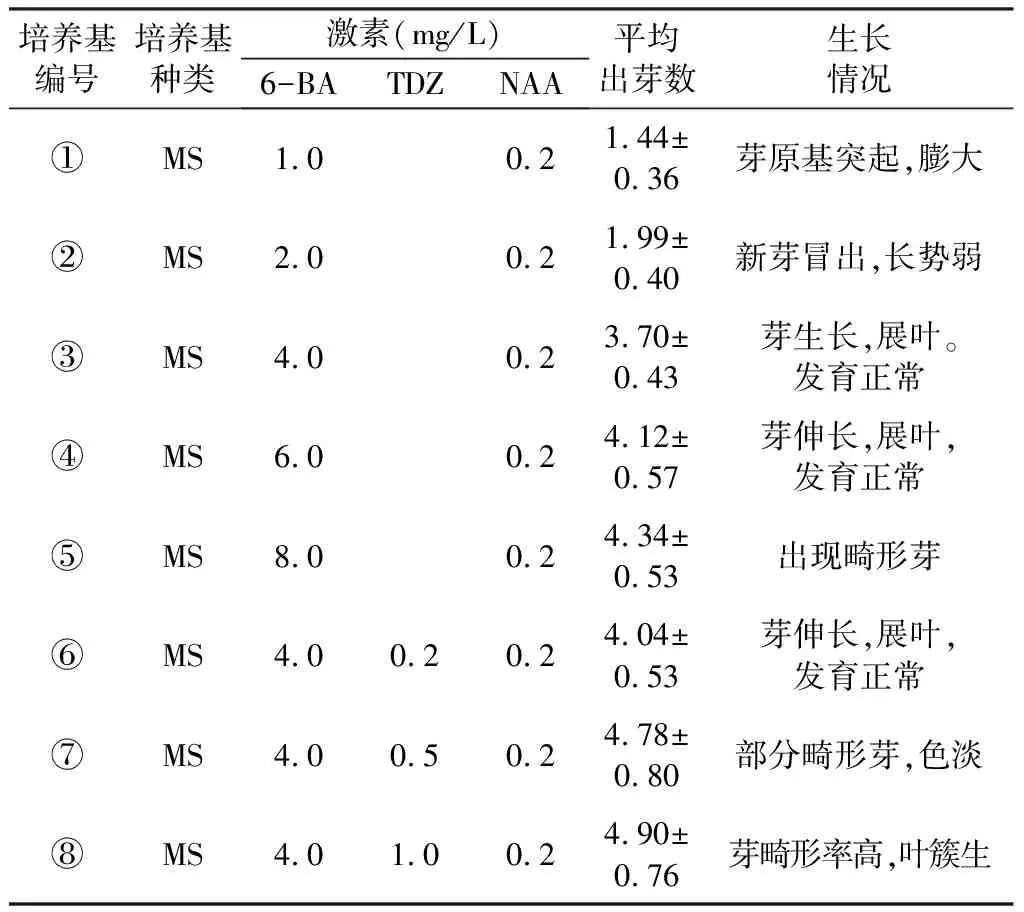
将诱导出的生长良好多花黄精的愈伤组织切成大约0.5 cm3的小块,接种于添加不同浓度激素配比的多花黄精不定芽诱导培养基上。培养基设置了8个处理。见表4,每个处理接种10个培养基,每个培养基接种5块,一共接种400块。培养45 d后观察不同的培养基芽诱导的情况。

表4 不定芽诱导培养基配置表
2.2.6 多花黄精生根培养
将3.0 cm以上高度的健康的植株转入添加了不同浓度激素配比的1/2MS多花黄精生根培养基上进行培养,多花黄精生根培养基设置了4个处理,见表5。每个处理接种15个培养基,每个培养基接种2株,一共接种60株。培养30 d后观察不同培养基的生根情况。

表5 生根培养基配置表
3 结果与分析
3.1 多花黄精种子萌发
3.1.1 激素对多花黄精种子发芽势的影响
由表6可知,6-BA 180.0 mg/L+GA360.0 mg/L这一组处理后的多花黄精种子发芽势为最高。由表7可知,F6-BA 表6 不同浓度的激素下多花黄精发芽势 发芽势(%)=25 d内发芽总数/种子总数×100% 表7 多花黄精发芽势的方差分析 3.1.2 激素对多花黄精种子发芽率的影响 由表8可知,6-BA 180.0 mg/L+ GA360.0 mg/L这一组处理后的多花黄精种子发芽率为最高。由表9可知,F6-BA 表8 不同浓度的激素下多花黄精发芽率 发芽率(%)=60 d内发芽总数/种子总数×100% 表9 多花黄精发芽率的方差分析 从以上发芽势和发芽率研究结果可以看出,多花黄精种子的最佳萌发条件为6-BA 180.0 mg/L+GA360.0 mg/L。 3.2.1 灭菌时间对多花黄精外植体灭菌效果的影响 由表10可知,在4个灭菌时间内,多花黄精外植体的污染数量随着灭菌时间的增加而减少,但褐化死亡的数量随着灭菌时间的增加而增加。在4个处理中,灭菌时间为12 min的多花黄精外植体的存活率最高,达44.0%,但是在进行30 d培养后发现这些多花黄精外植体的损伤比较严重。多花黄精外植体转接成功后仍有部分内生菌的出现,由此可见多花黄精块茎的灭菌难度较大。在正常培养的过程中,多花黄精块茎在诱导培养基上正常健康的生长20 d后会开始膨大而且慢慢出现绿色并逐渐加深,部分的块茎伴有芽萌动。 表10 灭菌时间对外植体灭菌效果的影响结果 存活率(%)=30 d外植体存活总数/接种外植体总数×100% 3.2.2 不同激素组合和浓度对多花黄精块茎愈伤组织诱导的影响 多花黄精块茎在培养25~30 d后开始形成少量的愈伤组织,愈伤组织生长先期比较缓慢。由表11可知,6-BA和2,4-D的激素组合对块茎愈伤的诱导效果好于6-BA和NAA的激素组合。在6-BA 2.0 mg/L+2,4-D 0.2 mg/L的MS培养基上诱导多花黄精块茎愈伤组织,出愈率达到最高,为65.3%,此时,多花黄精愈伤组织的颜色为黄白色或淡黄色,质地紧密。在6-BA 2.0 mg/L+2,4-D 0.4 mg/L的MS培养基上诱导多花黄精块茎愈伤组织,出愈率较低,为58.7%。分别比较表11中培养基①号和②号、培养基③号和④号和培养基⑤号和⑥号的出愈率可以发现,当2,4-D和NAA两种激素浓度相同时,随着6-BA的激素浓度的上升,出愈率逐渐降低,这表明了低浓度的6-BA利于多花黄精块茎愈伤诱导。 表11 不同激素组合和浓度对多花黄精块茎愈伤组织的诱导率 出愈率(%)=45 d出愈块数/接种总数×100% 3.2.3 不同激素组合和浓度对多花黄精愈伤组织不定芽诱导的影响 由表12可知,随着6-BA的激素浓度的增加,平均出芽数也随之增加,不定芽开始伸长。由表12中的培养基①~⑤可知,当6-BA的激素浓度升至8.0 mg/L时,开始出现畸形的芽和叶,颜色开始变淡,长势开始变差。比较培养基⑥~⑧可知,低浓度的TDZ对不定芽的诱导和生长有促进作用,但当TDZ的激素浓度达到0.5 mg/L时,在不定芽诱导增多的同时,叶片发育开始出现不正常,有簇生、发白、叶片生长受抑制和掉叶等的现象,导致正常有效不定芽减少。综合比较发现,多花黄精愈伤组织芽诱导较好的培养基为6-BA 6.0 mg/L+NAA 0.2 mg/L的MS培养基或者是6-BA 4.0 mg/L+TDZ 0.2 mg/L+NAA 0.2 mg/L的MS培养基。 表12 不同激素组合和浓度对多花黄精愈伤组织不定芽诱导率 3.2.4 IBA浓度对多花黄精试管苗生根的影响 由表13可知,随着IBA的激素浓度的增加,健康的不定芽的生根能力也增强,始根天数缩短。发现在IBA 1.0 mg/L的1/2MS培养基中培养30 d后诱导生根的效果最好,生根率达到最高,为86.7%,平均根数达34.17条。但是当IBA的激素浓度为1.5 mg/L时,生根率反而有所下降,这表明了过高浓度的IBA会抑制根的诱导。 表13 不同IBA浓度下多花黄精试管苗生根率和生根时间 生根率(%)=30 d生根块数/接种总数×100% 6-BA为180.0 mg/L和GA3为60.0 mg/L这一组浓度的激素配比处理后的多花黄精种子不论是发芽势还是发芽率都是最高。从方差分析来看,6-BA和GA3对于多花黄精种子的发芽率的影响差异不大而且6-BA和GA3对多花黄精的种子的发芽率都无显著性的影响。张旺凡[25]认为6-BA和GA3对打破多花黄精种子休眠, 促使胚根生长都有相同的作用,且两种激素对于多花黄精种子萌发的影响并无很大差异,这与本次研究结果一致。但同时张旺凡也认为6-BA和GA3对多花黄精的种子的发芽率都有显著性的影响,这与本次研究结果不同。导致这个结果不同原因可能是张旺凡进行的是单因素试验,而本次研究进行的是双因素(单次)试验。当然,如果有机会的话可以考虑进行双因素多次试验,这样就可以在减小偶然性的同时,还可以考虑一下6-BA和GA3这两种激素是否有偶联作用。 由于多花黄精根茎是长在地底下的,而土壤是微生物最好的“天然栖息地”,想要进行多花黄精组织培养的试验灭菌很重要[26]。所以本次试验首先进行了灭菌时间对外植体灭菌效果的影响的试验,得到将外植体灭菌12 min后,进行30 d培养后外植体的存活率最高,这与万学锋[27]等得到的最佳灭菌时间为15 min不同。由于不同地方土壤中微生物的含量是不同的,这有可能是是的研究结果不同的原因。研究外植体的最佳灭菌时间是为了使外植体在后期培养时有高存活率和低污染率。即使得到了最佳灭菌时间,由于黄精外植体灭菌后的外植体本身的损伤可能会比较严重,在外植体转接成功后进行培养时仍会有部分内生菌出现。本次研究结果表明,多花黄精块茎愈伤组织诱导中6-BA和2,4-D的激素组合对块茎愈伤的诱导效果好于6-BA和NAA的激素组合,而且在6-BA 2.0 mg/L+2,4-D 0.2 mg/L的MS培养基上诱导块茎愈伤组织,出愈率达到最高,这与刘红美[17]等对多花黄精组织培养快繁技术的研究结果相同。但是随着6-BA的激素浓度的上升,出愈率降低,这表明了低浓度的6-BA利于多花黄精块茎愈伤诱导,在含有2,4-D的MS培养基上面确没有这种情况出现。徐红梅等[28]在多花黄精愈伤组织再分化中的研究中得出TDZ 1.5 mg/L+2,4-D 1.0 mg/L最有利于不定芽增殖,但也表明在含TDZ的培养基上,芽进一步发育时,则叶片变厚,不规则弯曲,即有变态叶的形成,而以6-BA为细胞分裂素的培养基上,叶片形态是正常的。因此在本次研究中设置了不同浓度的6-BA、TDZ和NAA的激素组合来进行多花黄精愈伤组织不定芽的诱导。最终得到多花黄精愈伤组织不定芽诱导较好的培养基为6-BA 6.0 mg/L+ NAA 0.2 mg/L的MS培养基或者是6-BA 4.0 mg/L+TDZ 0.2 mg/L+NAA 0.2 mg/L的MS培养基。生根研究发现高浓度的IBA会抑制根的诱导,最适生根培养基为IBA 1.0 mg/L的1/2MS培养基,此时生根率到达最高。刘红美[17]等对多花黄精组织培养快繁技术的研究得到最适生根培养基为IBA 0.7 mg/L的1/2MS培养基,这与本次研究结果不同。在刘红美[17]等的研究中可以发现随着IBA浓度增加, 黄精无根苗生根率、根长及生根数也随之增加。那本次研究中增加了IBA的浓度来观察其对多花黄精试管苗生根的影响,以期望得到一个更好的生根浓度。 综上,本文研究了多花黄精的种子萌发及组培技术,研究结果为短时间内获得优质量大的多花黄精种苗、满足人工大面积种植多花黄精的生产提供技术支持。



3.2 多花黄精的组培



4 讨 论
4.1 多花黄精种子萌发
4.2 多花黄精组培

