饲喂沙蚕、乌贼对凡纳滨对虾生长性状及供能基因表达的影响
黄贤克,查珊洁,刘广绪,张敏,肖国强,闫茂仓,胡利华*
饲喂沙蚕、乌贼对凡纳滨对虾生长性状及供能基因表达的影响
黄贤克1,查珊洁2,刘广绪2,张敏1,肖国强1,闫茂仓1,胡利华1*
1. 浙江省海洋水产养殖研究所, 浙江 温州 325005 2. 浙江大学 动物科学学院, 浙江 杭州 310058
运用荧光定量PCR等技术,本研究对比分析了饲喂双齿围沙蚕和杜氏枪乌贼对雌、雄凡纳滨对虾体长、体重、肌肉重、含肉率等10个生长性状的影响,并探讨了不同生物饵料饲喂对雌、雄凡纳滨对虾关键代谢供能基因己糖激酶(HK)、丙酮酸激酶(PK)、异柠檬酸脱氢酶(IDH)和肉毒碱棕榈酰基转移酶(CPT1)表达的影响。研究结果表明,饲喂双齿围沙蚕具有显著的促进凡纳滨对虾生长的作用,雄性的体长、体重、头甲长、头甲宽、肌肉重、躯体周长显著高于对照组,雌性的体长、头甲长、头甲宽和躯体周长也显著增加;饲喂乌贼组的雄性凡纳滨对虾,虽然生长性能与对照组并无显著差别,但体型更为细长(BL/BW显著大于对照组,<0.05),而头部较为粗壮(HL/HW显著小于对照组,<0.05)。研究结果还发现饲喂双齿围沙蚕和杜氏枪乌贼对雌、雄凡纳滨对虾代谢供能关键基因的表达具有显著影响。
生物饵料; 凡纳滨对虾; 生长; 基因表达
凡纳滨对虾()俗称南美白对虾,因其具有头胸甲小、含肉率高、抗逆性强、生长快、繁殖期长、耐高密度和低盐度养殖、便于活体运输等优点,是目前世界对虾养殖的三大品种之一[1-3]。自上世纪80年代末成功引入我国后,凡纳滨对虾养殖产业得到迅猛发展,逐步成为全国水产养殖的支柱产业之一[3-5]。以浙江省为例,2014年,全省凡纳滨对虾养殖面积约40余万亩,产量约11.2万t(其中,淡水8.07万t,海水3.10万t),产值达45亿元,已成为浙江省第二大水产养殖品种。因此开展相关营养代谢等基础研究,对解决凡纳滨对虾养殖产业中存在的现实问题具有重要的指导意义[6]。
凡纳滨对虾的生物饵料沙蚕、乌贼具有EPA、DHA、蛋白质含量高,易于消化吸收等特点[7-9],在养殖中被广泛用于提高幼虾成活率、加速虾体生长和促进亲虾性腺发育[9,10]。目前对虾生物饵料沙蚕、乌贼的营养成分组成已经研究的较为透彻[9,11],少量相关研究也分析了生物饵料饲喂对凡纳滨对虾生长性能的影响[12],然而详细系统的对比分析仍然缺乏。而且,到目前为止仍未见从基因表达角度分析生物饵料饲喂对凡纳滨对虾代谢供能分子通路影响的研究报道。
生物体主要通过三羧酸循环、糖酵解和氧化磷酸化分子途径进行三大营养物质(糖、脂、蛋白质)的代谢,从而为生物体的正常生命活动提供能量[13]。其中糖酵解途径是机体糖类物质代谢的主要方式,己糖激酶(hexokinase,HK)和丙酮酸激酶(Pyruvate kinase,PK)是该过程中重要的变构调节酶[14,15]。HK催化由葡萄糖转变为葡萄糖-6-磷酸的放热反应,对整个糖酵解过程具有重要的调节作用[13];而PK则是糖酵解途径中重要的限速酶之一,其活力在一定程度上可以反映糖酵解水平的高低[13,15]。三羧酸循环中,异柠檬酸脱氢酶(Isocitrate dehydrogenase, IDH)催化三羧酸循环第一次氧化脱羧生成CO2的不可逆反应,因此是三羧酸循环中的主要限速酶[13,16]。此外,在脂肪酸氧化供能过程中,肉毒碱棕榈酰基转移酶(Carnitine palmitoyltransferase 1, CPT1)催化长链脂肪酸从酰基辅酶A转移到肉毒碱上这一生命过程,是该过程的重要限速酶[13,17]。
为探明不同生物饵料(沙蚕、乌贼)对凡纳滨对虾生长性能和机体代谢供能的影响,本研究运用荧光定量PCR等技术手段,对比分析了饲喂沙蚕、乌贼对雌雄凡纳滨对虾体长、体重、肌肉重、含肉率等10个生长性状指标的影响,并探讨了不同生物饵料饲喂下PK、HK、IDH、CPT1基因表达的情况。本研究结果将有助于丰富凡纳滨对虾分子代谢与营养相关知识体系,为凡纳滨对虾养殖产业合理选择生物饵料提供基础研究数据支持。
1 材料与方法
1.1 凡纳滨对虾的获得与暂养
体格均一的浙桂1号凡纳滨对虾(体长9.67±0.30 cm,体重10.05±0.5 g)于2016年7月初取自浙江省海洋水产养殖研究所清江试验场。试验前,对虾置于6 t水体室内养殖池内暂养7 d,期间水温、pH、盐度分别控制在28.8±0.6 ºC、8.3±0.2和29.8±0.4。每天分别于8:00、12:00、16:00和22:00投喂商业化对虾饲料4次,并于18:00换水(1/3水体)1次。
1.2 生物饵料饲喂试验
试验选取营养成分组成背景较为明晰的双齿围沙蚕()[8]和杜氏枪乌贼()[9]作为生物饵料,以商业化对虾饲料为对照。根据预实验结果,在综合考虑实际摄食效果情况下,分别设置对照组(仅投喂商业化对虾饲料)、乌贼添加试验组(1/2对虾饲料+1/2冰鲜杜氏枪乌贼,重量比)和沙蚕投喂试验组(仅投喂活体双齿围沙蚕)。试验在1吨水体养殖桶内进行,每组设置三个平行重复,各放置经过暂养的凡纳滨对虾50尾。分别于8:00、12:00、16:00和22:00投喂对应生物饵料或饲料,每次投喂量为虾体初始体重的1/15。试验周期15天,试验过程中保持水体环境温度(28.8±0.6 ºC)、pH(8.3±0.2)、盐度(29.8±0.4)相对稳定,并于每天18:00换水(1/3水体)1次。
1.3 生长性状测定
饲喂试验结束后,每平行组随机选取雌雄凡纳滨对虾各10尾,参照董世瑞[18]、吴立峰[19]、柴展[20]等的研究方法,利用游标卡尺、电子天平分别对体长(Body length)、体重(Body weight)、头甲长(Head length)、头甲宽(Head width)、肌肉重(Muscle weight)、躯体周长、体长/体重(BL/BW)、头甲长/头甲重(HL/HW)、头甲长/体长(HL/BL)和含肉率这10个性状指标进行测定。
1.4 PK、HK、IDH、CPT1基因表达荧光定量PCR分析
参照彭金霞[21]和Zhao[22]的试验方法,于每试验组随机选取雌雄凡纳滨对虾各5尾,冰上解剖取脑、肝胰腺、肌肉组织,液氮冻存用于后继RNA提取。按照试剂盒使用说明,使用RNAprep Pure组织样提取试剂盒(Tiangen, DP431)提取组织混合样总RNA,经NanoDrop(Thermo Scientific)和凝胶电泳检测后,利用M-MLV反转录试剂盒(Invitrogen, C28025-032)制备cDNA模版。
根据转录组测序获得的序列信息,通过Primer Primer 6.0分别设计PK、HK、IDH与CPT1基因的引物序列。参照Shi[23]和Liu[24]的方法,使用CFX96TM荧光定量PCR仪(Bio-Rad)对组织样中PK、HK、IDH、CPT1基因的表达情况进行测定。PCR反应体系(10 μL)包括5 μL SsoFastTMEvaGreen Supermix (Bio-Rad, 172-5201AP),2微升cDNA模版,0.3 μL上下游引物和2.4 μL ddH2O。扩增程序包括:95oC 5 min,94oC 20 s,61oC 20 s,72oC 20 s,40个循环。以-actin为内参,采用2-ΔΔCt法测定基因的相对表达量。内参与PK、HK、IDH、CPT1基因引物序列如表1所示。
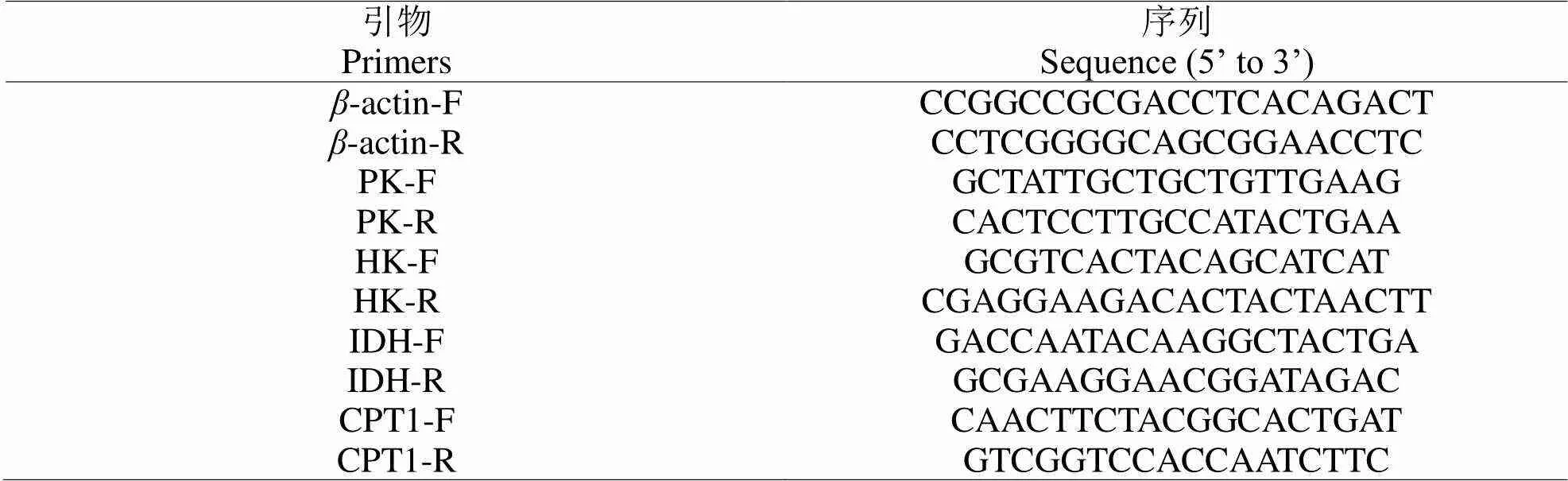
表1 内参(β-actin)与PK、HK、IDH、CPT1基因引物序列
1.5 统计分析
使用Shapiro-Wilk’s test和Levene’s test对生长性状数据进行正态性和方差齐性分析后,利用统计分析软件“R”进行单因素方差分析(One-way ANOVA)和Tukey HSD检验。参照刘广绪等[25]的方法,进行方差分析前,比例数据包括体长/体重(BL/BW)、头甲长/头甲重 (HL/HW)和头甲长/体长(HL/BL)均预先进行了反正弦转化但在结果中以未转化形式表述[26]。所有数据均以平均值±标准方差的方式表述,采用<0.05作为统计检验的显著性标准。
参照Tallarida与Murray的方法[27],通过Duncan检验分析不同生物饵料饲喂对相应基因表达的影响。参照Young等[28]的方法,通过除以对照组相应数据用于最终结果数据的表述。
2 结果与分析
2.1 饲喂不同生物饵料对凡纳滨对虾生长性状的影响
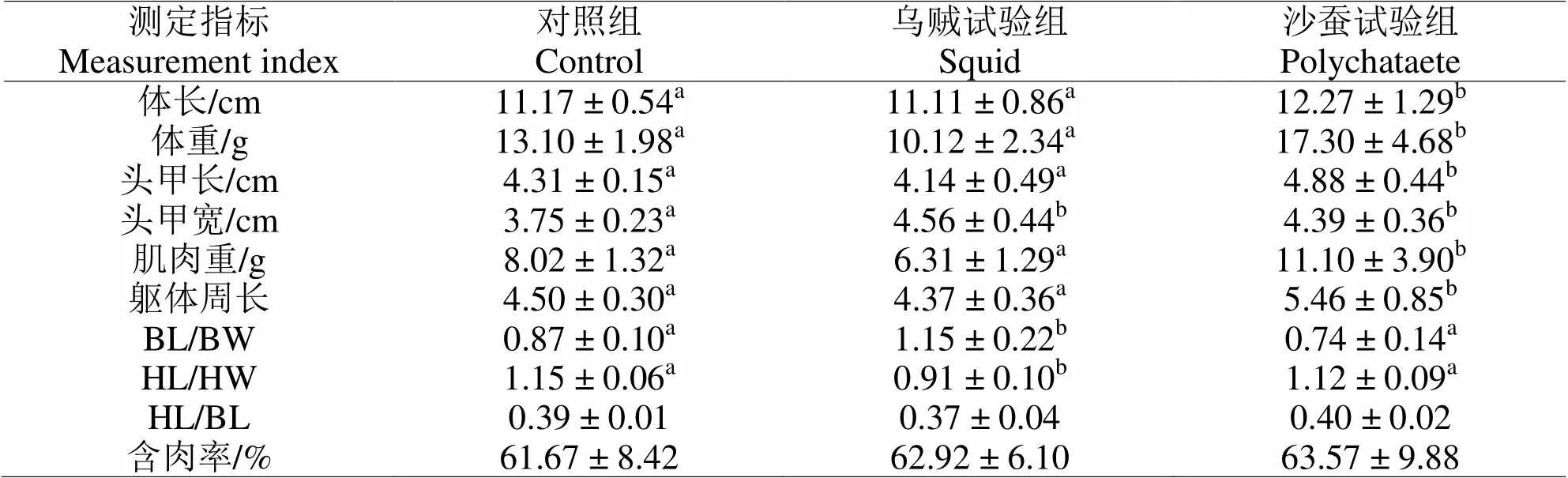
表2 饲喂双齿围沙蚕和杜氏枪乌贼对雄性凡纳滨对虾生长性状的影响
注:不同上标表示两组之间具有显著性差异(Tukey HSD检验,<0.05)。
Note: Different superscripts indicate significant difference between groups (Tukey test,<0.05).
如表2所示,与对照相比饲喂生物饵料对雄性凡纳滨对虾的生长性状指标具有显著影响。其中饲喂生物饵料沙蚕能显著提高雄性凡纳滨对虾的体长、体重、头甲长、头甲宽、肌肉重和躯体周长。与对照组相比,饲喂乌贼组的雄性凡纳滨对虾,虽然生长性能与对照组并无显著差别,但体型更为细长(BL/BW显著大于对照组,<0.05),而头部较为粗壮(HL/HW显著小于对照组,<0.05)。各试验组与对照组在头体长度比和含肉率上并无显著差别。

表3 饲喂双齿围沙蚕和杜氏枪乌贼对雌性凡纳滨对虾生长性状的影响
注:不同上标表示两组之间具有显著性差异(Tukey HSD检验,<0.05)。
Note: Different superscripts indicate significant difference between groups (Tukey test,<0.05).
如表3所示,与雄性试验获得的结果类似,饲喂生物饵料也能显著影响雌性凡纳滨对虾的生长性状与体型指标。其中饲喂生物饵料沙蚕能显著提高雌性凡纳滨对虾的体长、头甲长、头甲宽和躯体周长。在各试验组中,饲喂沙蚕的雌性凡纳滨对虾具有最大的平均体重和肌肉重,但由于组内变异较大,与对照组相比并不显著。此外,饲喂乌贼的雌性凡纳滨对虾,虽然生长性能与对照组并无显著差别,但体型更为细长(BL/BW显著大于对照组,<0.05),而头部较为粗壮(HL/HW显著小于对照组,<0.05)。各试验组与对照组在头体长度比和含肉率上并无显著差别。
2.2 饲喂不同生物饵料对PK、HK、IDH、CPT1基因表达的影响

图 1 饲喂双齿围沙蚕和杜氏枪乌贼对雄性凡纳滨对虾PK(Fig 1a)、HK(Fig 1b)、IDH(Fig 1c)、CPT1(Fig 1d)基因表达的影响
**表示与对照相比具有显著差异,下同。** indicates significant difference compared with control, the same as follows.
由图1可见,与对照相比饲喂生物饵料对雄性凡纳滨对虾代谢供能关键基因丙酮酸激酶(PK)、己糖激酶(HK)、异柠檬酸脱氢酶(IDH)和肉毒碱棕榈酰基转移酶(CPT1)的表达具有显著影响。其中,饲喂生物饵料沙蚕使上述四个代谢供能相关基因的表达显著下调。与之类似,虽然己糖激酶(HK)和异柠檬酸脱氢酶(IDH)的表达并未受到显著影响,但饲喂乌贼使得丙酮酸激酶(PK)和肉毒碱棕榈酰基转移酶(CPT1)的表达显著降低。上述基因的低水平表达说明此时雄性凡纳滨对虾个体糖、脂肪分解代谢活动较弱,因此与对照相比更利于能量物质的累计,从而促进个体生长发育。
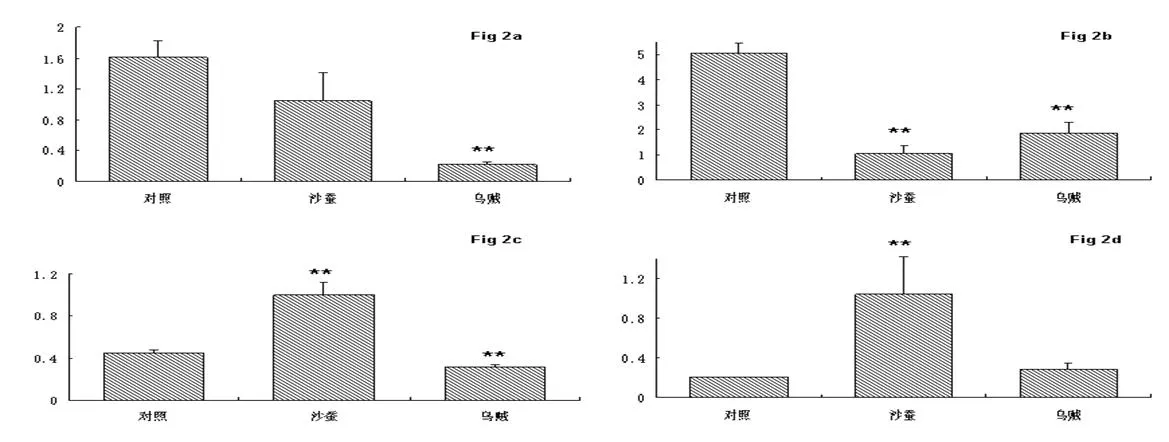
图 2 饲喂双齿围沙蚕和杜氏枪乌贼对雌性凡纳滨对虾PK(Fig 2a)、HK(Fig 2b)、IDH(Fig 2c)、CPT1(Fig 2d)基因表达的影响
如图2所示,饲喂生物饵料对雌性凡纳滨对虾代谢供能关键基因的表达也具有显著性影响,但与雄性对虾试验结果不同。其中,饲喂生物饵料乌贼使雌性凡纳滨对虾PK、HK、IDH基因的表达显著下调;饲喂沙蚕使HK基因表达显著下调,而使IDH和CPT1基因的表达显著上调。该结果表明饲喂生物饵料沙蚕、乌贼对凡纳滨对虾代谢供能关键基因表达的影响具有明显的性别差异。
3 讨论
之前的研究表明凡纳滨对虾的生长受到诸多因素,如温度[29]、盐度[30]、密度[31]等的综合影响,其中营养是影响凡纳滨对虾生长的关键因素之一[32,33]。双齿围沙蚕()和杜氏枪乌贼()是凡纳滨对虾的生物饵料之一,在养殖中被广泛用于加速虾体生长和促进亲虾性腺发育[9,10],然而到目前为止尚未见不同生物饵料饲喂凡纳滨对虾的效果对比研究。
相较而言,双齿围沙蚕粗脂肪、EPA、DHA含量显著高于杜氏枪乌贼,而杜氏枪乌贼则具有较高的粗蛋白与胆固醇含量[9,11]。本研究获得的结果表明,饲喂生物饵料沙蚕能显著促进雌、雄凡纳滨对虾的生长。该结果与之前的研究结果基本一致,刘石林等2006年的研究发现饲喂生物饵料沙蚕能显著提高凡纳滨对虾的特定生长率,使得沙蚕饲喂组的终体重显著高于配合饲料对照组[12]。饲喂沙蚕的生长促进作用可能源于多方面原因:一方面,与配合饲料和冰鲜乌贼相比,活体沙蚕在水体内的活动更易于诱使对虾摄食;另一方面,沙蚕所含总必需氨基酸、鲜味氨基酸和促诱食氨基酸含量均显著高于配合饲料,适口性高[11,12];而且作为活体饵料,与配合饲料相比沙蚕营养成分组成更为合理,不存在已知的营养抑制因子,也更易于被消化消化吸收[9,12]。本研究还发现饲喂冰鲜杜氏枪乌贼的凡纳滨对虾头部更为粗壮,由于之前的研究表明胆固醇对动物中枢神经系统的发育至关重要[34],因此可能是由于杜氏枪乌贼含有较高的胆固醇,对凡纳滨对虾头胸甲内神经与消化器官的发育有促进作用所致。
本研究发现饲喂生物饵料对雌、雌凡纳滨对虾代谢供能关键基因表达的影响具有显著的差别。对于雄性凡纳滨对虾,饲喂生物饵料使所分析的全部或部分代谢供能基因的表达显著下调,因此机体的糖、脂肪分解代谢活动处于较低水平,利于能量物质的累计,这可能也是其具有生长促进作用的内在原因之一。而对于雌性凡纳滨对虾,饲喂生物饵料对所分析的代谢供能基因表达的影响则较为复杂。其中饲喂双齿围沙蚕使雌性凡纳滨对虾HK基因的表达显著下调,使IDH和CPT1基因的表达显著上调。由于雌、雄凡纳滨对虾在摄食、游动等行为上可能存在差异[35],因此IDH和CPT1基因表达的上调可能是为雌性凡纳滨对虾活跃的游泳与抢食提供必要的能量供给所致。同理,由于饲喂的杜氏枪乌贼为冰鲜个体,诱食效果显著弱于活体沙蚕,因此饲喂冰鲜乌贼并未使IDH等代谢供能基因的表达出现显著的上调。雌、雄凡纳滨对虾在代谢供能基因表达上的显著差异,很可能是由于其在发育、营养需求等方面的不同所致[36-38]。
4 结论
本研究结果表明,饲喂生物饵料对雌、雄凡纳滨对虾的生长具有显著的影响,其中饲喂双齿围沙蚕对凡纳滨对虾具有显著的生长促进作用。同时饲喂生物饵料双齿围沙蚕、杜氏枪乌贼能对雌、雌凡纳滨对虾代谢供能关键基因的表达产生影响,并且具有性别差异。这一结果表明雌、雄性凡纳滨对虾在营养需求、代谢生长上可能存在显著的性别差异。
[1] 王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2004,37(4):94-100
[2] 熊建华,赵永贞,高永华,等.凡纳滨对虾良种培育研究进展[J].南方农业学报,2011,42(5):556-561
[3] 李世凯,江敏,戴习林,等.凡纳滨对虾池塘水质及对虾肌肉品质的对比分析[J].上海海洋大学学报,2012,12(6):955-964
[4] 张灵侠,沈琪,胡超群.凡纳滨对虾的遗传育种研究现状[J].海洋科学,2008,32(2):91-95
[5] 索建杰,王玉玮,姜玉声,等.三种凡纳滨对虾养殖模式的水质特征及养殖效果[J].水产学杂志,2015,2(5):12-17
[6] 林继辉,李松青,林小涛,等.凡纳滨对虾摄食与生长的实验研究[J].海洋科学,2004,28(8):43-46
[7] 顾晓英,蒋霜敏,郑忠明.双齿围沙蚕的生物学特征和开发利用现状[J].现代渔业信息,2002,17(8):33-34
[8] 滕瑜,王印庚,王彩理.沙蚕的营养分析与功能研究[J].海洋科学进展,2004,22(2):215-218
[9] 杜少波,胡超群,沈琪,等.凡纳滨对虾亲虾常用天然饵料营养成分的比较研究[J].热带海洋学报,2005,24(1):50-59
[10] 姚卫军,黄翔鹄,李活.不同天然饵料对凡纳滨对虾亲虾性腺发育的影响[J].广东海洋大学学报,2009,29(4):84-88
[11] 杨世平,刘慧玲,邱德全.天然和养殖沙蚕营养成分分析[J].饲料工业,2013,34(10):53-55
[12] 刘石林,刘鹰,杨红生,等.双齿围沙蚕与赤子爱胜蚓对凡纳滨对虾生长和免疫指标的影响[J].中国水产科学,2006,13(4):561-565
[13] 王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002:63-90
[14] 郭彪,王芳,侯纯强,等.温度突变对凡纳滨对虾己糖激酶和丙酮酸激酶活力以及热休克蛋白表达的影响[J].中国 水产科学,2008,15(5):885-889
[15] Sánchez-Paz A, So~nanea-Organis JG, Peregrino-Uriarte AB,. Response of the phosphofructokinase and pyruvate kinase genes expressed in the midgut gland of the Pacific white shrimpduring short-term starvation[J]. Journal of Experimental Marine Biology and Ecology, 2008,362(2):79-89
[16] 张贝贝,陶张欢,汪新颖,等.单体异柠檬酸脱氢酶的研究进展[J].安徽农学通报,2009,15(12):43-47
[17] 魏婷,张永煜,张庆华.肉毒碱棕榈酰基转移酶1A的研究进展[J].生命科学,2013,25(6):614-620
[18] 董世瑞,孔杰,万初坤,等.中国对虾形态性状对体重影响的通径分析[J].海洋水产研究,2007,28(3):15-22
[19] 吴立峰,张吕平,沈琪,等.凡纳滨对虾不同家系的形态性状对体重的影响[J].海洋湖沼通报,2010,37(2):37-48
[20] 柴展,栾生,罗坤,等.基于家系水平的凡纳滨对虾()保种群体出肉率与表型性状的相关性 分析[J].渔业科学进展,2015,36(6):63-70
[21] 彭金霞,殷勤,崔亮,等.凡纳滨对虾TCP-1-Beta基因的克隆及其与耐寒性状的相关性[J].水生生物学报,2011,36(4):604-609
[22] Zhao XG, Guo C, Han Y,. Ocean acidification decreases mussel byssal attachment strength and induces molecular byssal responses[J].Marine Ecology Progress Series, 2017,565:67-77
[23] Shi W, Zhao XG, Han Y,. Ocean acidification increases cadmium accumulation in marine bivalves: a potential threat to seafood safety[J]. Scientific Reports, 2016,6:20197
[24] Liu SX, Shi W, Guo C,. Ocean acidification weakens the immune response of blood clam through hampering the NF-kappa β and toll-like receptor pathways[J]. Fish and Shellfish Immunology, 2016,54(4):322-327
[25] 刘广绪,吴洪喜,柴雪良,等.重金属对滩涂贝类缢蛏精子的毒性作用[J].水生生物学报,2011,35(6):1-6
[26] Zar JH. Biostatistical analysis[M]. 5 edition. England: Pearson, 2010
[27] Tallarida RJ, Murray RB. Duncan multiple range test in Manual of pharmacologic calculations[J]. New York: Springer, 1987:125-127
[28] Young LG, Nelson L. Calcium ions and control of the motility of sea urchin spermatozoa[J]. Journal of Reproduction and Fertility, 1974,41(2):371-378
[29] 杨章武,卢小宁,郑雅友,等.温度对凡纳滨对虾幼体生长、变态和存活率的影响[J].台湾海峡,2011,30(1):81-84
[30] 吴立峰,张吕平,胡超群,等.2个凡纳滨对虾全同胞家系在不同盐度下的生长比较[J].热带海洋学报,2011,30(1):152-158
[31] 王兴强,曹梅,马甡,等.密度对凡纳滨对虾存活、生长和能量收支的影响[J].渔业科学进展,2006,27(1):8-13
[32] 郭冉,梁桂英,刘永坚,等.糖和蛋白质水平对饲养于咸淡水中的凡纳滨对虾生长、体营养成分组成和消化率的影响 [J].水产学报,2007,31(3):355-360
[33] 申玉春,陈作洲,刘丽,等.盐度与营养对凡纳滨对虾蜕壳和生长的影响[J].水产学报,2012,36(2):290-299
[34] Dietschy JM, Turley SD. Cholesterol metabolism in the central nervous system during early development and in the mature animal[J].Journal of lipid research, 2004,45(8):1375-1397
[35] Chow S, Sandifer PA. Differences in growth, morphometric traits, and male sexual maturity among Pacific white shrimp,, from different commercial hatcheries[J]. Aquactulture, 1991,92(2-3):165-178
[36] Moss DR, Moss SM. Effects of gender and size on feed acquisition in the Pacific white shrimp,[J]. Journal of World Aquaculture Society, 2006,37(2):161-167
[37] Garza-Torres R, Campos-Ramos R, Maeda-Martínez AM. Organogenesis and subsequent development of the genital organs in female and male Pacific white shrimp,()[J]. Aquaculture, 2009,296(1):136-142
[38] 朱春华,冉维亮,邓思平,等.环境因子对凡纳滨对虾性别分化的影响[J].水生生物学报,2011,35(3):414-422
Impacts Feedingandon the Growth Performance and Energy Supply Genes Expression of
HUANG Xian-ke1, ZHA Shan-jie2, LIU Guang-xu2, ZHANG Min1, XIAO Guo-qiang1, YAN Mao-cang1, HU Li-hua1*
1.325005,2.310058,
In the present study,feeding experiment andqPCR were conducted to investigate the impacts of two natural feed (and) on the growth performance and expression of metabolic genes of Pacific white shrimp (). According to the ten growth performance traits measured,was shown to be a growth-inducing feed. When fed with, the body length, body weight, head length, head width, muscle weight, body circumference of male individuals and the body length, head length, head width, body circumference of female ones were all significantly greater than those of the control. Although the growth performance of Pacific white shrimp fed onwas not significant different from that of the control, more slender body shape (BL/BW significantly greater than the control group,<0.05) and more stubbed head (HL/HW significantly lower than control group,<0.05) were detected in the Pacific white shrimp fed on. Moreover, different feeds exerted significant impacts on the expression of PK, HK, IDH, and CPT1 genes of both male and female individuals. Significant differences in term of gene expression alteration were also detected between male and female individuals when fed with the natural feeds investigated.
Natural feed; white shrimp; growth performance; gene expression
S963.2
A
1000-2324(2019)01-0112-06
10.3969/j.issn.1000-2324.2019.01.025
2017-08-31
2017-10-17
浙江省农业(水产)新品种选育重大科技专项(2016C2055-5);浙江省科技计划项目(2017F30043);温州市科技计划项目(N20140015);温州市科技计划项目(N20150040)
黄贤克(1981-),男,研究生,工程师,主要从事海水增养殖方面的工作. E-mail:hxkdu@163.com
Author for correspondence.. E-mail:hulihua1208@163.com

