铜绿假单胞菌吸附剂对水中菲-铜复合污染的吸附研究
张艳平,张 栋,刘兴元,赵红挺*
(1.杭州电子科技大学材料与环境工程学院,杭州310018;2.广东大众农业科技股份有限公司,广东 东莞523169)
疏水性有机物(Hydrophobic organic compounds,HOCs)和重金属是环境中普遍共存的典型有毒有害污染物,其共存会产生复合效应[1-2]。复合污染效应常常难以用单一污染的作用和机理来解释,过去依赖单一效应制定的有关评价标准也无法真实评价环境质量,因此,复合污染的研究已成为环境科学发展的重要趋势[3]。目前,单一重金属的微生物吸附或低分子量HOCs的微生物吸附降解已有较广泛的研究[4-19],Chen 等[4]研究了活的和灭活的白腐真菌对不同疏水性PAHs 的吸附降解;Zhang 等[5-6]研究了克雷伯氏菌株在五种表面活性剂存在下对芘的增效吸附降解行为、微生物吸附降解界面行为,并综述[7]了有机污染土壤的缓解及修复技术等;Reddy 等[8]研究了化学修饰生物材料对水溶液中Pb2+的生物吸附;Ge 等[11]研究了营养单胞菌同步Cr6+还原和Zn2+生物吸附及其相关基因构成和表达。而有关HOCs 和重金属复合污染的微生物修复及机理的研究不多见[20-21],邓军等[20]研究了氧化节杆菌(Arthrobacter oxydans)对水体中苯并[a]芘-镉复合污染物交互作用机理;Chen 等[22]利用微生物-植物组合在温室下对PAH-金属共污染土壤进行有效修复的研究。目前,对重金属-HOCs 复合污染的研究主要集中于复合污染效应,其机理和环境过程的探讨还很不够,制约了复合污染的修复和机制研究。
为此,本文以菲、铜分别为HOCs 和重金属的代表,以具有PAHs 高效降解能力和对重金属有强耐受性的铜绿假单胞菌(Pseudomonas aeruginosa)为实验菌株,研究了P.aeruginosa 吸附剂对菲和铜复合污染的吸附作用,并初步探讨了复合体系下相互影响的机制。利用扫描电镜(SEM)观察菲、铜单一及复合污染条件下吸附剂表面形态,并通过红外光谱(FTIR)分析细菌吸附剂表面与吸附相关的主要基团,以期为微生物修复有机物和重金属复合污染的机制研究提供科学依据。
1 材料与方法
1.1 药品及试剂
菲(纯度97%,购自阿拉丁试剂有限公司,中国上海);CuCl2、NaH2PO4、KH2PO4、K2HPO4、NH4Cl、MgSO4·7H2O、FeSO4·7H2O、MnSO4·H2O、ZnSO4·7H2O、CoCl2·6H2O、CaCl2·2H2O 均购自广州化学试剂厂,为AR 级;三乙醇胺、4-(2-吡啶偶氮)-间苯二酚、四硼酸钠、乙醇、甲醇均购自上海阿拉丁试剂厂,AR 级,甲醇为HPLC级。
1.2 P.aeruginosa吸附剂制备
无机盐培养基于121 ℃条件下灭菌20 min,接种PAHs高效降解能力和重金属强耐受能力的铜绿假单胞菌(P.aeruginosa)于培养基中,于(30±1)℃、150 r·min-1恒温培养箱振荡培养,取菌液按1%体积比接种于新鲜培养基中。收获对数生长末期的铜绿假单胞菌,于4000 r·min-1条件下离心5 min,生理盐水清洗后收集菌体,于烘箱70 ℃下干燥,用玛瑙研钵研磨成均匀粉末状,得到失活菌体吸附剂,放置于真空干燥器中保存。
1.3 实验设计
1.3.1 共存污染物对吸附剂吸附菲、铜的影响
在22 mL 样品瓶中投加适量吸附剂(浓度为0.5 g·L-1),加入20 mL 菲-铜复合污染溶液(pH=5.0),溶液每组设置不同铜浓度(0~5 mg·L-1)和不同菲浓度(0~1 mg·L-1),在25 ℃下,150 r·min-1振荡4 h 后,于离心机中4000 r·min-1离心5 min,取上清液测定菲和铜浓度。
1.3.2 吸附剂对菲-铜复合污染物的等温吸附
在22 mL 样品瓶中投加适量吸附剂(浓度为0.5 g·L-1),加入20 mL 菲-铜复合污染溶液(pH=5.0),其中一组铜浓度为5 mg·L-1时,菲浓度为0、0.2、0.4、0.6、0.8、1.0 mg·L-1;另一组菲浓度为1.0 mg·L-1时,铜浓度为0、1、2、3、4、5 mg·L-1。分别在15、20、25、30 ℃和35 ℃下,150 r·min-1振荡4 h 后,于离心机中4000 r·min-1离心5 min,取上清液测定菲和铜浓度。
1.3.3 投菌量对吸附剂吸附菲-铜复合污染物的影响
在22 mL 样品瓶中投加不同的吸附剂浓度(0、0.2、0.4、0.5、0.6、0.8、1.0 g·L-1),加入20 mL 菲-铜复合污染溶液(pH =5.0),菲浓度为1.0 mg·L-1、铜浓度为5 mg·L-1,在25 ℃下,150 r·min-1振荡4 h 后,于离心机中4000 r·min-1离心5 min,取上清液测定菲和铜浓度。
1.3.4 pH对吸附剂吸附菲-铜复合污染物的影响
在22 mL 样品瓶中投加适量吸附剂(浓度为0.5 g·L-1),加入20 mL 不同pH(3.0、3.5、4.0、4.5、5.0、5.5)的菲-铜复合污染溶液,菲浓度为1.0 mg·L-1、铜浓度为5 mg·L-1,在25 ℃下,150 r·min-1振荡4 h后,于离心机中4000 r·min-1离心5 min,取上清液测定菲和铜浓度。
1.3.5 吸附时间对吸附剂吸附菲-铜复合污染的影响
在22 mL 样品瓶中投加适量吸附剂(浓度为0.5 g·L-1),加入20 mL 菲-铜复合污染溶液(pH=5.0),菲浓度为1.0 mg·L-1、铜浓度为5 mg·L-1,在25 ℃下,150 r·min-1振荡不同时间(0、30、60、90、100、120、240、360、480 min)取样,于离心机中4000 r·min-1离心5 min,取上清液测定菲和铜浓度。
1.4 分析方法
1.4.1 菲分析方法
采用高效液相色谱仪(Agilent 1260 Infinity)测定,分析条件:色谱柱为PAHs专用色谱柱(5 μm,4.6×250 mm);荧光检测器λex=244 nm,λem=360 nm;流动相为甲醇/水(95∶5,体积比),流速1.0 mL·min-1;柱温40 ℃;进样量0.2 μL。
1.4.2 铜分析方法
用4-(2-吡啶偶氮)-间苯二酚光度法对铜进行分析[23]。
1.4.3 菌体表面形态观察
分别将吸附前以及吸附单一菲、铜和菲-铜复合污染体系的细胞经清洗、戊二醛固定、乙醇梯度脱水、干燥、喷金等操作后于扫描电镜(SEM)下观察[24]。
1.4.4 菌体红外光谱分析
分别将吸附前和吸附单一菲、铜和菲-铜复合污染体系的细胞加少量KBr 粉末混合并研磨、压片后用傅里叶变换红外光谱仪(FTIR)测定红外光谱[24]。
2 结果与讨论
2.1 共存污染物对细菌吸附菲、铜的影响
由图1 可以看出,在复合体系中,共存的菲或铜会显著影响P. aeruginosa 吸附剂对铜或菲的吸附效果(表1),影响程度随共存污染物浓度增大而增大。铜共存下(5 mg·L-1),吸附剂对菲的去除率最大提高了14.14%;而菲共存时(1.0 mg·L-1),吸附剂对铜的去除率下降了7.76%。共存污染物时,影响了吸附剂对铜和菲的吸附。

表1 实验因子对吸附效果影响的显著性分析Table 1 Significance analysis of the effects of experimental factors on adsorption effect
研究了25 ℃下,共存污染物时细菌吸附剂对菲和铜的等温吸附,如图2 所示。将吸附剂对菲和铜的吸附数据分别用线性模型(式1)和Langmuir 模型(式2)进行拟合,吸附参数列于表2。

式中:Kd表示菲的吸附系数,L·g-1;Ce表示平衡浓度,mg·L-1;KL表示铜的吸附系数,L·mg-1;Qe和Qm分别是平衡吸附量和饱和吸附量,mg·g-1;
从图2 和表2 可以看出,细菌吸附剂对复合体系中菲的吸附符合线性模型,对复合体系中铜的吸附符合Langmuir 模型。随着铜浓度的增加(0~5 mg·L-1),菲吸附系数与铜浓度呈正相关,Kd值从2.54 L·g-1增加到4.73 L·g-1(表2)。随着菲浓度的增加(0~1 mg·L-1),铜的吸附系数KL从4.88 L·mg-1增加到5.06 L·mg-1。表明共存污染物会影响彼此的吸附系数改变细菌吸附性能。
温度是影响吸附的主要原因之一,本文研究了吸附剂对复合污染体系在15~35 ℃对菲和铜的等温吸附,如图3 所示。对不同温度下的菲、铜的吸附用模型拟合(图3A,图3B),并计算了不同温度下的Kd、KL(表3)。在25 ℃,共存铜(5 mg·L-1)较单一体系,吸附剂对菲的吸附系数增大了1.86 倍(无铜时Kd为2.54 L·g-1)。铜的存在极大提高了吸附剂对菲的吸附能力,这与文献报道相一致。25 ℃时,吸附剂对铜的吸附,共存菲(1.0 mg·L-1)时铜的吸附系数(KL)达到5.06 L·mg-1,饱和吸附量达到5.30 mg·g-1,单一体系KL为4.89 L·mg-1,单一体系Qm为5.51 mg·g-1,与文献报道相当。

图2 共存污染物对细菌吸附菲(A)和铜(B)的影响Figure 2 Influence of co-existing pollutants on biosorption of phenanthrene(A)and copper(B)

表2 共存污染物对细菌吸附菲(Kd)和铜(KL)的影响Table 2 Influence of co-existing pollutants on biosorption of phenanthrene(Kd)and copper(KL)
进一步研究了温度对吸附系数的影响(图4),可以看出随温度升高,吸附剂对菲和铜的吸附系数均显著下降。如在共存铜下,相比于15 ℃,细菌对菲在35 ℃时的分配系数下降了52.63%。复合体系中,15 ℃下,细菌吸附剂对铜的吸附系数是35 ℃时的6.64倍。
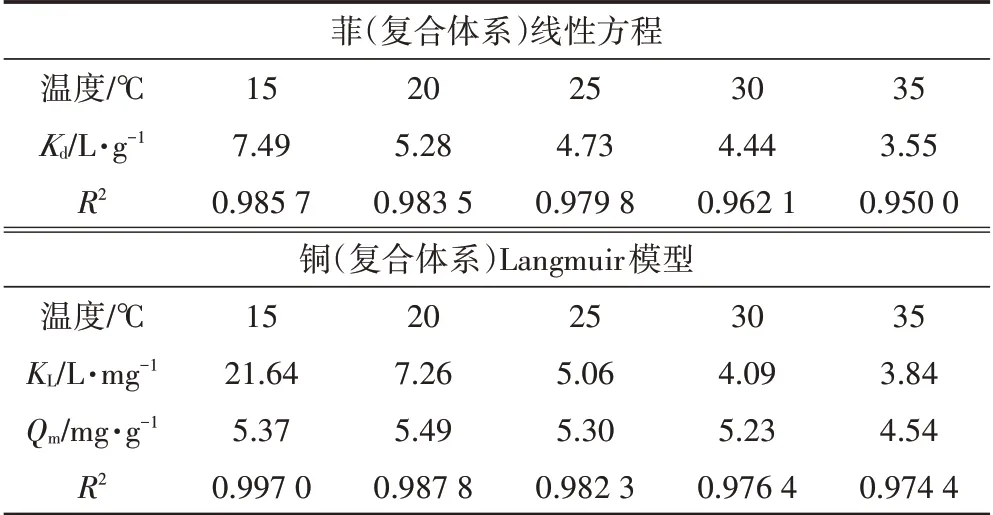
表3 铜和菲复合体系等温吸附模型拟合及各参数Table 3 Adsorption model fitting parameters for isotherm of copper and phenanthrene
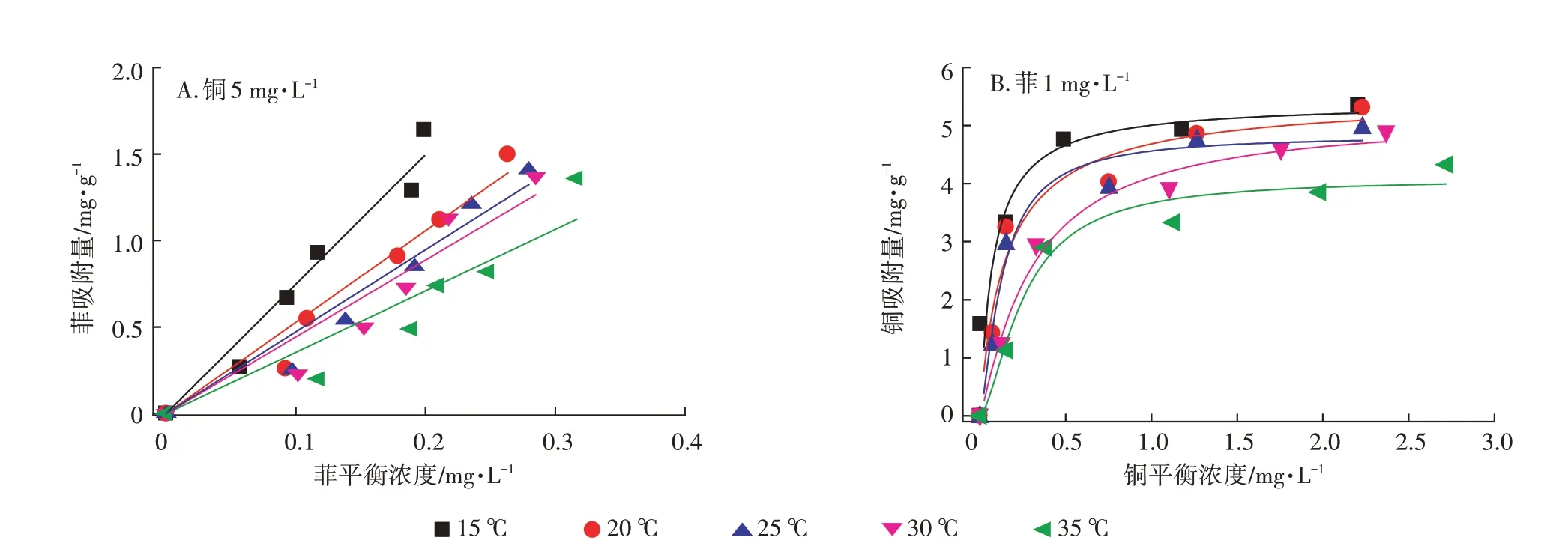
图3 复合体系中吸附剂对菲(A)和铜(B)的等温吸附Figure 3 Adsorption isotherms of biosorbent on phenanthrene(A)and copper(B)in the combined pollutants system
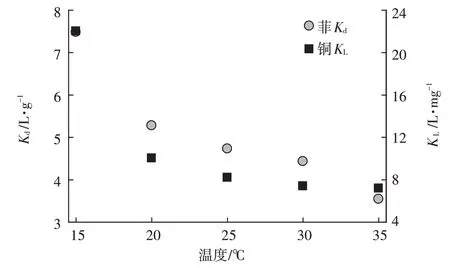
图4 温度对菲Kd、铜KL的影响Figure 4 Influence of temperature on adsorption coefficient of phenanthrene(Kd)and copper(KL)

图5 投菌量对菲、铜污染物去除率的影响Figure 5 Influence of the amount of bacteria on the removal rate of phenanthrene and copper pollutants
2.2 投菌量对吸附剂吸附菲-铜复合污染物的影响
吸附剂浓度是影响吸附的关键因素,实验进一步探究了投菌量对吸附复合体系中菲、铜的影响。由图5 可以看出,在单一体系和复合体系中,铜、菲的去除率随投菌量的增加均呈现先增加后趋于平稳的趋势。复合体系中菲、铜的平衡状态时去除率分别达77.37%、64.34%。吸附剂浓度在0.4~1.0 g·L-1时,复合体系中菲、铜均能达到较高去除率。
2.3 pH对吸附剂吸附菲-铜复合污染物的影响
pH是影响铜的去除的重要因素,研究结果(图6)发现,单一、复合体系中随pH 增大(3.0~5.5),铜的去除率显著提高,从3.42%增大到30.01%,pH 为5 时铜的单一体系和复合体系去除率分别为46.03%和44.21%,有研究表明质子化程度较高时,H+会占据大量吸附活性位点,随着pH 的增加,质子化程度降低,铜去除率有所增加。而细菌吸附菲对pH 不敏感,在pH=3.0~5.5 范围时,菲的去除率在70%左右,没有显著性差异(表1)。
2.4 吸附剂吸附菲-铜复合污染物动力学
菲、铜吸附率随时间的变化有相似趋势(图7),两者在30 min 已达到吸附平衡,该菌对菲、铜的吸附行为用准二阶动力学模型(式3)拟合(图8),单一、复合体系中菲、铜准二级吸附动力学数率常数为0.208 0、0.046 8 g·mg-1·min-1和0.075 2、0.072 2 g·mg-1·min-1。
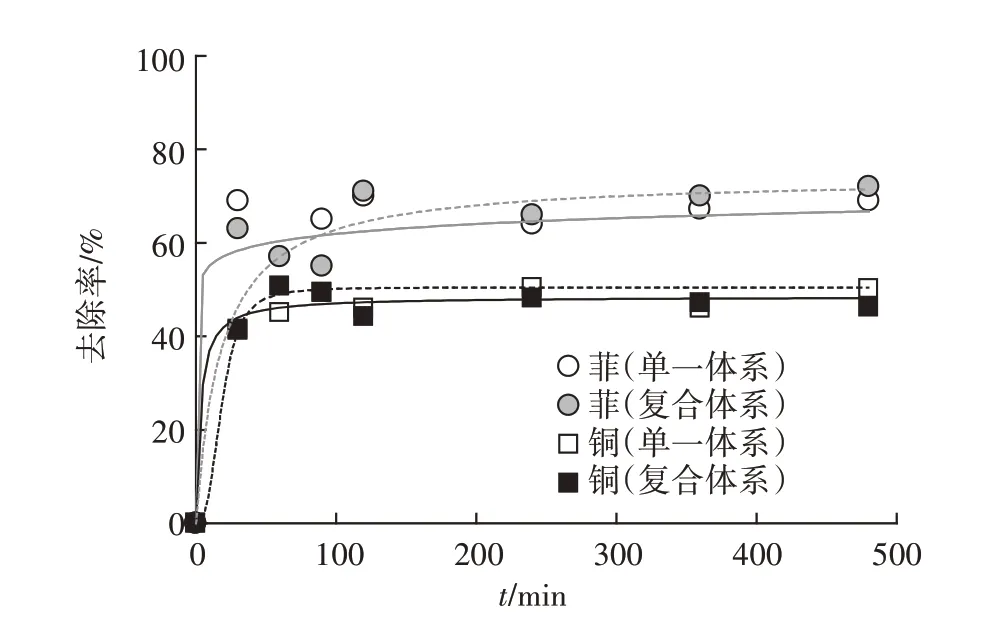
图7 P.aeruginosa对菲、铜污染物吸附动力学Figure 7 Adsorption kinetics for phenanthrene and copper

图8 准二级动力学拟合曲线Figure 8 Pseudo-second-order model fitting curves
准二级动力学模型公式

式中:t 表示吸附时间,min;Qe表示平衡吸附量,Qt表示时间为t时的吸附量,Ks表示二级吸附速率常数,g·mg-1·min-1
2.5 表征
为了初步探明复合体系中菲、铜对吸附剂影响的机制,采用扫描电镜(SEM)和傅里叶转换红外光谱法(FTIR)考察了吸附剂吸附污染物前后的细菌表面外观形貌和官能团变化,如图9 和图10 所示。从图9 的SEM图像也可以看出,细菌吸附单一菲后菌表面样貌并没有发生显著变化(如图9a 和图9b);而吸附铜离子后,细菌表面呈现均匀的凹凸(如图9c),图9d对复合污染的吸附也可以看出细菌表面呈现均匀的凹凸,也说明细菌吸附菲、铜存在不同的表面吸附行为。
从图10 可以看出,细菌吸附污染物之前,细菌表面官能团丰富,为吸附污染物提供了大量吸附位点。主要特征峰有3272~3289 cm-1处的吸收峰,来自细胞壁上蛋白质不饱和碳的C-H、N-H 和O-H 的伸缩振动;2923~2934 cm-1处的吸收峰,为蛋白质上饱和碳的C-H 键伸缩振动带;2100~2400 cm-1是叁键和累积双键区吸收峰,1627 cm-1的吸收峰,为酰胺Ⅰ带,是C=O的伸缩振动;1538 cm-1的吸收峰,为酰胺Ⅱ带,是N-H 的弯曲振动与C-N 伸缩振动的叠加,这两个峰是蛋白质的特征谱带。1393、1455 cm-1的吸收峰,分别属于蛋白质分子中-CH3的对称和反对称弯曲振动;1227 cm-1附近的吸收峰是O-H 面内弯曲振动,可能还有P=O 的伸缩振动;1053~1056 cm-1处的吸收峰主要来自糖环C-O-H 的伸缩振动,以及脂类C-O-C键的伸缩振动,可能也有-的伸缩振动。

图9 细菌吸附污染物前后SEM图(×10 000倍)Figure 9 SEM images before and after adsorption of bacteria(×10 000 times)
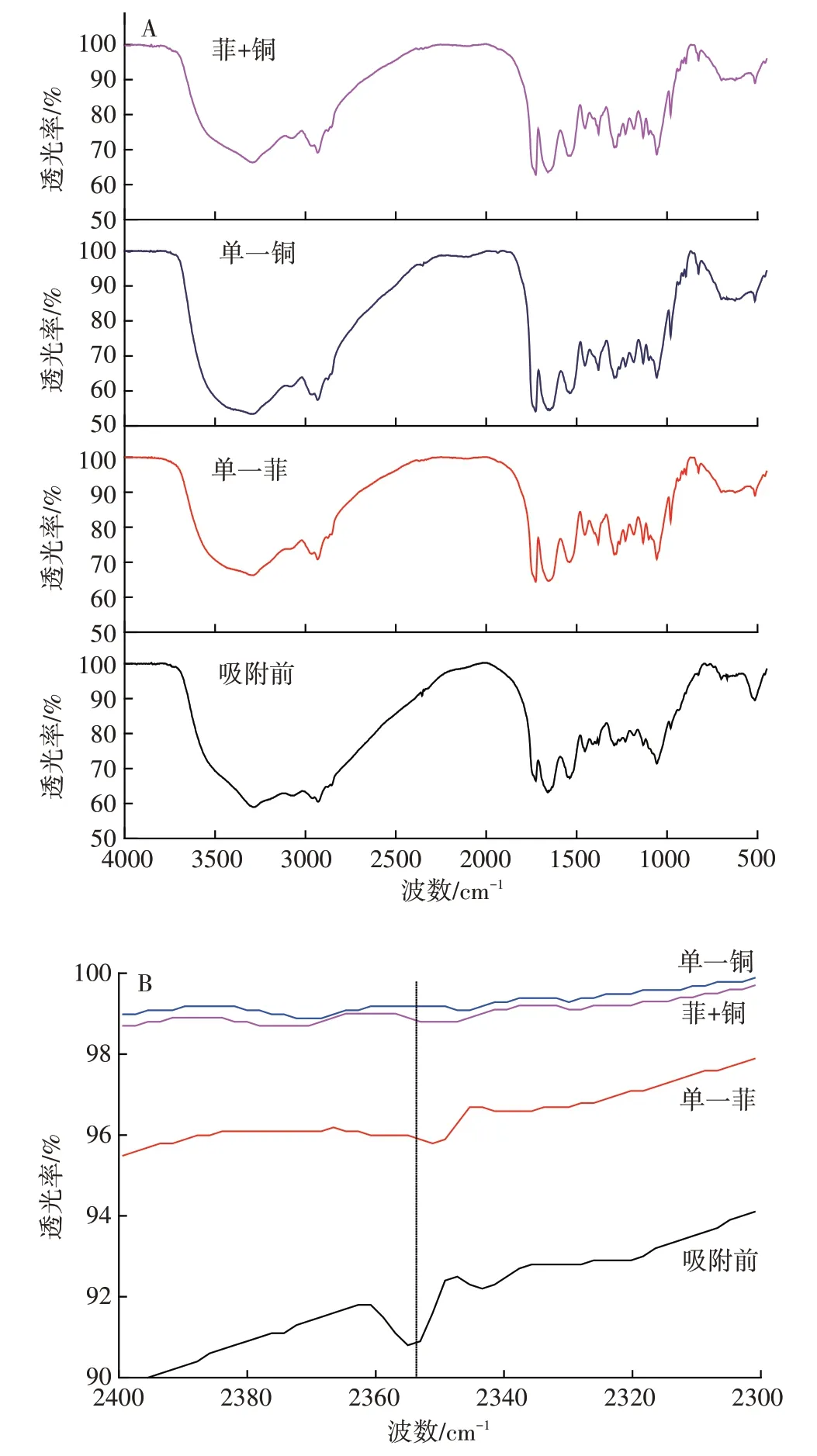
图10 细菌吸附污染物前后的FTIR图谱(A)和局部放大图(B)Figure 10 FTIR spectra of bacteria before and after adsorption(A)and partial enlarged drawing(B)
菌体吸附菲前后并没有显著的官能团变化,两者的红外光谱极为相似,这与细菌吸附菲主要是分配作用而没有改变/占用细菌表面官能团是一致的。
细菌对铜离子的吸附则主要表现为表面官能团络合行为,导致细菌表面部分官能团被掩蔽,如图10局部放大图(B),细菌吸附单一铜、菲-铜复合污染物后,在2350 cm-1处的吸收峰变弱,表明菌体吸附过程同细胞的叁键和累积双键官能团伸缩振动有关。同时,铜离子与细胞的叁键和累积双键络合后,影响了细菌吸附剂对复合污染的吸附。
3 结论
(1)复合体系中,温度显著影响P. aeruginosa 吸附剂对菲、铜的吸附。35 ℃时菲吸附系数(3.55 L·g-1)较15 ℃(7.49 L·g-1)下降了52.63%;铜的吸附系数从21.64 L·mg-1下降至3.84 L·mg-1。菲的等温吸附用线性拟合,且吸附常数随温度升高而减小,铜的等温吸附用Langmuir模型拟合,细菌吸附剂对其吸附能力随着温度增加而下降。pH 显著影响铜的去除,对菲的吸附则影响不显著。
(2)复合体系中,细菌吸附菲后细胞表面及表面官能团没有改变/占用细菌表面官能团,吸附菲表现为分配作用,吸附铜离子后,细菌表面呈均匀凹凸,铜离子与细菌表面叁键和累积双键官能团络合后影响了复合污染的吸附。

