地黄微型饮片制备工艺△
赵芳雪,史俊祖,刘颖,辜一情,姜宇婷,单国顺,贾天柱
辽宁中医药大学 药学院,辽宁 大连 116600
地黄为玄参科植物地黄RehmanniaglutinosaLibosch.的块根,始载于《神农本草经》,列为上品。作为临床常用中药之一,地黄具有清热生津、凉血止血的作用[1-2]。但其个体通常较大,最长可达十几厘米,直径可达五六厘米,临床使用中通常将其切制成厚2~3 mm的饮片。而这种饮片的规格较大,质地较黏,不便于临床调剂和有效成分的煎出,从而限制了饮片的自动调剂的发展。同时,也降低了饮片的利用率。针对上述情况,辽宁中医药大学的贾天柱教授提出“微型饮片”概念,即指体积较大的药材,经切制所得到的边长小于0.5 cm的丁块饮片。微型饮片作为一种新型饮片,本身具有流动性好和有效成分浸出率高的特点。因此,为了方便地黄饮片在临床上的调剂,提高有效成分的煎出,本文拟开展具有高流动、高煎出特性的地黄微型饮片制备工艺研究,以期为中药现代化的发展提供参考。

注:A.地黄药材;B.传统饮片;C.微型饮片。图1 地黄药材、常规饮片及微型饮片对比图
1 材料
1.1 仪器
日本岛津公司LC-20AB液相色谱仪(LC-20AB泵、CTO-20A柱温箱、SIL-20A自动进样器、CBM-20A数据转换器);LC-Solution色谱数据工作站(日本岛津公司);细集料流动时间测定仪(绍兴市上虞越达仪器厂);METTLER AE240型十万分之一分析天平;FA1004B电子天平(上海精密科学仪器有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);ZQRZG型智能化直线往复式切药机(杭州海善制药设备有限公司);DHF-200手提式高速万能打粉机(温岭市林大机械有限公司);X/WT数显调节仪电热恒温水浴锅(余姚市显星仪器有限公司);电热恒温干燥箱(上海市跃进医疗器械一厂)。
1.2 试药
地黄药材购自大连权健中药饮片有限公司,批号:20171025,经辽宁中医药大学中药鉴定教研室翟延君教授鉴定为为玄参科植物地黄RehmanniaglutinosaLibosch.的干燥块根。
梓醇、毛蕊花糖苷对照品(四川省维克奇生物科技有限公司,批号分别为:wkq16040301、wkq16062004,经HPLC测定纯度均大于98%);乙腈为色谱纯;水为纯净水;其他试剂均为分析纯。
2 方法与结果
2.1 梓醇的含量测定
2.1.1 对照品溶液的制备 取梓醇对照品适量,精密称定,置于50 mL量瓶中,加甲醇溶解并定容至刻度,制成质量浓度为0.464 0 mg·mL-1的对照品溶液。
2.1.2 供试品溶液的制备 取地黄饮片粉末约2.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,加热回流提取1.5 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液10 mL,浓缩至近干,残渣加水溶解,转移至10 mL容量瓶中,并用水稀释至刻度线,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得[1]。
2.1.3 色谱条件 色谱柱:Microsorb C18(250 mm×4.6 mm,5 μm);柱温:30 ℃;流速:1.0 mL·min-1;PDA检测器,检测波长:203 nm;流动相:0.1 % 磷酸水(A)-乙腈(B),梯度洗脱,洗脱程序:0~5 min(2%~3 % B);5~20 min(3%~4 % B);20~25 min(4%~4 % B);25~30 min(4%~2 % B);30~40 min(2%~2 % B)色谱图见图2[1]。

注:A.梓醇对照品;B.地黄饮片;1.梓醇。图2 梓醇对照品及地黄饮片色谱图
2.1.4 线性关系考察 精密吸取梓醇对照品溶液1、2、5、10、20、40 μL,注入高效液相色谱仪,按照2.1.3项下色谱条件进行测定,以对照品进样量(μg)为横坐标X,峰面积为纵坐标Y,绘制标准曲线。结果梓醇的回归方程为Y=151 119X+105 774(r=0.999 7),表明梓醇进样量在0.464 0~18.56 μg具有良好的线性关系。
2.1.5 精密度试验 分别精密吸取同一供试品溶液,按2.1.3项下操作,连续进样6次,记录色谱峰面积,结果梓醇峰面积的RSD为0.95%,表明仪器精密度良好。
2.1.6 重复性试验 取同一地黄样品粉末6份,按照2.1.2项下方法制备供试品溶液,并按2.1.3项下色谱条件进行分析,结果梓醇含量的RSD为1.01%,表明本法重复性良好。
2.1.7 稳定性试验 取地黄供试品溶液,室温放置,按2.1.3项下色谱条件,分别于0、2、4、8、12、24 h进样分析,记录各自峰面积,结果梓醇峰面积的RSD为1.01%,表明供试品溶液在24 h内稳定。
2.1.8 加样回收率试验 取已知含量的地黄饮片6份,每份约1.0 g,精密称定,置具塞锥形瓶中,每组分别加入梓醇对照品溶液7 mL,按照2.1.2项下方法制备供试品溶液,并按2.1.3项下色谱条件进行分析,结果见表1。
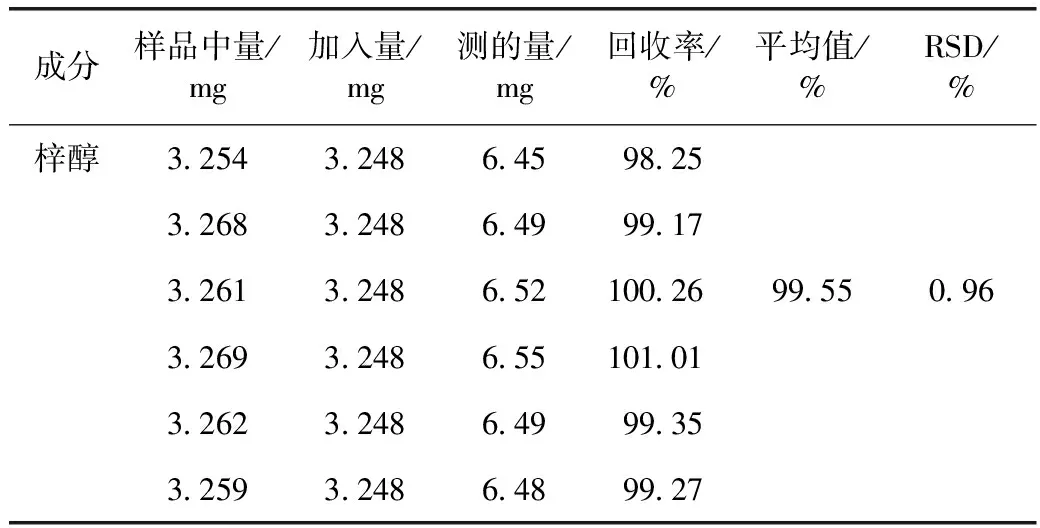
表1 梓醇加样回收率结果(n=6)
2.2 毛蕊花糖苷的含量测定
2.2.1 对照品溶液的制备 取毛蕊花糖苷对照品适量,精密称定,置25 mL量瓶中,加甲醇溶解并定容至刻度,制成质量浓度为0.203 0 mg·mL-1的对照品溶液。
2.2.2供试品溶液的制备 取地黄样品粉末约2.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定重量,加热回流提取1.h,放冷,再称定重量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液10 mL,浓缩至近干,残渣加水溶解,转移至10 mL容量瓶中,并用水稀释至刻度线,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得[1]。
2.2.3色谱条件 色谱柱为Welch Xtimate C18(250 mm×4.6 mm,5 μm);柱温:35 ℃;流速:1.0 mL·min-1;检测波长:334 nm;流动相:0.1%醋酸水-乙腈(82∶18),进样体积为20 μL,色谱图见图3[1]。
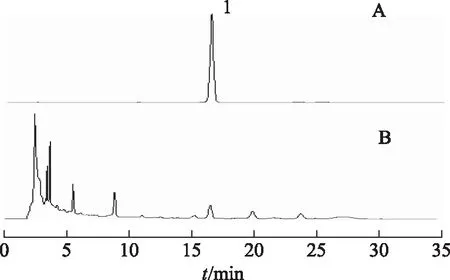
注:A.毛蕊花糖苷对照品;B.地黄饮片;1.毛蕊花糖苷。图3 毛蕊花糖苷对照品及地黄饮片色谱图
2.2.4 线性关系考察 分别精密吸取毛蕊花糖苷对照品溶液1、2、5、10、20、40 μL,注入高效液相色谱仪,按照上述色谱条件进行测定,以对照品进样量(μg)为横坐标X,峰面积为纵坐标Y,绘制标准曲线。结果毛蕊花糖苷的回归方程为Y=2 830 600X+11 700(r=0.999 8),表明毛蕊花糖苷在进样量0.203 0~8.120 μg具有良好的线性关系。
2.2.5 精密度试验 分别精密吸取同一供试品溶液,按2.2.3项下操作,连续进样6次,记录色谱峰面积,结果毛蕊花糖苷峰面积的RSD为1.19%,表明仪器精密度良好。
2.2.6 重复性试验 取同一地黄样品粉末6份,按照2.2.2项下方法制备供试品溶液,并按2.2.3项下色谱条件进行分析,结果毛蕊花糖苷含量的RSD为0.90%,表明本法重复性良好。
2.2.7 稳定性试验 取地黄供试品溶液,室温放置,按2.2.3项下色谱条件,分别于0、2、4、8、12、24 h进样分析,记录各自峰面积,结果毛蕊花糖苷峰面积的RSD为1.89%,表明供试品溶液在24 h内稳定。
2.2.8 加样回收率试验 取已知含量的地黄饮片6份,每份约1.0 g,精密称定,置具塞锥形瓶中,每组加入毛蕊花糖苷对照品溶液1 mL,按照2.2.2项下方法制备供试品溶液,并按2.2.3项下色谱条件进行分析,结果见表2。

表2 毛蕊花糖苷加样回收率结果(n=6)
2.3 饮片煎膏率的测定
取饮片样品5 g,精密称定,加10倍量冷水浸泡40 min,直火加热,水沸后改用文火煎煮30 min,滤过,药液备用;药渣加8倍量水,继续煎煮,水沸后改用文火煎煮20 min,滤过,合并两次药液,定容至100 mL量瓶中,混匀。精密量取上述煎煮液50 mL,置己恒重的蒸发皿中,于沸水浴上浓缩至干,然后置于烘干箱中105 ℃烘至恒重,记录煎膏质量并计算煎膏率。

(1)
2.4 地黄饮片制备成品率的测定
地黄药材低温干燥,控制水分含量小于8%。取上述地黄药材100 g,清水闷润至软后进行切制,样品干燥后,控制含水量小于8%,称定成品饮片的质量并计算成品率。

(2)
2.5 饮片的流动性考察
每次称取100 g地黄微型饮片,采用细集料流动时间测定仪,记录打开阀门到样品全部流出测定仪的时间,即为样品的流动时间,每个样品测定10次。
2.6 饮片切制工艺优化研究
2.6.1 正交试验设计及方法 根据前期文献调研及初步预试验研究,确定切制方式(A)、粒径(B)、干燥温度(C)为考察因素,每个因素设定3个水平,不考虑交互作用,选用L9(34)正交表设计试验,因素水平表见表3。

表3 正交试验因素水平表
微型饮片的切制:各组实验均先以切药机进行切片,然后按照微型饮片切制工艺的设计,手工码放于切药机中,再按照纵切与横切的组合方式,进行二次切条和三次成粒。
本试验的结果采用综合评分法进行评价,根据各指标在微型饮片制备工艺及成品质量的贡献大小设计权重。各组实验,以成品率最高的计为10分,其相应计分为A×10/最高成品率;以煎膏率最高者计为30分,其相应计分为B×30/最高煎膏率;以有效成分梓醇及毛蕊花糖苷的煎出率最高值计为30分,其他各组相应计分为C×30/煎出率最高得分;以流动时间最快得分计为30分,其相应计分为D×30/流动时间最快组。(即:综合评分P=A×10/最高成品率+B×30/最高煎膏率+C×30/活性成分煎出率最高得分+30×流动时间最小/D。其中,A为成品率,B为煎膏率,C为活性成分梓醇及毛蕊花糖苷的煎出率得分,D为流动时间)。
为了考察地黄切制成微型饮片后主要活性成分梓醇及毛蕊花糖苷在水煎液中煎出效果是否受到影响。笔者以水煎液中梓醇(毛蕊花糖苷)的含量与药材中梓醇(毛蕊花糖苷)的含量相除,计算活性成分的煎出率。并采用综合得分法设计活性成分的煎出率得分。具体煎出率得分O=E×50/梓醇的最高煎出率+F×50/毛蕊花糖苷最高煎出率(E为梓醇的煎出率,F为毛蕊花糖苷的煎出率)。
2.6.2 试验方法及结果 按正交表安排进行试验,正交试验安排及试验测定结果见表4,方差分析结果见表5。
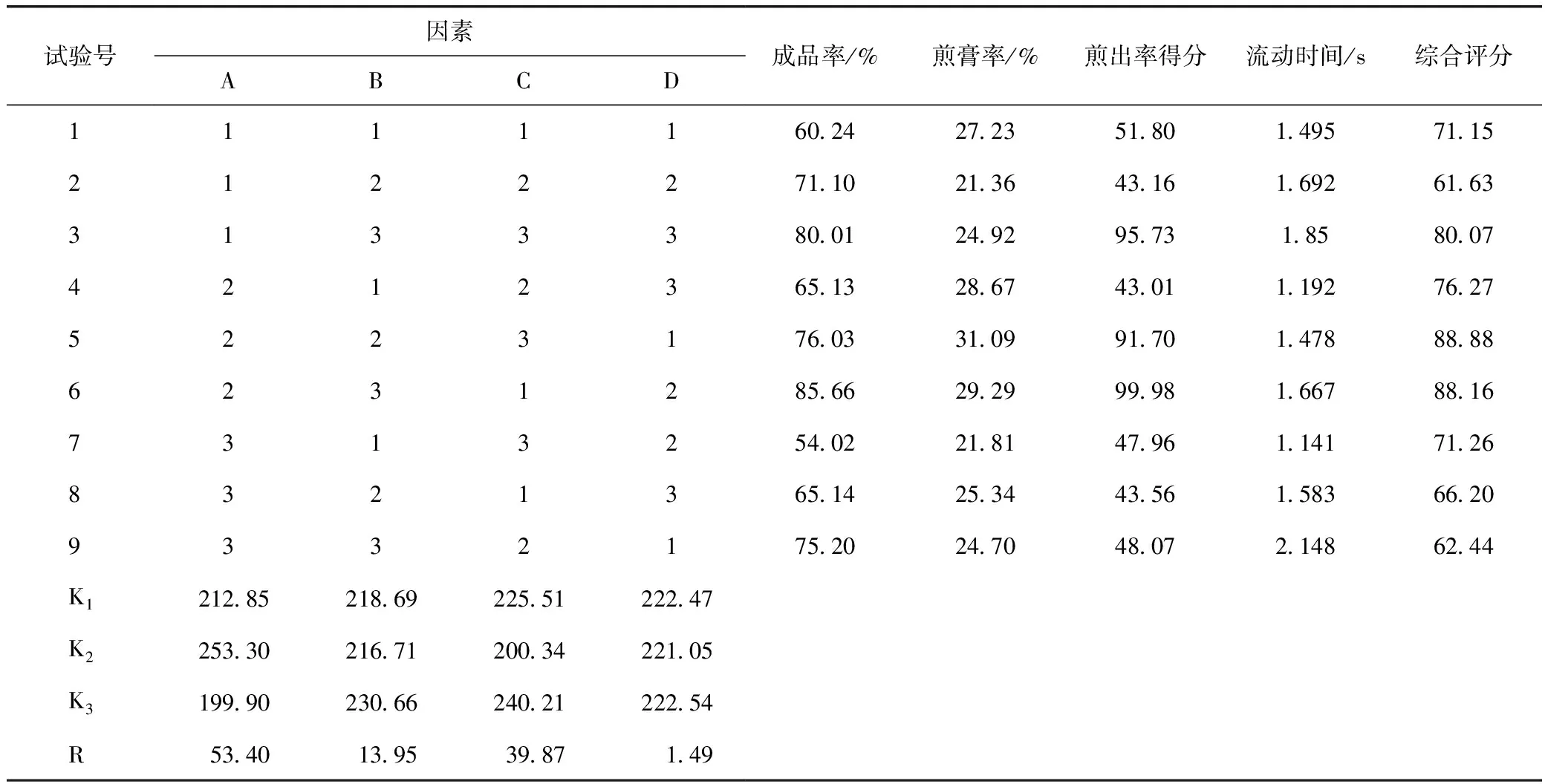
表4 正交试验设计及结果
由试验结果分析可知,各因素对综合得分影响大小依次为A>C>B,即切制方式>干燥温度>粒径,由此确定地黄微型饮片的切制工艺为A2B2C3,即生地黄以先纵切,再横切的方式,切制成0.3~0.4 mm3的小丁块,并以80 ℃烘干。
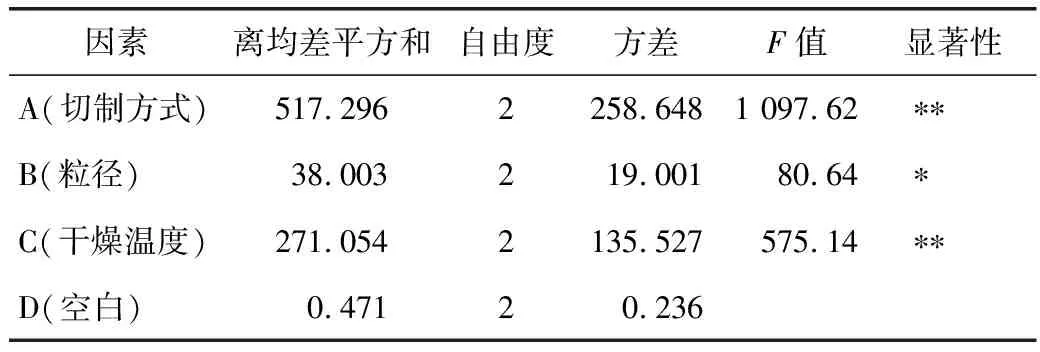
表5 方差分析结果
注:F0.05(2,9)=19;F0.01(2,9)=99;*为P<0.05;**为P<0.01。
由方差分析结果可知,切制方式及干燥温度对地黄微型饮片的制备工艺的影响差异有统计学意义,粒径也对地黄微型饮片的制备工艺的影响差异有统计学意义,因此,结合综合得分确定地黄微型饮片的切制工艺为A2B2C3,即生地黄以先纵切,再横切的方式,切制成0.3~0.4 mm3的小丁块,并以80 ℃烘干。
2.6.3 最佳工艺验证试验 称取3份生地黄样品各100 g,以最佳工艺方法切制,并按2.2、2.3、2.4、2.5项下方法测定地黄微型饮片中的梓醇、毛蕊花糖苷含量、煎膏率、成品率及流动时间。结果见表6。

表6 验证试验
结果表明,3份样品中成品率、煎膏率、梓醇、毛蕊花糖苷含量均较高且流动时间较短,表明该工艺切实可行。
3 讨论
地黄作为临床常用的大品种,主要含有环烯醚萜及其苷类、紫罗兰酮类、苯乙醇苷类、糖类、氨基酸及微量元素等[3-5]。其中,环烯醚萜苷类和苯乙醇苷类是地黄中主要活性成分,也是发挥疗效的主要物质基础。因此,我们在2015版《中华人民共和国药典》地黄项下含量测定方法的基础上,结合相关文献报道建立了地黄饮片中环烯醚萜苷类梓醇及苯乙醇苷类成分毛蕊花糖苷的含量测定方法,并用于地黄饮片的质量控制及炮制工艺的优化[6-7]。
“饮片”其名源于古人将切制后的药片加水做成“饮剂”饮用而来,最早出现在南宋著名学者周密的《武林旧事》中,“熟药圆散,生药饮片”,并一直沿用至今[8]。长久以来,作为中药应用于临床的最终形式,饮片一直以粗放、简陋的形式呈现在世人面前。由于片型各异,只能以戥秤调剂,既增加了调剂人员的工作量,又制约了调剂的精度和速度。因此,近年来中医药科研工作者在饮片的“形”上进行多次改进,先后推出了浓缩颗粒、超微饮片等一系列产品,但由于这些“饮片”缺少共煎过程,使其应用受到限制;接着又推出了小包装饮片,但又产生了二次污染,且调剂人员看不到药,不识药,亦存在大量缺点[9-10]。鉴此,“微型饮片”应运而生,作为一种新型饮片,微型饮片在保留传统饮片特色的同时,化大为小,既可提高药材有效成分的煎出率,减少饮片使用量,又增加了饮片的流动性,便于调剂和煎煮,更适用于智能调剂和煎煮系统的应用[11]。
前期研究发现,随着饮片粒径的降低,其煎膏率及有效成分煎出率均增加,这一结果也在一定程度上反映出微型饮片研究的合理性。但也有研究指出,饮片粒径过细在煎煮过程中易出现糊锅及不易过滤现象[12-18]。因此,本研究综合上述因素来设定地黄微型饮片的粒径,从而既保证有效成分的煎出,又保持其良好的流动性且不易出现糊锅和不易过滤的现象。
微型饮片的流动性对于饮片自动调剂具有积极的意义。鉴于微型饮片的颗粒状属性,药物制剂领域的休止角测定并不适合对微型饮片的流动性进行考察。因此,我们采用了建筑工程领域的细集料流动时间测定仪,并经过适当改进,以适应微型饮片流动性测定的需要。
微型饮片作为一种新型饮片,其本身具备“规格划一,流动可调”的优点。但是,作为一种新生事物,微型饮片本身尚存在许多问题需要解决。其中,最重要的是对炮制工艺的规范。本研究正是通过正交试验的方法对地黄微型饮片的最佳制备工艺进行验证,证明了该工艺确实可行,适用于工业化生产的需求。未来实验将会进一步对微型饮片与常规饮片及细粉之间的药理药效、特征图谱等方面进行比较研究,从而为微型饮片的安全性提供数据支持。

