达芬奇机器人与腹腔镜胃癌手术安全性与可行性对比的meta分析
,, ,国海
(皖南医学院弋矶山医院,安徽 芜湖,241001)
胃癌是我国常见的消化道恶性肿瘤,居恶性肿瘤死因第三位,其发病率一直居高不下,全球每年约有 95.1万新发病例,72.3万死亡病例,已成为全球肿瘤相关死亡的第三大原因。近年,全球胃癌发生率均有稳定的下降,但亚洲仍是胃癌发病率最高的地区[1]。由于缺乏早期诊断手段,患者确诊时多已属中晚期,外科手术仍是最有效的治疗手段,手术方式已从传统开腹手术发展到腹腔镜手术[2],与传统开腹手术相比,微创手术具有住院时间短、术后疼痛轻、早期下床活动、早期进食等优点[3]。但由于腹腔镜器械在有限的空间内运动的限制、手震颤的放大、二维成像及仪器移动的不足,达芬奇机器人手术应运而生,很多外科医师希望应用这项创新性技术克服腹腔镜技术的一些局限性,自2001年Giulianotti等[4]开展第一例机器人胃切除术(robotic gastrectomy,RG)以来,不少研究证实了RG的可行性,由于具有多方面的优越性,国内很多大型医院也相继引进达芬奇机器人系统,但相对腹腔镜手术而言,机器人胃癌切除术开展例数仍较少,相关研究也是小样本单因素的分析,其有效性、安全性有待于进一步探讨。
1 资料与方法
1.1 检索策略 以“gastric cancer or gastric carcinoma or gastric neoplasms”,“laparoscopic or laparoscopy or laparoscopic-assisted or laparoscopy-assisted”,“robot or Da Vinci robot or robot assisted or Da Vinci robot assisted”为英文检索词;以“胃癌”、“胃切除术”、“腹腔镜”、“达芬奇”、“机器人”为中文检索词;检索PubMed、Web of Science、Embase及Cochrane Library、中国知网(CNKI)、万方数据库、中国生物医学文献数据库(CBM)等医学数据库,手动检索公开发表的相关刊物,筛选有关RG与腹腔镜胃切除术(laparoscopic gastrectomy,LG)的对比性研究文献,检索时间为2015~2018年。
1.2 文献纳入标准 (1)手术或胃镜后病理证实为胃癌;(2)对RG与LG的临床对比研究;(3)有统计分析所需数据的全文文章;(4)至少有以下观察指标中的一项:手术时间、切除淋巴结数量、估计失血量、术后通气及进食时间、近远端切缘长度、住院时间、术后并发症。如果发现同一中心或同一作者重复的研究,则选择最近的研究或有更多病例数的文献作为研究对象;如果发现同一中心的完全不同患者的同类研究,我们仍作为纳入标准。
1.3 文献排除标准 (1)病例中包含胃良性肿瘤或因其他原因行胃切除术者;(2)胃癌患者为缓解症状仅行姑息性手术;(3)文献中包含胃癌行急诊手术的病例;(4)文献中包括复发性胃癌的病例;(5)Meta分析、病例报道、综述、会议报告类型的文献;(6)同一作者或同一中心包含相同病例的重复研究;(7)提取不出相关对比数据的文献。
1.4 数据提取与文献质量评估 数据由两位审查员根据上
述排除与纳入标准独立提取,对于意见不统一的文献经协商或由第三位审查员商讨解决。提取数据包括:第一作者、国家、发表时间、研究时间、研究类型、两组病例数、手术时间、淋巴结清扫数量、术中出血量、术后首次通气时间、术后首次进食时间、近远端切缘长度、术后住院时间及术后总并发症。根据纳入与排除标准,入选文献我们采用Newcastle-Ottawa Scale(NOS)文献质量评价标准进行评分,NOS评分为0~9分,得分≥6分认为研究方法是合理的,可纳入研究。
1.5 统计学处理 采用Review Manager 5.3软件(由Cochrane协作网提供)进行数据分析。对于二分类变量使用比值比(odds ratio,OR)分析,连续性变量利用加权均数差(weighted mean difference,WMD)评估;使用固定效应模型对异质性较小(I2<50%)的数据进行合并统计效应量,使用随机效应模型对异质性较大(I2≥50%)的数据进行合并统计效应量。P<0.05为差异有统计学意义。
2 结 果
2.1 文献提取情况 根据关键词搜索,共搜索到相关文献576篇,通过阅读标题与摘要排除423篇,进一步阅读全文,根据纳入与排除标准,排除综述、Meta分析、会议报告等126篇文献,分析剩余27篇文献的数据,去掉包含相同病例的文献中研究质量相对较差的4篇文献,使用NOS评分系统对文献进行评分,去掉其中评分较低的5篇,最终纳入18篇随机对照及回顾性分析RG与LG近期疗效、安全性的文献,共包括6 644例患者,其中RG组2 028例,LG组4 616例,大部分研究来自东亚(中国、日本、韩国),文献检索及筛选流程图见图1,文献基本信息见表1,文献质量评分均≥6分。
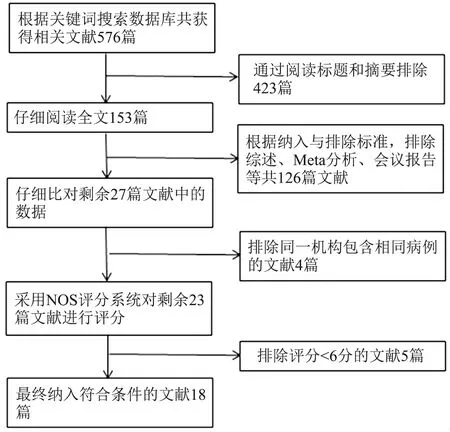
图1 文献检索及筛选流程图
表1 纳入文献的基本特征
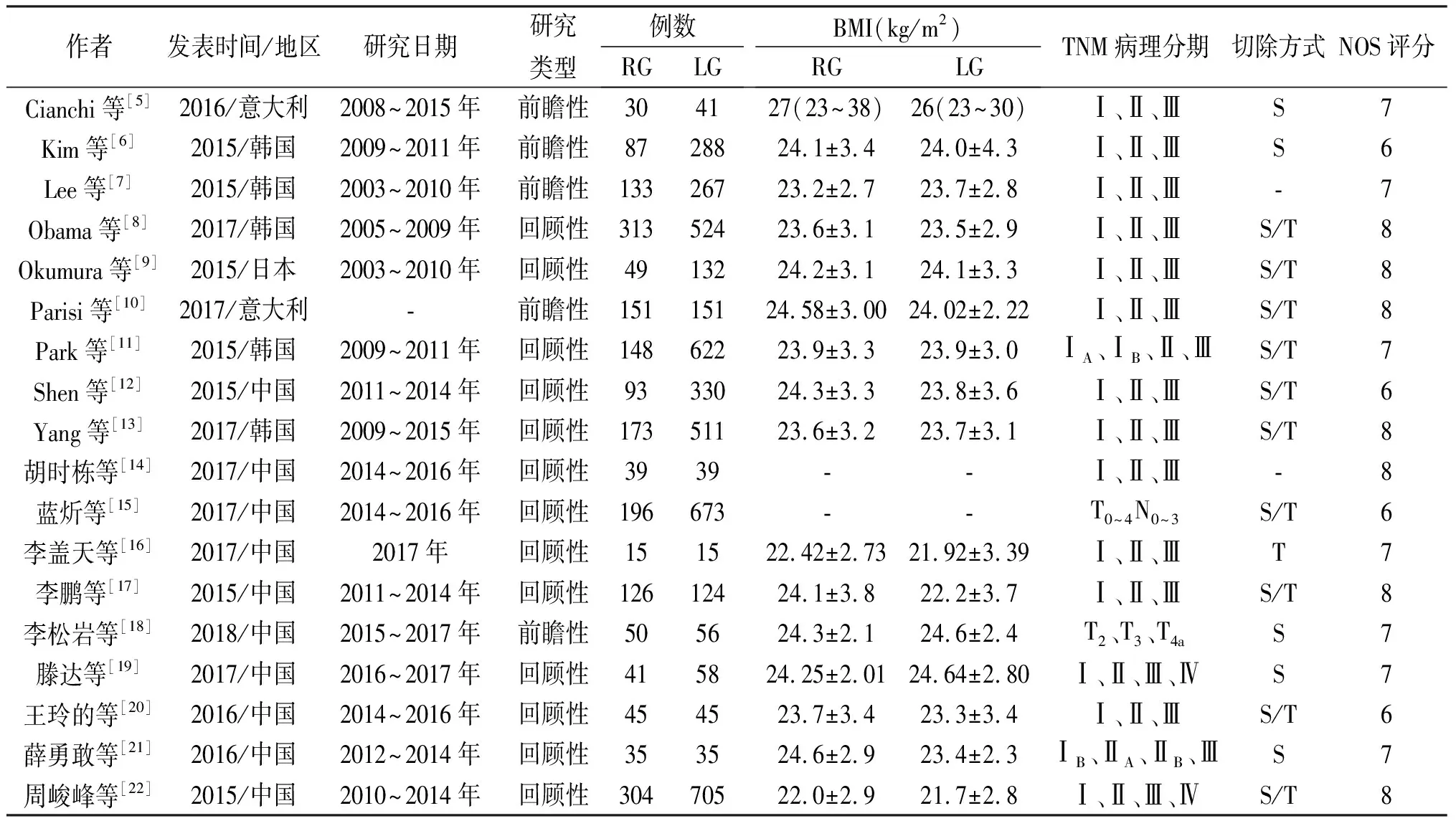
作者发表时间/地区研究日期研究类型例数RGLGBMI(kg/m2)RGLGTNM病理分期切除方式NOS评分Cianchi等[5]2016/意大利2008~2015年前瞻性30 4127(23~38)26(23~30)Ⅰ、Ⅱ、ⅢS7Kim等[6]2015/韩国2009~2011年前瞻性8728824.1±3.424.0±4.3Ⅰ、Ⅱ、ⅢS6Lee等[7]2015/韩国2003~2010年前瞻性13326723.2±2.723.7±2.8Ⅰ、Ⅱ、Ⅲ-7Obama等[8]2017/韩国2005~2009年回顾性31352423.6±3.123.5±2.9Ⅰ、Ⅱ、ⅢS/T8Okumura等[9]2015/日本2003~2010年回顾性4913224.2±3.124.1±3.3Ⅰ、Ⅱ、ⅢS/T8Parisi等[10]2017/意大利-前瞻性15115124.58±3.0024.02±2.22Ⅰ、Ⅱ、ⅢS/T8Park等[11]2015/韩国2009~2011年回顾性14862223.9±3.323.9±3.0ⅠA、ⅠB、Ⅱ、ⅢS/T7Shen等[12]2015/中国2011~2014年回顾性9333024.3±3.323.8±3.6Ⅰ、Ⅱ、ⅢS/T6Yang等[13]2017/韩国2009~2015年回顾性17351123.6±3.223.7±3.1Ⅰ、Ⅱ、ⅢS/T8胡时栋等[14]2017/中国2014~2016年回顾性3939 --Ⅰ、Ⅱ、Ⅲ -8蓝炘等[15]2017/中国2014~2016年回顾性196673--T0~4N0~3S/T6李盖天等[16]2017/中国2017年回顾性151522.42±2.7321.92±3.39Ⅰ、Ⅱ、ⅢT7李鹏等[17]2015/中国2011~2014年回顾性12612424.1±3.822.2±3.7Ⅰ、Ⅱ、ⅢS/T8李松岩等[18]2018/中国2015~2017年前瞻性505624.3±2.124.6±2.4T2、T3、T4aS7滕达等[19]2017/中国2016~2017年回顾性415824.25±2.0124.64±2.80Ⅰ、Ⅱ、Ⅲ、ⅣS7王玲的等[20]2016/中国2014~2016年回顾性454523.7±3.423.3±3.4Ⅰ、Ⅱ、ⅢS/T6薛勇敢等[21]2016/中国2012~2014年回顾性353524.6±2.923.4±2.3ⅠB、ⅡA、ⅡB、ⅢS7周峻峰等[22]2015/中国2010~2014年回顾性30470522.0±2.921.7±2.8Ⅰ、Ⅱ、Ⅲ、ⅣS/T8
-:表示文献中未提及;S:胃部分切除术,T:全胃切除术
2.2 纳入文献相关指标meta分析结果
2.2.1 两组手术时间的比较 纳入的18篇文献中17篇对两组手术时间进行了比较,检验结果异质性为I2=97%,采用随机效应模型进行统计,结果显示与LG组相比,RG组手术时间增加[WMD(95%CI):44.20 (29.36~59.04),P<0.01]。见图2。
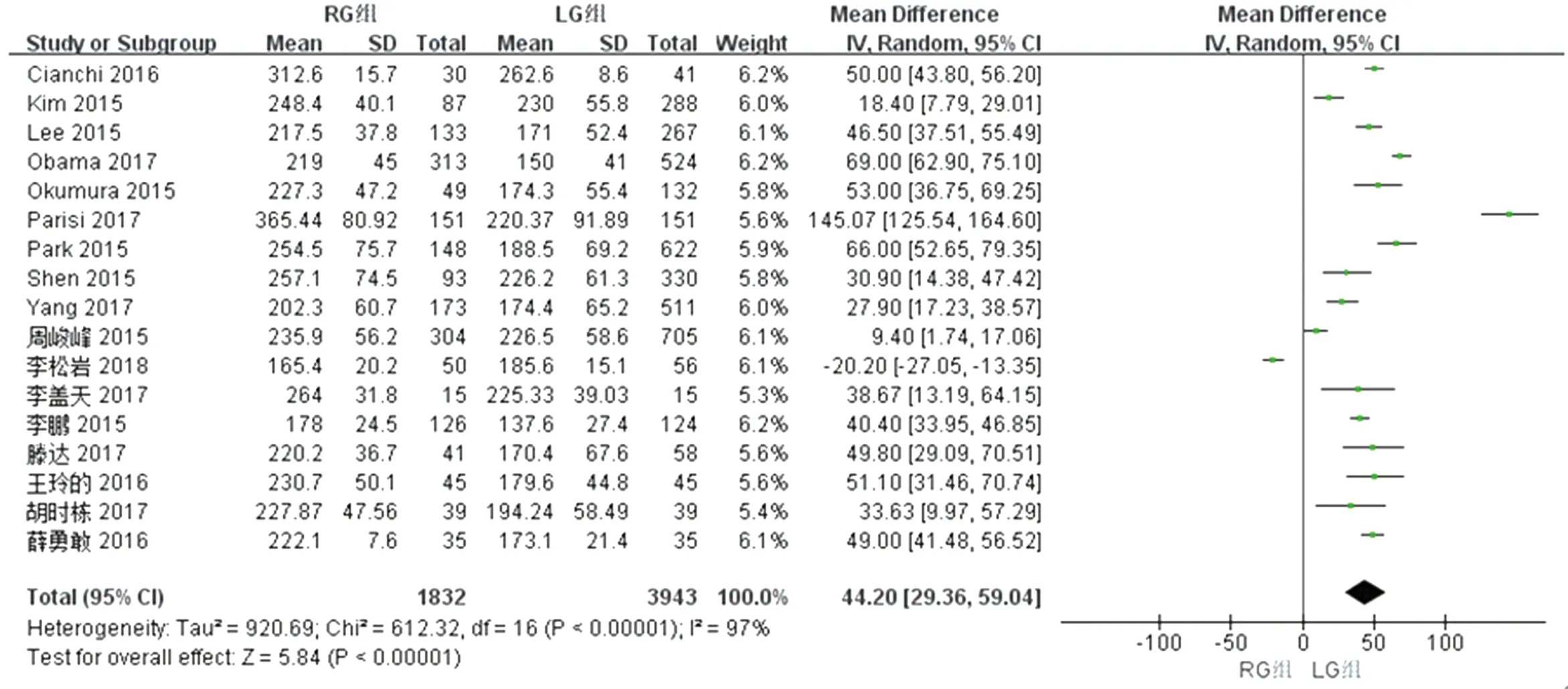
图2 两组手术时间meta分析结果
2.2.2 两组术中失血量的比较 17篇文献对两组术中失血量进行了比较,检验结果异质性为I2=83%,采用随机效应模型进行统计分析,结果显示与LG组相比,RG组术中失血量少[WMD(95%CI):-24.05(-33.21~-14.89),P<0.01]。见图3。
2.2.3 两组淋巴结清扫数量的比较 16篇文献对两组淋巴结清扫数量进行了比较,检验结果异质性为I2=90%,采用随机效应模型进行统计分析,结果显示与LG组相比,RG组淋巴结清扫数量多[WMD(95%CI):3.17(1.53~4.81),P<0.01]。见图4。
2.2.4 两组术后首次排气时间的比较 11篇文献对两组术后首次排气时间进行了比较,检验结果异质性为I2=78%,采用随机效应模型进行统计分析,结果显示与LG组相比,RG组术后首次排气时间短[WMD(95%CI):-0.21(-0.37~-0.04),P<0.05]。见图5。
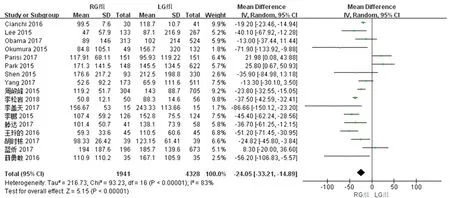
图3 两组术中失血量meta分析结果
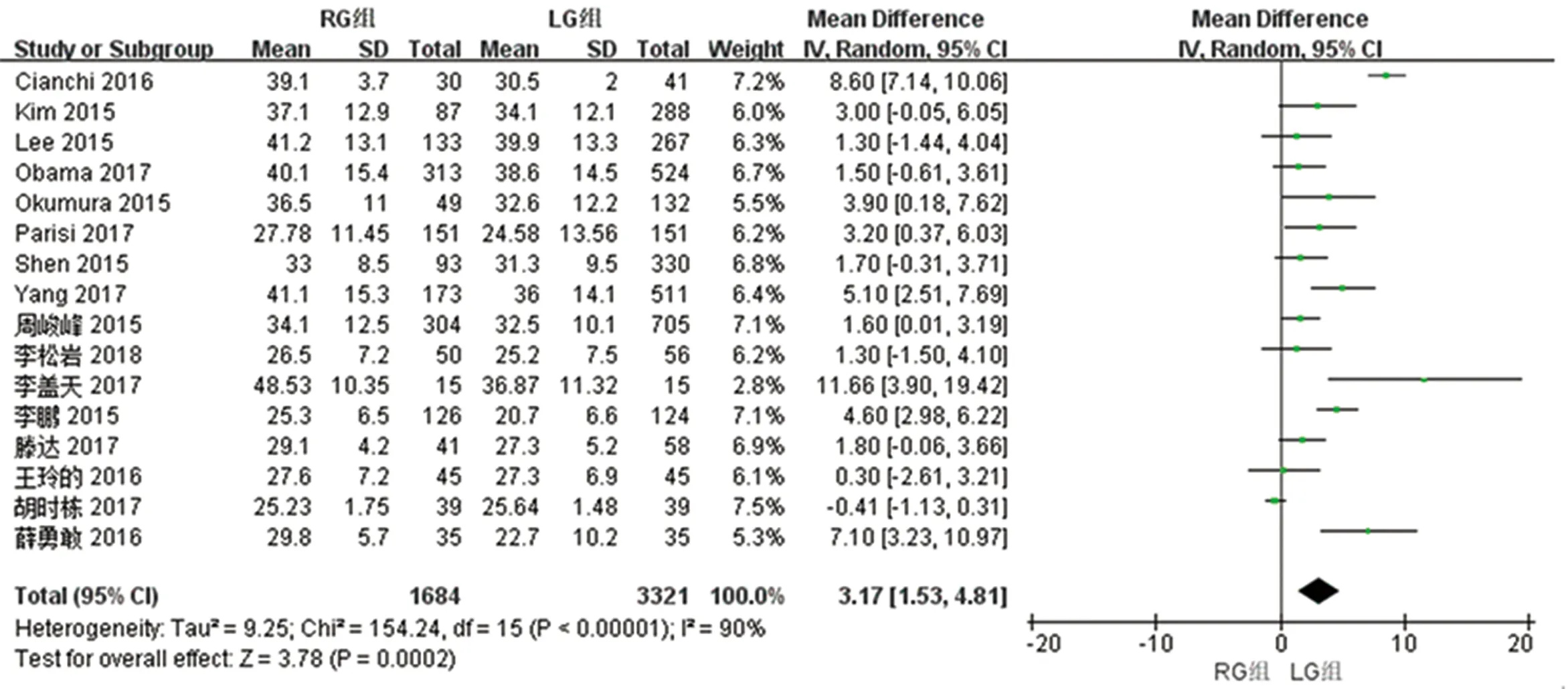
图4 两组清扫淋巴结数量meta分析结果
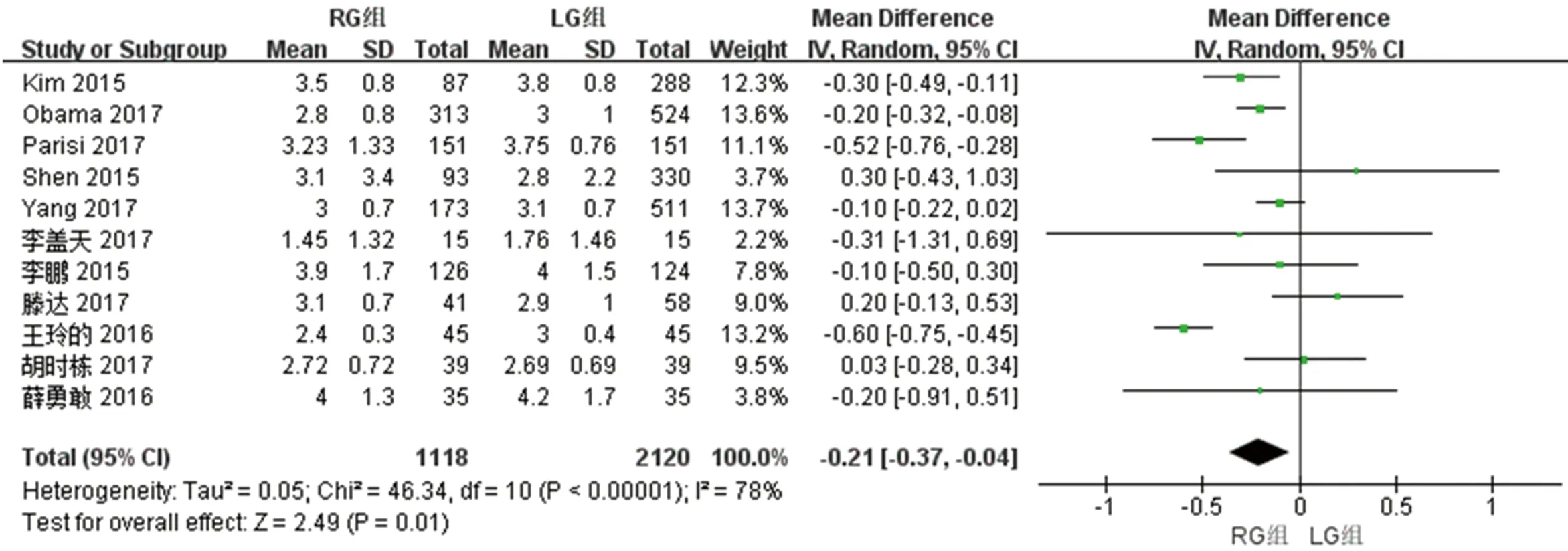
图5 两组术后首次排气时间meta分析结果
2.2.5 两组术后首次进食时间的比较 11篇文献对两组术后首次进食时间进行了比较,检验结果异质性为I2=87%,采用随机效应模型进行统计分析,结果显示,与LG组相比,RG组术后首次进食时间短[WMD(95%CI):-0.26(-0.51~-0.01),P<0.05]。见图6。
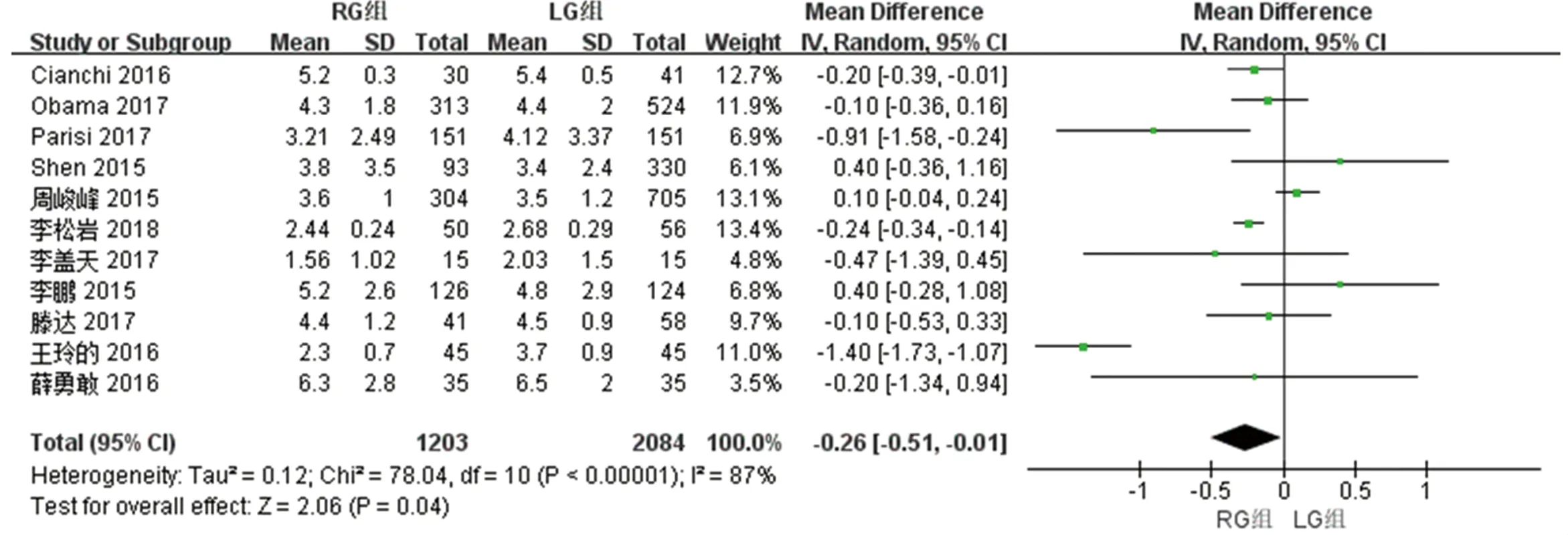
图6 两组术后首次进食时间meta分析结果
2.2.6 两组术后住院时间的比较 15篇文献对两组术后住院时间进行了比较,检验结果异质性为I2=68%,采用随机效应模型进行统计分析,结果显示与LG组相比,RG组术后住院时间短[WMD(95%CI):-0.72 (-1.11~-0.34),P<0.05]。见图7。
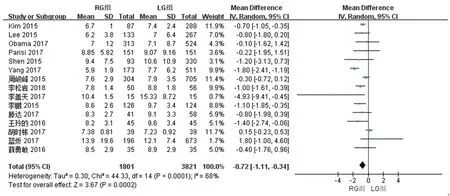
图7 两组术后住院时间meta分析结果
2.2.7 两组术后总并发症的比较 12篇文献对两组术后总并发症进行了比较,检验结果异质性为I2=0,采用固定效应模型进行统计,结果显示与LG组相比,RG组术后总并发症少[OR(95%CI): 0.71(0.55~0.92),P<0.05]。见图8。
2.2.8 两组近端切缘距离的比较 5篇文献对两组近端切缘距离进行了比较,检验结果异质性为I2=38%,采用固定效应模型进行统计分析,结果显示与LG组相比,两组近端切缘距离差异无统计学意义[WMD(95%CI): -0.03(-0.16~0.10),P=0.63]。见图9。
2.2.9 两组远端切缘距离的比较 5篇文献对两组远端切缘距离进行了比较,检验结果异质性为I2=48%,采用固定效应模型进行统计分析,结果显示与LG组相比,两组远端切缘距离差异无统计学意义[WMD(95%CI):0.00(-0.18~0.19),P=0.96]。见图10。
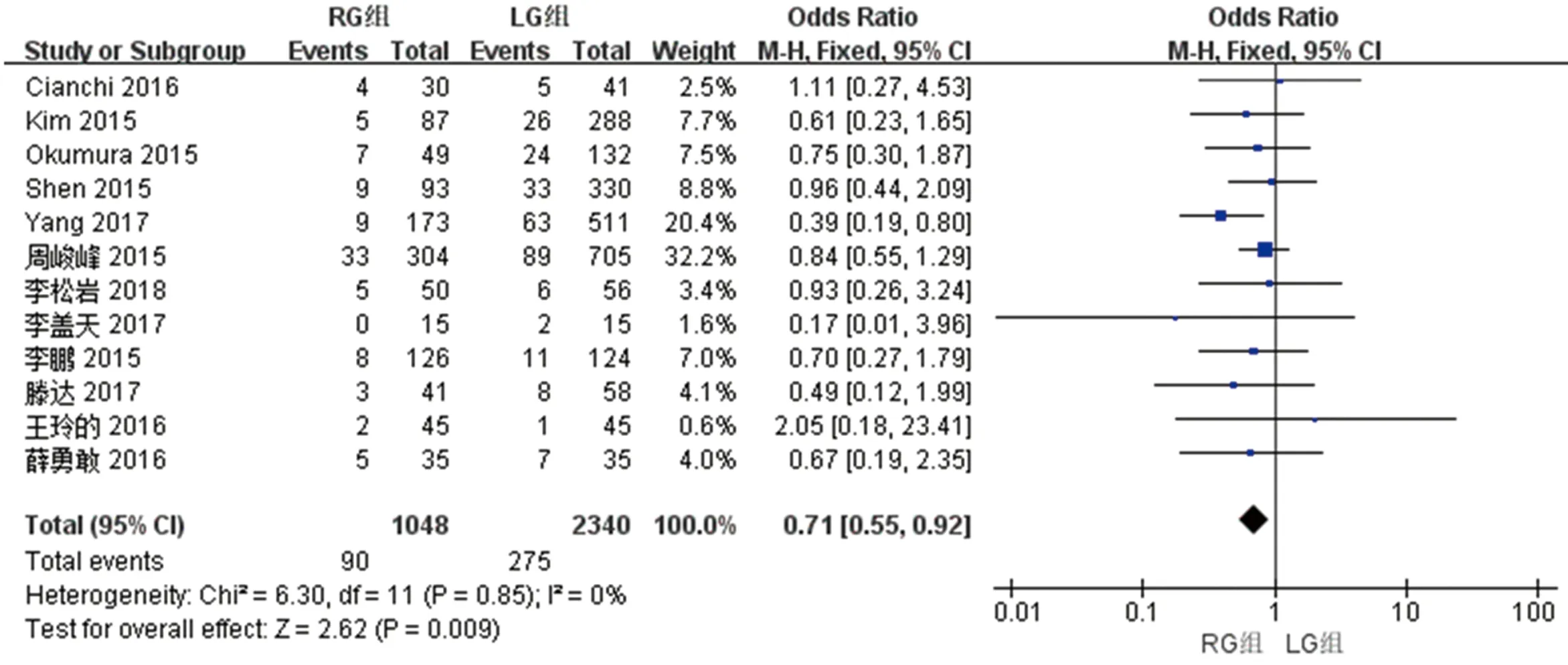
图8 两组术后总并发症meta分析结果
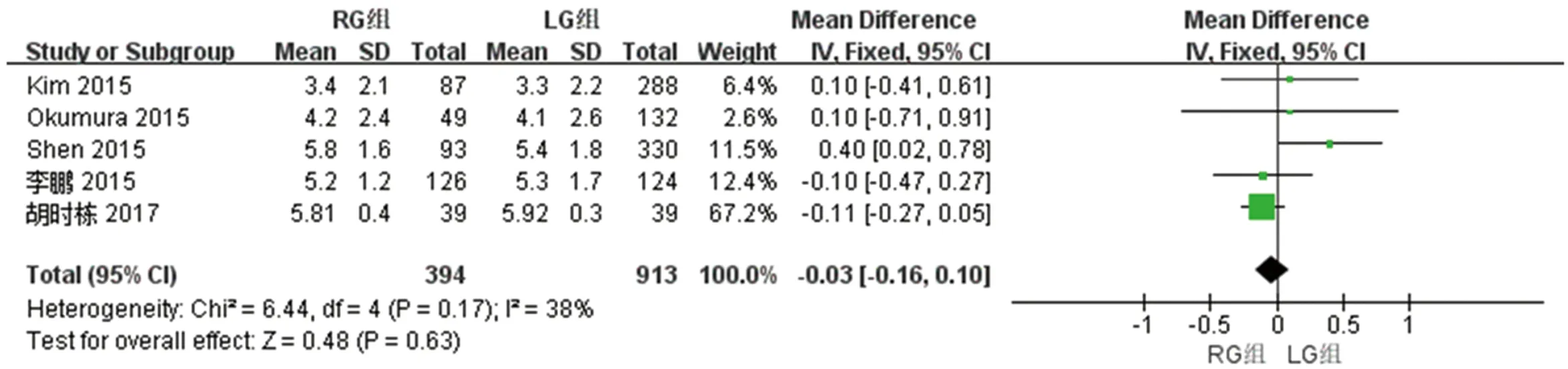
图9 两组近端切缘距离meta分析结果
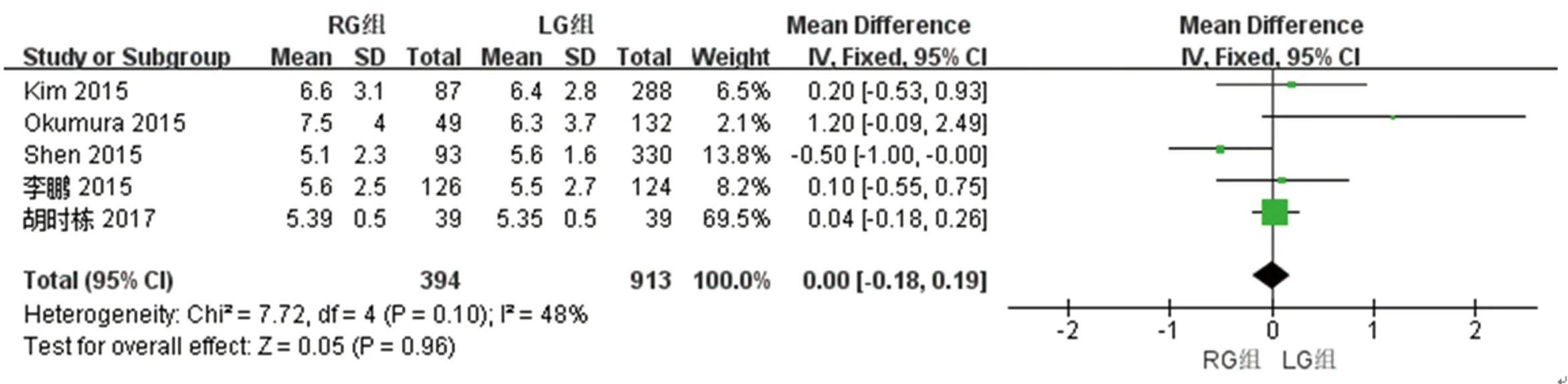
图10 两组远端切缘距离meta分析结果
3 讨 论
胃癌是常见的消化道肿瘤,早期症状不明显,在我国,胃癌早期发现率较低,仅约10%,发现时多已处于中晚期,手术切除仍是治疗胃癌的首选方法。随着微创技术的发展,微创手术已被广泛应用于胃癌的治疗,提高了患者的生活质量,但不同的微创技术在并发症、安全性方面仍存有争议,目前对RG与LG的研究多为非随机的、单中心的研究,因此尚无足够的证据去支持RG广泛应用于临床,需要更多的、前瞻性的对照研究证明RG的安全性与有效性。
本meta分析中,我们选取了18项临床实验对比RG与LG的安全性与并发症。结果显示,与LG相比,RG手术时间更长,第一个原因是机器人手术系统的装备、调试会较腹腔镜系统时间延长;另一个重要因素是RG的学习曲线,Eom等[23]报道,手术时间可能在至少15例病例后稳定下来,然后逐渐缩短,有腹腔镜手术经验的外科医生20例手术后可达到一个平台[24]。但与LG相比,RG术后通气时间、第一次进食时间及住院时间缩短,而影响术后肠功能恢复时间的一个主要因素即为术后炎症反应,Kim等[25]认为,术中器官牵拉是引起术后炎症反应的一个重要因素。由于机器人系统具有灵活的机器臂及清晰的3D影像系统,术中因手颤导致的不必要碰撞、暴露视野的牵拉更少,因而术后炎症反应较轻,术后胃肠功能恢复较快,因此术后通气时间、术后第一次进食时间更短。更早进食能更快地从流质饮食过渡至软食,从而更早地出院,因此术后住院时间相应缩短。
本研究还发现,相较LG,RG具有更少的术中出血量,我们分析这可能因腹腔镜的一些缺陷导致的,如术者体位不适、操作杆不灵活、操作杆引起的手颤放大效应,这些导致清扫淋巴结时可能损伤周围血管,从而引起不必要的出血。由于术中具有更小的损伤,因此RG术后并发症明显减少。此外,机器人具有清晰的三维立体图像,7个自由度关节及放大10倍等优点[26];因此,在淋巴结清扫方面具有腹腔镜无可比拟的优势。对于腹部复杂的解剖结构,可轻易地深入到狭窄腔隙进行精细操作,因而RG能清扫更多的淋巴结,而彻底清扫淋巴结是患者预后的一个重要因素,也是精准判断胃癌分期的一个重要因素。患者预后的另一个重要因素即为肿瘤近、远端切缘,本研究结果显示,两种术式在此方面差异无统计学意义。
虽然我们的研究表明,机器人手术在治疗胃癌方面存在诸多优势,但本研究也存在一定的不足,其中纳入的部分高质量文献中包含Ⅳ期胃癌的病例,尽管胃癌诊疗指南不推荐Ⅳ期胃癌进行手术,但部分Ⅳ期胃癌,如单个可切除的肝脾转移灶,经综合考虑后还是选择手术治疗加化疗结合的方式,因此增加了手术的治疗难度。不同分期的胃癌手术治疗效果采用相同的标准去评价,难免会产生一定的误差,因此如果能在各级分期中分别比较不同手术方式的疗效可能会得到更令人满意的结果。
机器人手术想广泛推广于临床,还有一个不容忽视的问题就是手术费用,昂贵的机器人系统也导致手术费用相应增加,致使很大一部分患者因经济制约而无法选择更好的手术方式;还应考虑的一个问题就是规模较小的医院,由于资金欠缺无法引进更先进的机器人手术系统,加剧了医疗资源的分布不均,导致大医院人满为患,小医院无人问津。
综上所述,RG在治疗胃癌方面是安全、有效的,且与LG治疗胃癌相比,RG在术中出血量、淋巴结清扫数量、术后并发症及住院时间等方面均具有明显优势,应在缩短手术时间、降低手术成本的基础上推广应用。

