白杨素对动脉损伤后新生内膜增生的影响及机制
严 玲 关红菁 朱丽华 唐其柱
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)的异常过度增殖是经皮冠状动脉介入治疗后再狭窄的主要病理机制之一[1]。在促有丝分裂刺激下,如血小板衍生生长因子(platelet derived growth factor, PDGF)-BB或血管损伤状况,多种细胞内信号通路被激活,促进VSMCs异常增殖和再狭窄的发生、发展。这些信号通路包括丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 通路、Janus激酶/信号转导及转录激活蛋白(Janus kinase, JAK/ signal transducer and activator of transcription, STAT)通路等[2~4]。针对于抑制VSMCs增殖以及调节信号通路的药物干预可能成为防治再狭窄的治疗策略。
白杨素(chrysin)又被称为5,7-二羟黄酮(5,7-dihydroxyflavone),是一种可从蜂胶、蜂蜜及多种植物中提取出的天然化合物,具有抗炎/抗氧化、促凋亡/抗肿瘤、扩张血管、降低血脂、改善内皮功能和胰岛素抵抗相关血管并发症等多种药理学效应,近年来其心血管保护作用也倍受重视[5~12]。笔者前期的体外实验显示白杨素可显著抑制PDGF-BB引起的VSMCs表型转换、细胞迁移和异常增殖,然而其对体内小鼠颈动脉损伤后新生内膜增生的作用尚未见报道[13,14]。本研究首次在小鼠动物水平,探讨白杨素对颈动脉导丝损伤后新生内膜增生的抑制效应,并且从JNK和STAT信号通路方面,研究白杨素血管保护作用的可能分子机制。
材料与方法
1.材料:SPF级雄性C57BL/6小鼠购自中国医学科学院医学实验动物研究所;金属导丝(直径0.38mm, No.C-SF-15-15)购于美国Cook公司;白杨素购于美国Sigma公司;抗增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体购于美国Cell Signaling Technology公司;抗总的及磷酸化的JNK和STAT3抗体购于美国Cell Signaling Technology公司;对二甲氨基偶氮苯(3,3′-diaminobenzidine, DAB)试剂盒购于北京中杉金桥生物技术有限公司;Biotinylated Goat Anti-Mouse IgG (H+L)和Horseradish Peroxidase Streptavidin购于美国Vector公司;柠檬酸盐抗原修复溶液(pH值为6.0)购于福州迈新生物技术开发有限公司;PDGF-BB购于美国ProSpec公司;DMEM/F12液及胎牛血清购于美国Gibco公司;Immobilon-FL膜购于美国Millipore公司。
2.颈动脉导丝损伤小鼠动物模型的建立、分组与白杨素处理:参照笔者以往建模方法[15~17],选取10周龄雄性C57BL/6小鼠,腹腔注射戊巴比妥钠 (3%,90mg/kg)以麻醉小鼠,于颈前部正中切口,分离出颈外动脉后将其结扎,继而用血管夹夹闭颈内与颈总动脉,阻断其血流,用显微剪剪开颈外动脉,将金属导丝(直径0.38mm)插入,来回进行5次扭转进退操作以摩擦动脉管壁,导致颈总动脉的损伤,之后将导丝撤出,结扎颈外动脉切口近心端,缝合皮肤。术后小鼠分成模型对照组(Vehicle组)和白杨素组(Chrysin组),模型对照组小鼠喂以正常啮齿类动物饲料,白杨素组小鼠喂以含0.09%白杨素[w/w,如果根据每30g小鼠每天消耗5g饲料计算,相当于150mg/(kg·d)的白杨素给药剂量]的正常啮齿类动物饲料,饲养28天。于术后28天将小鼠处死,分离获取损伤侧的颈动脉,用于检测指标。
3.评价新生内膜形成:4%多聚甲醛固定颈动脉,常规脱水、石蜡包埋、连续切片 (3μm),苏木素-伊红 (HE) 染色评价颈动脉组织形态结构。用Image-Pro Plus 6.0软件分析计算:内膜面积为内弹力板环绕面积与管腔面积的差值,中膜面积为外弹力板与内弹力板环绕面积的差值,内/中膜比值为内膜与中膜面积的比值。
4.PCNA免疫组化:石蜡切片经脱蜡水化,柠檬酸盐抗原修复液高压修复抗原,3%H2O2溶液室温孵育10min,PBS漂洗后加入10%羊血清37℃封闭1h,滴加抗PCNA抗体4℃孵育过夜,PBS漂洗后加入Biotinylated Goat Anti-Mouse IgG (H+L)室温孵育2h,PBS漂洗后加入Horseradish Peroxidase Streptavidin 37℃孵育30min,DAB显色,阳性表达为深褐色,显色完全后用Mayer苏木素复染,脱水透明封片。在显微镜成像系统(BX51FL/DP72, 日本Olympus公司)下观察拍照,用Image-Pro Plus 6.0软件进行图像分析,数据显示为新生内膜内PCNA阳性染色的细胞数目。
5.细胞培养:参照参考文献[13,14],采用酶消化法分离大鼠主动脉平滑肌细胞,培养在DMEM/F12液(10%胎牛血清)里,待VSMCs生长到近融合状态时予以传代。VSMCs的纯度利用细胞形态和α-SMA染色鉴定。实验使用VSMCs为5~12代。
6.细胞周期检测:参照以往方法,见参考文献[14]。碘化丙锭 (propidium iodide, PI) 染色法流式细胞仪测定细胞周期分布状态。VSMCs生长至70%融合时无血清培养24h。12.5μmol/L白杨素预处理1h后,加入PDGF-BB (20ng/ml)刺激24h。胰酶消化VSMCs,70%乙醇固定过夜,800r/min离心10min,收集细胞将其重悬于1ml的PI染色液(含20μg/ml PI和50μg/ml RNaseA)中,避光孵育30min,流式细胞仪检测各时期的细胞百分比。
7.Western blot法检测:同以往方法,见参考文献[13,14]。VSMCs接种至6cm培养皿中,待生长至70%~80%融合时换无血清继续培养24h。12.5μmol/L白杨素预处理2h后,给予PDGF-BB(20ng/ml)刺激相应的时间。VSMCs用含蛋白酶抑制剂Complete及磷酸酶抑制剂PhosSTOP的细胞裂解溶液裂解,12000r/min离心20min,取上清,BCA法测定蛋白质浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白(上样量为20μg蛋白/样本),随后转印至Immobilon-FL膜上。TBST洗膜液封闭1h,加不同的一抗,4℃孵育过夜,之后加IRDye®800CW标记的二抗,室温孵育1h,Odyssey Imaging System (Li-COR)获取荧光信号。

结 果
1.白杨素遏制颈动脉损伤后新生内膜增生:本实验12只小鼠术后均存活,Vehicle组有1只形成血栓未纳入分析。颈动脉HE染色显示,Vehicle组术后28天新生内膜形成非常明显,而Chrysin组新生内膜增生较模型对照组明显减轻。形态学数据分析显示,与Vehicle组比较,Chrysin组的内膜面积和内膜中膜比值均显著降低,分别为Vehicle组的59.91%和56.04%,差异均有统计学意义 (图1)。
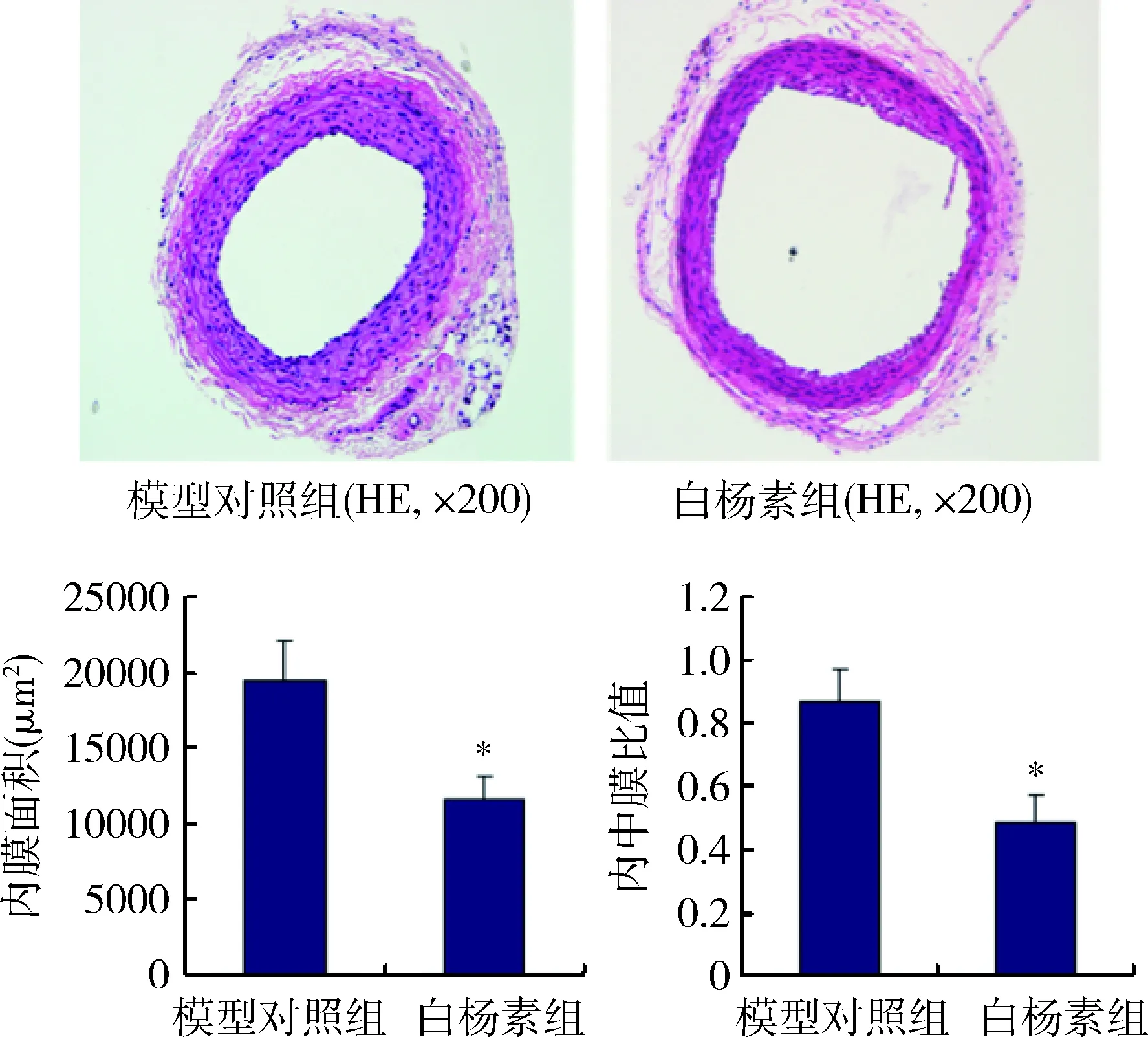
图1 白杨素遏制颈动脉损伤后新生内膜增生与模型对照组比较,*P<0.05
2.白杨素遏制新生内膜细胞增殖:颈动脉免疫组化染色显示术后28天 Chrysin组PCNA阳性细胞表达数较Vehicle组显著减少, 阳性细胞数仅为Vehicle组的67.93% (图2),白杨素可显著遏制颈动脉损伤后新生内膜内VSMCs增殖,从而减轻新生内膜增生。
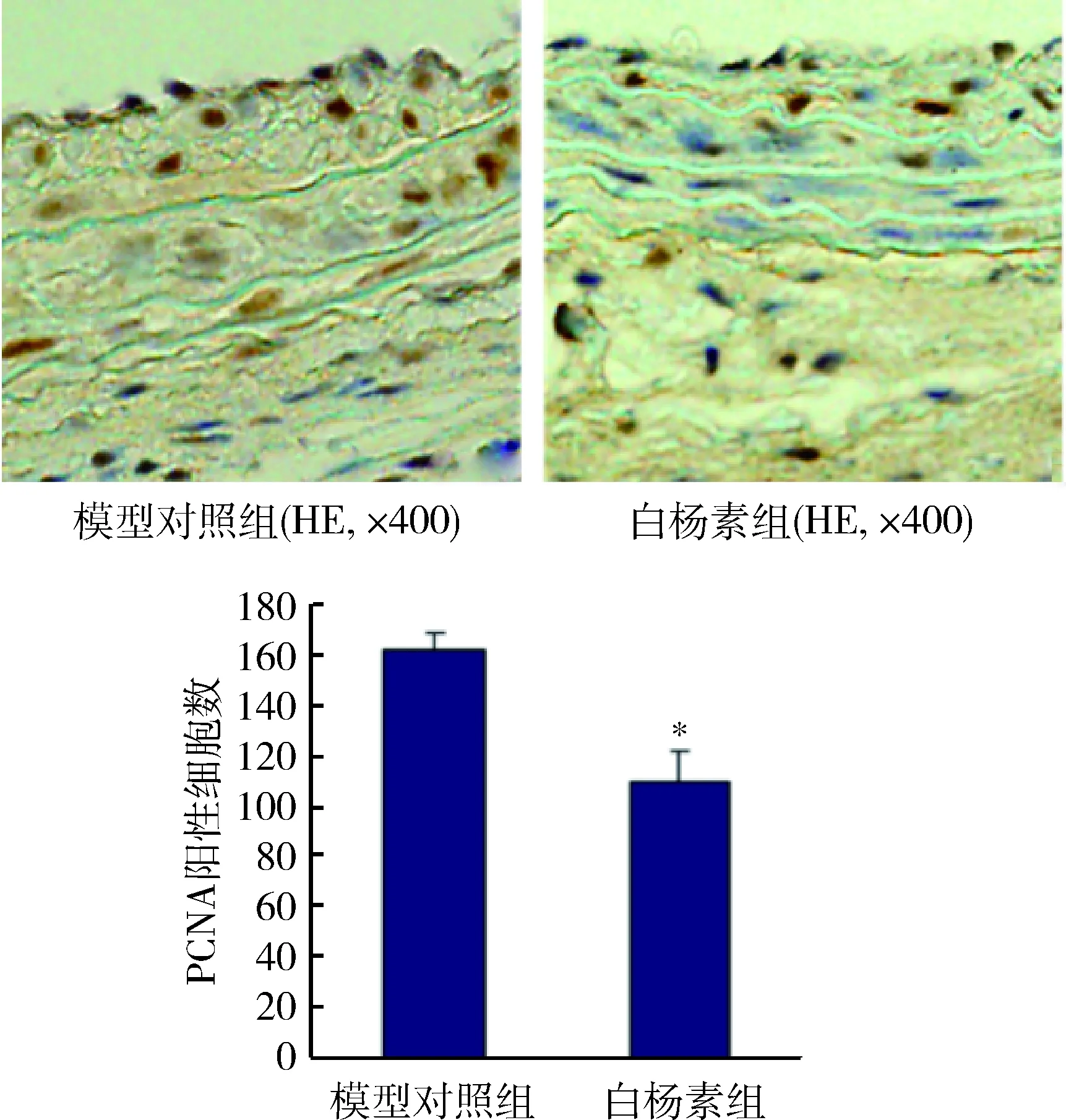
图2 白杨素对新生内膜内PCNA表达的影响与模型对照组比较,*P<0.05
3.白杨素对PDGF-BB处理的VSMCs细胞周期的作用:各组别的细胞周期分布代表图参见图3。PDGF-BB刺激VSMCs 24h使G0/G1期细胞占比显著低于模型对照组,而S期细胞占比明显高于模型对照组。白杨素预处理显著抑制PDGF-BB刺激的VSMCs增殖周期变化,使G0/G1期细胞比例显著升高,而G2/M期细胞比例显著降低(表1)。
4.白杨素对PDGF-BB引起的VSMCs中JNK磷酸化的作用:Western blot法检测结果显示20ng/ml PDGF-BB作用15min后显著升高VSMCs中JNK的磷酸化表达水平,然而12.5μmol/L白杨素预处理几乎完全抑制PDGF-BB引起的JNK磷酸化,PDGF-BB和白杨素对JNK总蛋白水平没有明显影响(图4)。
5.白杨素对PDGF-BB引起的VSMCs中STAT3磷酸化的作用:Western blot法检测结果显示PDGF-BB作用15min后STAT3即发生显著磷酸化,并持续到30min,而白杨素预处理显著降低PDGF-BB对STAT3的磷酸化,PDGF-BB和白杨素对STAT3的总蛋白表达水平没有显著影响(图4)。

图3 流式细胞术分析各组别的细胞周期分布
表1 白杨素对PDGF-BB处理的VSMCs细胞周期分布的作用
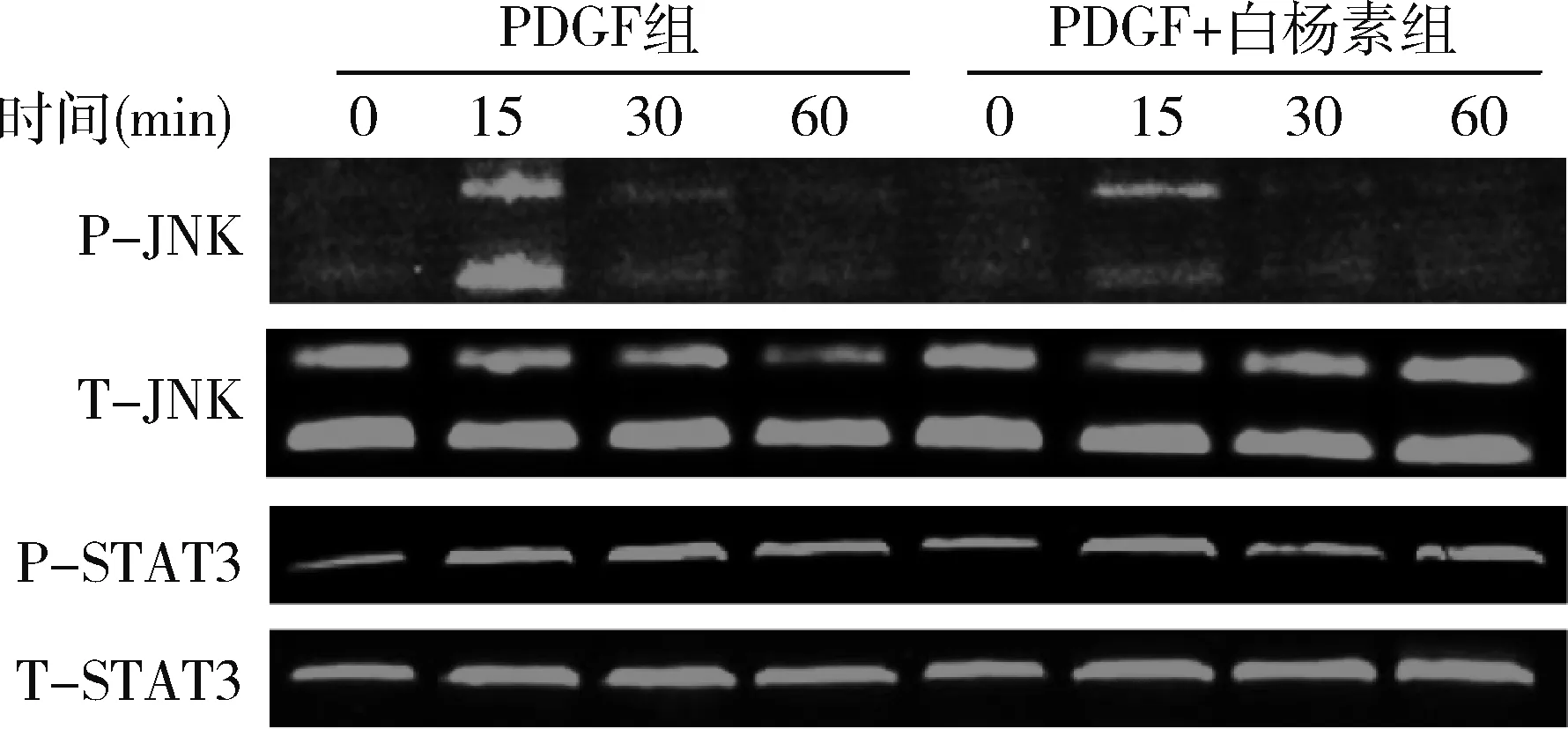
图4 白杨素对PDGF-BB引起的VSMCs中JNK和STAT3信号通路活化的作用
讨 论
VSMCs表型转换、迁移和异常增殖参与了动脉损伤后新生内膜增生的发生发展。笔者前期研究发现白杨素预处理能阻止PDGF-BB引起的VSMCs收缩表型向合成表型转换,并显著抑制PDGF-BB引起的VSMCs迁移[13]。同时,笔者还发现白杨素明显抑制PDGF-BB引起的VSMCs增殖与DNA合成[14]。这些体外研究结果促使进一步探讨白杨素对体内颈动脉损伤后新生内膜增生的作用。本研究利用前期建立的成熟稳定的小鼠颈动脉导丝损伤模型,首次发现口服给予白杨素可显著抑制新生内膜增生,并明显降低新生内膜中PCNA阳性细胞表达数[15~17]。该体内实验结果又进一步验证了前期体外实验结果,强有力地支持白杨素对损伤诱导的血管重构的保护效应。
白杨素抑制动脉损伤后新生内膜增生的详细机制尚未完全阐明。鉴于VSMCs异常增殖加速新生内膜增生,而PDGF-BB能强效刺激VSMCs增殖,本实验利用体外PDGF-BB诱导VSMCs增殖细胞模型进一步探寻白杨素血管保护作用的可能分子机制。与前期研究一致的是,流式细胞术分析显示白杨素预处理使PDGF-BB引起的VSMCs增殖停滞在G0/G1期,从而遏制VSMCs增殖[14]。既往研究显示,JNK通路和STAT3通路的活化与VSMCs异常增殖和新生内膜形成密切相关[2~4]。
本实验随后测定了白杨素对上述信号蛋白的影响,结果显示,在体外培养的VSMCs中,20ng/ml PDGF-BB刺激诱导JNK和STAT3快速磷酸化,而12.5μmol/L白杨素预处理显著抑制PDGF-BB对JNK和STAT3的磷酸化。该结果提示白杨素抑制PDGF-BB引起的VSMCs增殖的分子机制可能与其减弱JNK和STAT3活化相关。Lee等[18]报道白杨素在人成巨核细胞性白血病MO7e细胞中可抑制干细胞因子诱导的STAT3活化,Lin等[19]报道白杨素还能在人脐静脉内皮细胞中抑制白介素-6诱导的STAT3活化,这些结果从一定程度上验证了本研究的可靠性。然而,白杨素究竟通过哪种具体的上游信号分子同时对JNK通路和STAT3通路发挥抑制效应,尚待进一步深入研究。白杨素抑制动脉损伤后新生内膜形成是否与其抑制JNK和STAT3通路活化有直接因果关系还有待进一步动物实验研究证实。
综上所述,本研究结果证实白杨素可能经由抑制JNK通路和STAT3通路活化,阻止血管平滑肌细胞异常过度增殖,从而减轻动脉损伤后的新生内膜增生。白杨素有望成为经皮冠状动脉介入治疗后再狭窄的有效防治药物。

