睡美人转座酶对小鼠肝内胆管癌动物模型成瘤率的影响
周万飞,黄银久,秦中强,谈 燚△
(1.蚌埠医学院第一附属医院肝胆外科,安徽蚌埠 233000;2.蚌埠医学院生物科学系,安徽蚌埠 233000)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是一种胆管上皮源性的、高度恶性的肿瘤[1]。在世界范围内ICC作为肝胆系统第2常见的原发性恶性肿瘤,其发病率与病死率在我国持续增高[2]。到目前为止,根治性手术切除是ICC惟一有效的方法。
研究ICC的发病机制及病理改变的前提是建立ICC的动物模型。迄今为止,构建ICC动物模型的方法为化学方法或通过肝内直接注射肿瘤细胞的方法,如以氨基比林和亚硝酸钠溶液作为叙利亚地鼠的饮用水,每周饮用6 d,连续饮用24周,可诱发ICC,成癌率50%[3]。ZENDER等[4]研究发现利用含有致癌基因的慢病毒感染肝祖细胞,之后注射进小鼠肝脏内,8周后诱发ICC,成癌率70%。但是以上两种方法用时长,成癌率低。BIAO等[5]研究表明,应用水流动力学质粒转染方法将两种质粒NICD1和myr-AKT通过尾静脉注射到体内可诱导ICC的发生,但是此方法无法稳定高效地建立起ICC模型。有文献报道睡美人(sleeping beauty,SB) 转座酶结合水流动力学转染方法可以使靶基因在肝脏中长期稳定表达[6-7]。本研究应用水流动力学方法并结合SB100或SB13将NICD1和myr-AKT质粒注射到小鼠体内,诱导ICC形成,进而比较两种转座酶对成瘤率的影响,为研究ICC做好前期实验基础,现报道如下。
1 材料与方法
1.1实验动物 健康昆明小鼠80只,6~8周龄,体质量20~24 g,采购自蚌埠医学院实验动物中心[动物许可证号:SCXK(苏)2017-0001;合格证编号:NO.201723468]。
1.2试剂 无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司(Lot:Q5331),Anti-HA tag山羊单克隆抗体(Lot:CR138965-1)及Anti-Cytokeratin19 兔单克隆抗体(Lot:GR1234768-1)购自英国abcam公司;驴抗山羊IgG Alexa Fluor 488®Polyclonal(Lot:211346)及驴抗兔IgG Alexa Fluor 594®Polyclonal(Lot:134523)购自美国Jackson公司。诱癌质粒:pT3-EF1a-NICD1,pT3-myr-AKT-HA(human AKT1),C-luc-SB13,pCMV(CAT)T7-SB100由英国addgene公司馈赠。
1.3方法
1.3.1ICC模型的构建 将实验小鼠分为4组,每组20只。A组小鼠通过尾静脉注射pT3-mry-AKT-HA和pT3-EF1a-NICD1质粒联合SB100。B组小鼠通过尾静脉注射pT3-mry-AKT-HA和pT3-EF1a-NICD1质粒联合SB13。C组小鼠通过尾静脉注射pT3-mry-AKT-HA和pT3-EF1a-NICD1质粒。D组小鼠通过尾静脉注射生理盐水。用无内毒素质粒大提试剂盒提取pT3-EF1a-NICD1、pT3-myr-AKT-HA、SB100、SB13 4种质粒。在A组中3种质粒分别取25 μg与2 mL的0.9% NaCl溶液充分混合,通过尾静脉在7 s内将含有此3种质粒的0.9% NaCl溶液注射入小鼠体内;B组和C组用上述同种方法将含有质粒的溶液注射入小鼠体内;D组用上述同种方法将等量0.9% NaCl注射入小鼠体内。在实验期间,小鼠正常投喂饲料,随意饮水。观察4组小鼠生长情况,体质量变化,精神食欲等变化。4周后小鼠全部处死。
1.3.2组织病理学检测ICC 将实验组中ICC组织和对照组中正常肝组织取出,用4%多聚甲醛固定,常规石蜡包埋,之后用病理组织切片机制成10 μm的连续石蜡切片。然后将切片用苏木素-伊红(HE)染色,在光镜下观察。
1.3.3采用免疫组织化学SP法检测ICC 将石蜡组织块切成5 μm厚切片,于二甲苯中脱蜡2次,水化,自来水冲洗。柠檬酸缓冲液93 ℃抗原修复30 min后,室温下驴血清封闭30 min后磷酸盐缓冲溶液(PBS)洗3次。除去PBS后,滴加一抗(1∶200稀释),孵化4 ℃过夜,PBS冲洗3次,每次5 min。滴加反应增强液,室温下孵育30 min,PBS冲洗3次,每次5 min。滴加抗兔/山羊IgG聚合物,室温下孵育30 min,PBS冲洗3次,每次5 min。滴加新鲜配制的3,3-二氨基联苯胺(DAB)显色试剂显色。自来水充分冲洗,苏木素复染,PBS返蓝,乙醇脱水,二甲苯透明,中性树胶封固。以细胞质和(或) 细胞膜上见到棕黄色颗粒分布为阳性。采用半定量方法进行判断:无着色细胞为阴性,着色细胞小于30%为“+”(阳性),着色细胞30%~60%为“++”(中等阳性),着色细胞大于60%为“+++”(强阳性)。选择 5个400倍视野,计数每个视野100个瘤细胞中CK19或者HA阳性细胞数。
1.4统计学处理 采用SPSS20.0 软件进行数据分析,计数资料以频数或百分率表示,比较采用Fisher精确概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1诱癌质粒提取结果 使用酶标仪测4种质粒浓度均在1 μg/μL以上,A260/A280在1.8~2.0。分别取1 μL诱癌质粒上样1%凝胶电泳,见图1。

M:takara DL10000 DNA Marker;1:pT3-myr-AKT-HA;2:pT3-EF1a-NICD1;3:pCMV(CAT)T7-SB100;4:C-luc-SB13
图1 4种诱癌质粒的DNA凝胶电泳
2.2小鼠ICC发生情况 A、B组小鼠在实验期间均未发生死亡,随着实验时间的延长,实验组小鼠逐渐出现精神萎靡,食欲减退,体质量减轻,毛发失去光泽,部分呈现出嗜睡状态。A组中有7只腹水明显,B组中有4只腹水明显,而对照组精神食欲正常,体质量无明显变化。4周后处死全部小鼠,对照组肝脏无
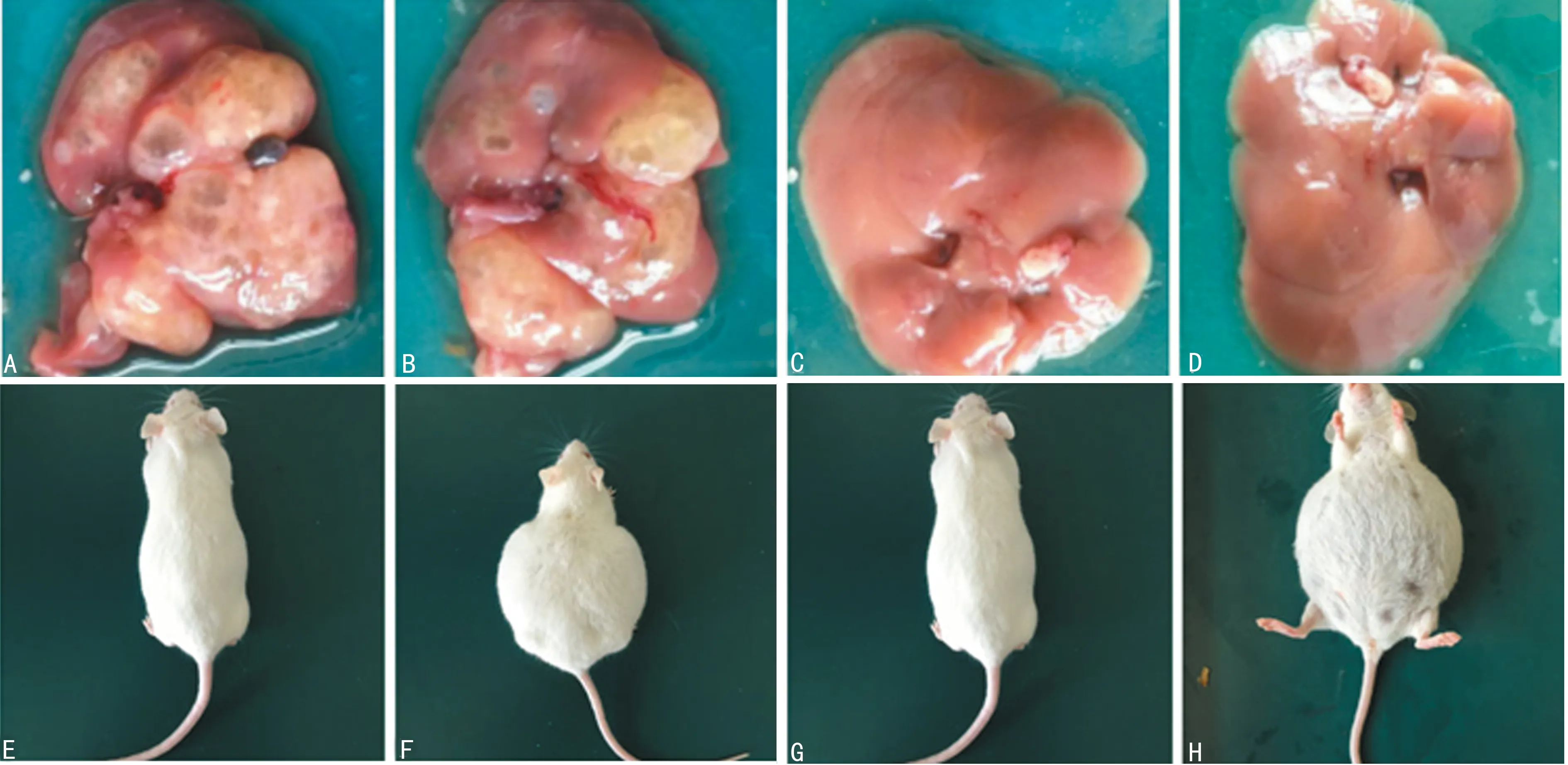
A:A组小鼠肿瘤生长情况;B:B组小鼠肿瘤生长情况;C:C组小鼠肿瘤生长情况;D:D组小鼠肿瘤生长情;E:C组小鼠腹水情况;F:A组小鼠腹水情况;G:D组小鼠腹水情况;H:B组小鼠腹水情况
图2 ICC病理及小鼠腹水情况
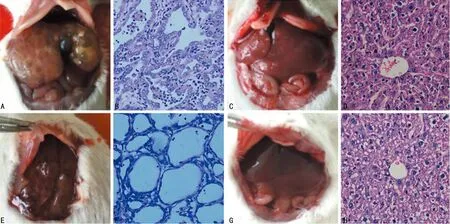
A:A组肝脏组织呈多灶囊泡状改变;B:A组肝脏组织镜下形态;C:C组肝脏组织表面光滑未见异常改变;D:C组肝脏组织镜下形态;E:B组肝脏组织呈多灶囊泡状改变;F:B组肝脏组织镜下形态;G:D组肝脏组织表面光滑未见异常改变;H:D组肝脏组织镜下形态
图3小鼠ICC肿瘤组织标本及石蜡切片(HE,×400)
明显变化。A组小鼠全部成癌,成癌率100%,B组小鼠中14只成癌,成癌率70%,两组成癌率比较,差异有统计学意义(P<0.05)。肝脏表面可见多结节状肿块,切面灰白质脆,呈鱼肉状,伴多囊形成,囊径0.4~1.0 cm,内含清亮液体,见图2。
2.3组织病理学变化 经HE染色镜下实验组肿瘤组织呈弥漫性生长,部分呈小片状分布,累犯周边肝小叶。肿瘤组织中可见形状不规则的腺管样结构,部分呈乳头状生长。瘤细胞形状不一,大小不等,多呈低柱状或立方状单层排列,部分细胞呈复层排列。细胞核大,深染,部分可见核分裂。胞质少,染色深。局部瘤细胞间质血管丰富,肿瘤间质及腺管样结构内可见炎性细胞浸润。肿瘤周围部分血管充血淤血明显。胃、胰腺、肾等器官未见肿瘤转移。对照组细胞结构完整,核型一致,见图3。
2.4免疫组织化学结果 CK19免疫组织化学定位于细胞质,A组中ICC瘤细胞45%(9/20)中等阳性表达,55%(11/20)强阳性表达;B组中ICC瘤细胞40%(8/20)中等阳性表达,60%(12/20)强阳性表达;C组、D组无阳性表达。AKT-HA定位于细胞质及细胞膜,A组中ICC瘤细胞60%(12/20)强阳性表达,40%(8/20)中等强阳性表达;B组中ICC瘤细胞35%(7/20)中等阳性表达,65%(13/20)强阳性表达;C组、D组中无阳性表达,见图4。
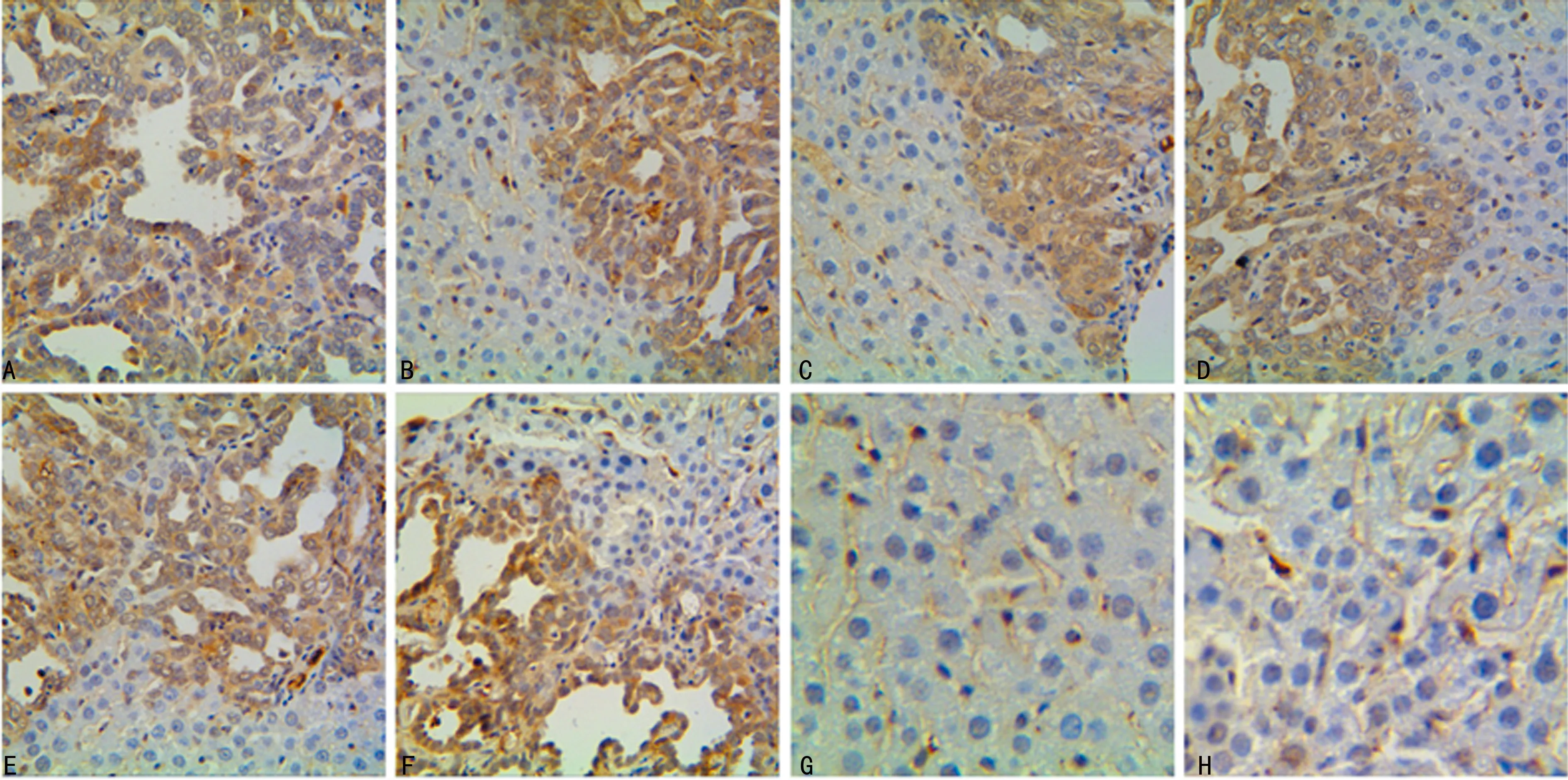
A:A组 ICC肝脏组织CK19蛋白表达于肿瘤细胞细胞质中显示是胆管细胞分化;B:A组 ICC肝脏组织中HA蛋白表达于肿瘤细胞细胞膜、细胞质;C:B组肝脏组织中CK19蛋白表达于肿瘤细胞细胞质中显示是胆管细胞分化;D:B组肝脏组织中HA蛋白表达于肿瘤细胞细胞膜、细胞质;E:C组肝脏组织中CK19免疫组织化学表达阴性;F:C组肝脏组织中HA免疫组织化学表达阴性;G:D组肝脏组织中CK19免疫组织化学表达阴性;H:D组肝脏组织中HA免疫组织化学表达阴性
图4小鼠ICC实验组及对照组免疫组织化学结果(×400)
3 讨 论
EVERT等[8]研究发现单独激活Notch信号通路虽然可以单独促进ICC的发展,但周期较长,一般为20~25周。ZENDER等[9]发现Notch信号通路和AKT信号通路在ICC形成和发展中具有重要作用,二者结合可以加速ICC发展。水流动力学质粒转染方法是一种全新的体内基因转移技术。ZHANG等[10]认为,水流动力学注射是一个物理过程,肝内皮细胞窗在高压情况下增大,导致肝细胞膜产生了孔隙,从而质粒DNA可通过孔隙进入肝细胞。BIAO等[5]利用表达NICD1的转座子诱导小鼠ICC的形成,其周期为5个月。AMMRA等[11]发现SB转座酶是第1个可以在脊椎动物细胞中进行基因转移的转座子,并且支持脊椎动物全面遗传工程,包括转基因、插入突变和治疗性体细胞基因。HUDECEK等[6]发现SB转座酶结合水流动力学转染方法可以使靶基因在肝脏中长期稳定表达。因此本研究利用水流动力学质粒转染方法,将诱癌质粒pT3-myr-AKT-HA (humanAKT1)、pT3-EF1a-NICD1,分别与SB100和SB13混合后通过尾静脉快速注射入小鼠体内,建立ICC模型。以此来观察结合两种转座酶后对ICC模型成瘤率的影响。实验发现结合SB100的成瘤率高于SB13。对于未结合SB转座酶的C组,与文献报道一致[9],D组无明显异常改变。
综上所述,利用水流动力学质粒转染法并结合SB转座酶构建小鼠ICC动物模型具有以下优点:(1)操作简单,成瘤概率高,可以大量制备ICC动物模型。(2)癌变过程与人类ICC发生相似,可以用于ICC发病机制,病因和治疗的研究。(3)由于是无创操作,实验动物耐受性好,病死率低,实用性强。本实验充分比较了两种SB转座酶对于构建ICC模型的影响,结果表明SB100在成瘤率上显著优于SB13。

