低频脉冲电磁场对大鼠成骨细胞骨形成的影响及作用机制
王媛媛,葸慧荣,石文贵,周 建,陈克明
中国人民解放军联勤保障部队第九四○医院骨科研究所,兰州 730050
低频脉冲电磁场(pulsed electromagnetic fields,PEMFs)近年来已被广泛应用于治疗各种骨骼疾病,特别是骨折和骨关节炎[1],但其作用机制尚不明确。研究表明,50 Hz、0.6 mT的PEMFs可通过Wnt、骨形态发生蛋白(bone morphogenic protein,BMP)等信号通路刺激成骨细胞的成熟和矿化[2- 3],也可提高实验动物的骨密度和骨生物力学性能[4],减缓骨量丢失[5],增加骨质疏松症患者的骨矿盐沉积[6]。此外,临床研究进一步证实,PEMFs可增加人体骨矿物质密度,防止骨质疏松症患者的骨质流失[7- 8]。因此,PEMFs被认为是骨质疏松症最有希望的疗法。
初级纤毛是一类以微管为基础结构的细胞器,其来源于细胞的母中心粒,锚定在细胞膜上,并如“天线”般突出于细胞表面[9]。作为细胞感受器,初级纤毛从环境中接受各种信号,并将信号传导至细胞内引起细胞反应。近期研究表明,许多受体、离子通道转运蛋白及其某些下游分子已经被定位到纤毛上,且电磁场促进骨形成依赖于初级纤毛[10]。本研究观察了PEMFs对大鼠成骨细胞(rat osteoblasts,ROBs)骨形成的影响,探讨了环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/蛋白激酶A(protein kinase A,PKA)/环磷腺苷效应结合蛋白(cAMP response element-binding protein,CREB)信号通路的作用机制。
材料和方法
低频电磁场细胞处理仪由本课题组自行研制,发明专利号:ZL201110423102.0。整套装置由计算机控制模块、数模转化模块、信号放大模块、线圈、磁场传感器和温度传感器组成,可产生正弦波、三角波、方波、脉冲波、锯齿波等不同类型的均匀电磁场,频率5~200 Hz,强度0.0~9.0 mT精确可调。可确保60 mm培养皿内所有细胞受到相同电磁场处理。实验过程中线圈置于细胞培养箱中,通过导线与外部装置连接[11]。
实验动物及材料出生48 h以内的SPF级Wistar大鼠[甘肃省中医药大学动物实验中心,合格证号:SCXK(甘)2004- 0006- 152];α-MEM培养基、Ⅱ型胶原酶、胎牛血清(美国Gibco公司),胰蛋白酶(西安科昊生物工程有限责任公司),磷酸化的蛋白激酶A(P-protein kinase A,p-PKA)抗体、蛋白激酶A(protein kinase A,PKA)抗体,磷酸化的环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,p-CREB)抗体、乙酰化的α-tubulin(美国Abcam公司),β-Actin抗体(美国Bioworld公司),SDS-PAGE凝胶制备试剂盒、4×蛋白上样缓冲液、BCA蛋白浓度测定试剂盒、ECL Plus超敏发光液(北京索莱宝科技有限公司),罗丹明标记的免疫荧光二抗(美国KPL公司),大鼠cAMP ELISA试剂盒(瑞士NY公司);脂质体转染试剂(美国Invitrogen公司),碱性磷酸酶(alkaline phosphatase,ALP)测试盒(南京建成生物工程研究所)。
ROBs分离培养参照文献[11],取出生48 h以内的Wistar大鼠5只,置于75%的酒精中消毒后处死;取颅骨,剪成约2 mm大小的骨碎片,PBS漂洗后置于培养瓶中;加入适量0.25%的胰蛋白酶,37 ℃水浴消化10 min,弃消化液;换用0.1%的Ⅱ型胶原酶37 ℃水浴消化10 min,弃消化液;之后用0.1%的Ⅱ型胶原酶37 ℃水浴消化3次,每次20 min;收集消化液于盛有适量培养液(α-MEM 培养基∶胎牛血清=9∶1)的培养瓶中,200目细胞筛过滤,1000 r/min(r=5 cm)离心5 min;弃上清,细胞沉淀使用培养液重悬,调整密度至×104细胞/ml,接种于90 mm培养皿中,置于37 ℃、5% CO2培养箱中培养;待细胞生长至90%以上融合时,用0.25%的胰蛋白酶消化传代用于实验。
PEMFs处理后ROBs内ALP活性的测定将ROBs用50 Hz 0.6 mT PEMFs每天处理1.5 h,连续处理3、6、9 d后测定其ALP活性,检测方法参照试剂盒说明书,具体为:弃培养基,PBS漂洗3次;加入基质液和缓冲液各250 μl,轻微震荡混匀,37 ℃孵育15 min;加入显色液750 μl,轻微震荡混匀,将其吸出加入96孔板中,520 nm处测定吸光值,根据公式换算得到ALP活性值。
ROBs内cAMP浓度测定将ROBs均匀接种于60 mm培养皿中,待生长至接近融合时置于PEMFs中分别处理0、15、30、60、90、120 min;弃培养液,PBS 清洗 3 次,加入 500 μl RIPA细胞裂解液;收集细胞裂解液并吹打均匀,4 ℃ 12 000 r/min(r=5 cm)离心10 min;取上清,按照 ELISA 试剂盒说明书检测cAMP浓度。
PEMFs处理后ROBs内p-PKA、PKA、p-CREB和CREB蛋白表达的检测采用Western blot法,具体为:将ROBs均匀接种于60 mm培养皿中,待生长至接近融合时用50 Hz 0.6 mT PEMFs分别处理0、15、30、60、90、120 min;弃培养液,PBS 清洗 3 次,加入RIPA蛋白裂解液300 μl,充分裂解细胞;收集细胞裂解液,4 ℃ 12 000 r/min(r=5 cm)离心30 min;收集上清,取20 μl进行蛋白质浓度测定,剩余加入1/3体积的4×蛋白上样缓冲液,沸水浴10 min,待冷却后取20 μg 进行 SDS-PAGE 凝胶电泳。
PEMFs处理后p-CREB核转位情况的观察ROBs爬片培养24 h后,置于50 Hz 0.6 mT PEMFs中分别处理0、15、30、60、90、120 min;4 ℃预冷的 PBS 清洗3次,4%多聚甲醛固定10 min,0.1%的 Triton X- 100 透膜 10 min;BSA 封闭液室温封闭 1 h 后,加入p-PKA一抗(1∶200)、乙酰化的α-tubulin(1∶200),细胞核用DAPI(1∶10 000) 染色,4 ℃过夜;加入罗丹明标记的荧光二抗(1∶200),37 ℃孵育30 min,每步操作后 用4 ℃预冷的 PBS 清洗 3 次,每次 5 min;加入p-CREB一抗(1∶200),封片后置于荧光显微镜下观察。
RNA干扰后ROBs内p-PKA、p-CREB、RUNX2和OSX蛋白表达的检测将siRNA(siRNA- 1:5’-GGAUAUGGGUCCAAGACAUCC- 3’) 与pENTRTM/U6 载体相连后,利用脂质体转入ROB,对照组则转入相应的阴性对照载体,转染24 h后,采用Western blot法检测ROB内p-PKA、p-CREB、RUNX2和OSX蛋白的表达情况。
统计学处理采用SPSS 20.0统计软件,实验数据以均数±标准差表示,组间差异比较采用单因素方差分析,组间多重比较采用LSD法,P<0.05为差异有统计学意义。
结 果
PEMFs处理后ROBs内ALP活性的变化PEMFs处理ROBs 3、6、9 d后,ALP活性值分别为24.356±4.911、37.688±2.151和39.922±5.486,均明显高于相应对照组的18.531±2.401(F=40.172,P=0.0121)、33.675±4.366(F=40.654,P=0.0324)和36.574±1.339(F=44.324,P=0.0134)。
PEMFs处理后ROBs内RUNX2和OSX的变化PEMFs处理30(P=0.0042和P=0.0058)、60(P=0.0097和P=0.0079)、90 min(P=0.0083和P=0.0098)时,ROBs内的RUNX2和OSX活性均显著高于未处理组;处理15(P=0.657和P=0.873)和120 min(P=0.976和P=0.724)时与未处理组差异无统计学意义(图1)。
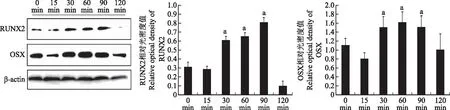
PEMFs:低频脉冲电磁场;RUNX2:骨形成相关因子;OSX:成骨相关转录因子;与0 min相比,aP<0.01
PEMFs:pulsed electromagnetic fields;RUNX2:runt-related transcription factor 2;OSX:osterix;aP<0.01 compared with 0 min
图1PEMFs处理后RUNX2和OSX蛋白表达的变化
Fig1Changes of the protein expressions of RUNX2 and OSX after PEMFs treatment
PEMFs处理后ROBs内cAMP浓度的变化PEMFs处理15 min时,ROBs内cAMP浓度未发生明显变化(P=0.1410);处理30 min后较未处理时明显升高(P=0.0012),持续至60 min时达到峰值(P=0.0035);后开始下降,90 min时下降至与未处理时持平(P=0.0720);120 min时虽较未处理时升高,但差异无统计学意义(P=0.0642)(图2)。
PEMFs处理后ROBs内p-PKA和p-CREB的变化PEMFs处理15(P=0.0018)、30(P=0.0087)、90(P=0.0250)和120 min(P=0.0350)时,ROBs内的p-PKA水平明显高于未处理组;处理60 min时(P=0.673)与未处理组差异无统计学意义。PEMFs处理15(P=0.0075)、30(P=0.0017)、60(P=0.0074)和90 min(P=0.0096)时,ROBs内的p-CREB水平明显高于未处理组;处理120 min时(P=0.745)与未处理组差异无统计学意义(图3)。
PEMFs处理后p-CREB发生核转位PEMFs未处理时,细胞核内很少甚至几乎没有 p-CREB蛋白。PEMFs处理ROBs 15 min后,CREB发生磷酸化并聚集于细胞核内(图4)。
p-PKA与初级纤毛共定位将PKA、p-PKA与初级纤毛共定位染色,结果发现p-PKA定位于初级纤毛上(图5)。
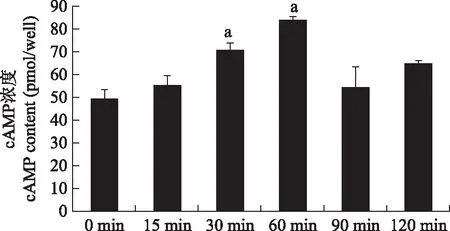
cAMP:环磷酸腺苷;与0 min相比,aP<0.01
cAMP:cyclic adenosine monophosphate;aP<0.01 compared with 0 min
图2PEMFs处理后ROB内cAMP浓度变化
Fig2Changes of cAMP concentrations after PEMFs treatment
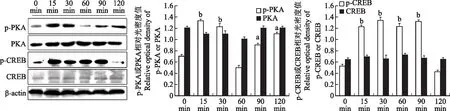
PKA:蛋白激酶A;p-PKA:磷酸化蛋白激酶;CREB:环磷腺苷效应结合蛋白;p-CREB:磷酸化环磷腺苷效应结合蛋白;与0 min相比,aP<0.05,bP<0.01
PKA:protein kinase A;p-PKA:p-protein kinase A;CREB:cAMP-response element binding protein;p-CREB:p-cAMP-response element binding protein;aP<0.05,bP<0.01 compared with 0 min
图3PEMFs处理后ROB内p-PKA和p-CREB蛋白表达的变化
Fig3Changes of the protein expressions of p-PKA and p-CREB after PEMFs treatment

图4PEMFs处理ROB 15 min后的p-CREB核转位结果
Fig4PEMFs-induced nuclear translocation of p-CREB after 15 min of PEMFs treatment

原发性纤毛呈绿色(乙酰化α-tubulin),p-PKA、PKA呈红色,细胞核呈蓝色
Primary cilium is stained green(with acetylated α-tubulin),p-PKA,PKA stained red,and nuclei stained blue
图5ROBs中初级纤毛与p-PKA、PKA共定位结果(DAPI)
Fig5Immunostaining localization of p-PKA in primary cilia of rat calvarial osteoblasts(DAPI)
RNA干扰后ROBs内p-PKA、p-CREB蛋白表达情况RNA 干扰去除初级纤毛后,干扰组的p-PKA(F=78.602,P=0.0270)和p-CREB(F=76.082,P=0.0089)蛋白表达量明显低于未干扰组,PKA(F=40.576,P=0.0832)和CREB(F=54.876,P=0.0991)蛋白表达量与未干扰组相比差异无统计学意义(图6)。
RNA干扰后ROBs内RUNX2和OSX蛋白表达情况RNA干扰去除初级纤毛后,干扰组的RUNX2(F=41.064,P=0.0230)和OSX(F=57.524,P=0.0310)蛋白表达量明显低于未干扰组(图7)。
讨 论
PEMFs在临床上用于骨折愈合已有近50年的历史,多项研究表明,其可以促进骨形成[12- 13]。尽管本课题组研究发现,50 Hz 0.6 mT PEMFs可通过cAMP/PKA促进ROB矿化成熟,但这只是整个信号级联反应的一部分,PEMFs促进骨形成的作用机制至今不明。
ALP活性与骨组织矿化息息相关,是成骨性分化的早期标志。本研究结果显示,PEMFs处理后ROBs内的ALP水平明显升高,且相关成骨性指标的蛋白表达量也明显升高,提示PEMFs能够促进骨形成。本研究还通过检测PEMFs处理后ROBs内cAMP浓度、PKA和CREB磷酸化水平的变化及p-CREB核转位情况发现,经PEMFs处理后,ROBs中cAMP浓度表现出先升高后降低的趋势,PKA、CREB的磷酸化水平均表现出上升趋势,且p-CREB出现短暂的核转位现象,表明PEMFs可能激活了cAMP/PKA/CREB信号通路。
初级纤毛作为突出于成骨细胞表面的信号感受器,可提高成骨细胞从骨基质和骨髓腔中接受机械和化学信号的能力[14]。大量研究表明,初级纤毛上存在许多受体、离子通道蛋白,当初级纤毛感受外界刺激后,将各种信号传递于胞内[15- 17]。本研究将p-PKA定位于初级纤毛上,采用RNA干扰法干扰初级纤毛,结果发现p-PKA和p-CREB蛋白表达量显著降低,成骨相关蛋白RUNX2和OSX蛋白表达量也降低,提示初级纤毛可能在cAMP/PKA/CREB信号通路中发挥重要作用。由于cAMP/PKA/CREB信号通路与 G 蛋白是偶联的,因此,找出PEMFs是通过何种 G 蛋白受体激活了何种 G 蛋白,进一步激活该信号途径来促进骨形成,将是下一步的研究重点。
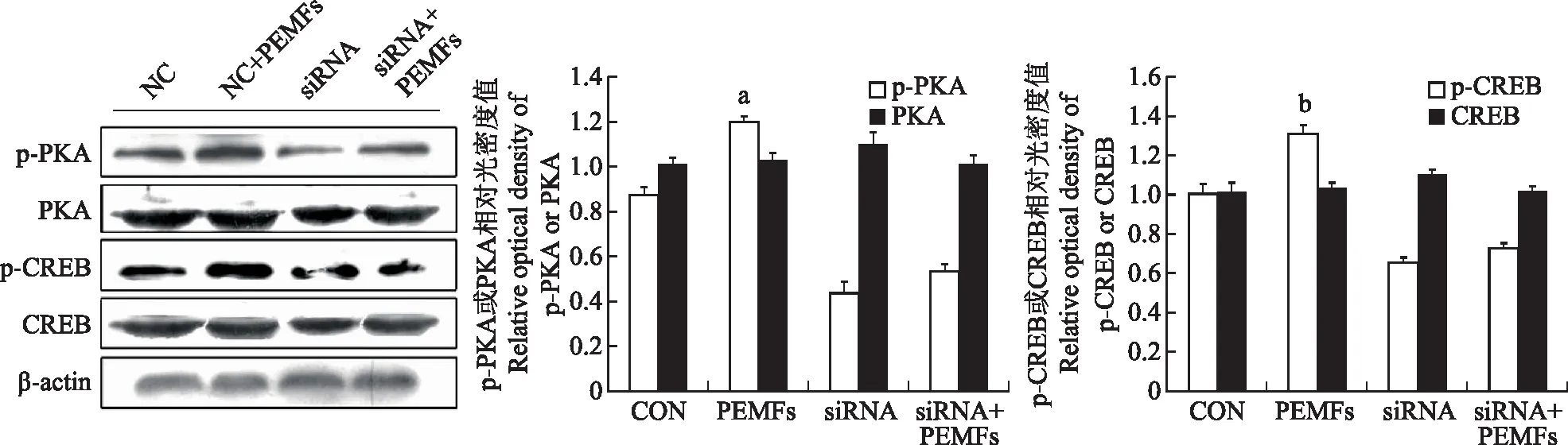
与对照组相比,aP<0.05,bP<0.01
aP<0.05,bP<0.01 compared with control
图6PEMFs处理转染的ROBs后,p-PKA和p-CREB蛋白表达
Fig6Protein expressions of p-PKA and p-CREB in transfected ROBs after PEMFs treatment

与PEMFs组相比,aP<0.05
aP<0.05 compared with PEMFs group
图7PEMFs处理转染的ROBs后,RUNX2和OSX蛋白表达情况
Fig7Protein expressions of RUNX2 and OSX in the transfected ROBs after PEMFs treatment

