口腔癌患者循环外泌体促进舌癌细胞CAL27增殖、迁移、侵袭中的作用
郭怡 彭红 蹇淑娟 陈慧 代喆颖 江玲 李秀臣 崔晓燕
外泌体是由细胞分泌的直径在30~100 nm范围的,表面具有特定分子标记如CD9和CD63的磷脂双分子膜性囊泡[1]。这些囊泡几乎存在于人体所有的体液中,包括血液、血浆/血清、唾液、乳汁、脑脊液、尿液、精液等[2]。外泌体中含有多种物质,如蛋白质、DNA、mRNA、miRNA、LncRNA等[3-4]。这些生物学分子可经外泌体转运到不同细胞中,并对细胞中信号通路和蛋白表达进行调控,从而影响受体细胞的生物学行为[5-7]。最新研究表明,肿瘤来源的外泌体参与到肿瘤细胞与基底细胞的遗传信息的交换,促进了肿瘤的生长、侵袭与转移,并且外泌体在肿瘤耐药中发挥重要作用[8-10]。口腔癌患者外周血中外泌体的水平较正常人明显增高,可能与口腔癌的发展和转移有密切关系[11]。本研究拟在此基础上,探讨口腔癌患者外周血中外泌体在口腔癌发展、侵袭中作用,为口腔癌防治提供新的理论依据。
1 材料与方法
1.1 材料与设备
DMEM-高糖培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、双抗(青霉素+链霉素)、胰蛋白酶(Hyclone公司, 美国);基质胶(BD公司, 美国); RIPA裂解液(9806S)(武汉飞羿科技有限公司); 蛋白上样缓冲液、兔抗人β-actin一抗、羊抗兔二抗、羊抗兔荧光二抗、BCA蛋白定量检测试剂盒、 SDS-PAGE凝胶配置试剂盒、Western blot电泳液、转膜液、DAPI显影剂、定影剂(武汉谷歌生物科技有限公司); ECL化学发光试剂盒(Thermo Fisher公司, 美国); 兔抗人CD9、CD63、Ki67一抗(Sigma公司, 美国); 细胞培养耗材(江苏NEST耐思生物科技有限公司); Transwell小室(Corning公司, 美国); Avanti J-26XP离心机(Beckman Coulter公司, 美国); H-7000FA透射电镜(Hitachi公司, 日本); 蛋白凝胶成像系统(ChemiScope 4300 Pro型, 上海Clinx公司)。
1.2 循环外泌体分离纯化与鉴定
1.2.1 循环外泌体分离纯化 本研究选取2012-01-01~2016-12-31就诊于武汉市第三医院(武汉大学附属同仁医院)口腔科的口腔鳞状细胞癌患者20例。所有患者均经局部组织切取活检术确诊为口腔鳞状细胞癌。本研究符合伦理要求,患者及家属均知情同意。收集每例口腔癌患者外周血5 ml,按下列方法1 次离心: ① 1 500 g离心20 min,收集上清;② 16 500 g离心20 min,再次收集上清;③ 0.2 μm滤器过滤,收集过滤液;④ 120 000 g离心70 min,弃上清,PBS重悬沉淀;⑤ 120 000 g离心70 min,弃上清,以150 μl PBS重悬沉淀,以BCA法测定外泌体蛋白浓度,冻存于-80 ℃备用。
1.2.2 循环外泌体鉴定 分别用透射电镜技术(TEM)、蛋白电泳技术(Western blot)检测离心所得的沉淀,分析沉淀物质的颗粒大小及外泌体标志物的表达。
1.3 细胞培养
人舌癌细胞系(CAL27)购自中国典型培养物保藏中心(武汉)。CAL27细胞培养用含10%FBS的DMEM高糖培养基培养于37 °C,约95%湿度和5% CO2浓度的恒温培养箱,隔天换液,每3 d传代1 次。
1.4 Western blot
以RIPA 裂解液裂解细胞/外泌体后超声震荡 3 次(每次 5~10 s), 12 000 r/min速度离心15 min, 取上清并用BCA蛋白定量检测试剂盒测定蛋白浓度。按所测蛋白浓度计算样品(蛋白上样量为20 μg)和上样缓冲液体积后,将其混合并置于 95 °C 水浴锅中水浴 5 min。配制10% SDS-聚丙烯酰胺凝胶(SDS-PAGE),80 V恒压下蛋白电泳至分离胶与浓缩胶界面时换为 120 V 电压, 然后 200 mA, 2 h 恒流下将蛋白转至 PVDF 膜。封闭 2 h 后,分别以CD9(1∶500)、CD63(1∶1 000)、 p-Rb(1∶1 000)、cyclin D1(1∶1 000)、β-actin(1∶10 000)抗体 4 ℃孵育过夜。TBST 洗膜 3次,每次 10 min。相应二抗室温孵育2 h,TBST 洗膜 3 次,每次10 min。化学发光剂显色后,蛋白凝胶成像系统分析样品中目标蛋白的相对含量。
1.5 透射电镜观察
将PBS重悬的外泌体样品吸附至镍网上,自然风干; 2.5%的戊二醛固定10 min,PBS漂洗3 次;加入CD63抗体20 μl(1∶100)于37 ℃孵育2 h,PBS漂洗3 次,加入金标二抗20 μl(1∶100)于37 ℃孵育1 h,PBS漂洗3 次;醋酸铀负染5 min,以滤纸吸干染液;待样品干燥后置于透射电镜下观察。
1.6 细胞划痕试验
将对数生长期的CAL27细胞以5×105/孔接种于6 孔板中,培养24 h后,用20 μl无菌吸头沿培养孔的正中划一道划痕,PBS轻轻冲洗去除游离细胞,对照组加入正常培养基,实验组另加入终浓度为40 μg/ml循环外泌体。
1.7 Transwell实验
将铺有基质胶的Transwell小室置于24 孔板上,在外室加入500 μl含有40 μg/ml外泌体的完全培养基,小室内加入300 μl无血清培养基垂悬的CAL27细胞悬液(1×106/ml)。培养24 h后,从培养箱中取出Transwell小室,PBS清洗,用棉签擦去上层基质胶和细胞,95%乙醇固定10 min,结晶紫染色10 min,PBS冲洗3 次,显微镜下观察并拍照。
1.8 裸鼠移植瘤实验
将对数生长期的CAL27以PBS重悬,使细胞密度为1×107个/ml。 将200 μl含有CAL27细胞的PBS悬液注射于裸鼠腹侧皮下。待肿瘤长至150 mm3后,随机分为对照组(n=20)和外泌体处理组(n=20),外泌组每隔2 d经尾静脉给予每只裸鼠50 μl循环外泌体(1 mg/ml),PBS组则给予50 μl PBS。外泌体一共注射了5 次,观察期的起点是第一次注射外泌体。每隔2 d观察并测量和记录肿瘤大小,连续观察和测量4 周。肿瘤体积计算公式为:(长×宽×宽)/2。观察期结束后,处死裸鼠,取下肿瘤标本及肺组织,制成石蜡切片进行后续实验。
1.9 免疫荧光实验
切片脱蜡、梯度酒精入水后,滴加适量ki67一抗,37 ℃孵育1 h;PBS洗去抗体;滴加适量对应二抗, 37 ℃避光孵育30 min,PBS洗去抗体;以含DAPI封片剂封片;最后置于荧光显微镜下观察并拍照。
1.10 统计学分析
2 结 果
2.1 口腔癌患者循环外泌体的鉴定
以图 1A所示的程序收集口腔癌患者循环外泌体。透射电镜下,分离所得的沉淀呈双层膜结构,大小范围为20~100 nm,其中50~60 nm的双层膜结构最多(图 1B)。Western blot结果提示,离心分离的沉淀中高表达CD63(图 1C)。免疫电镜结果提示,CD63、CD9表达的位置位于双侧膜结构外膜(图 1D)。表明本研究分离所得的沉淀为外泌体。
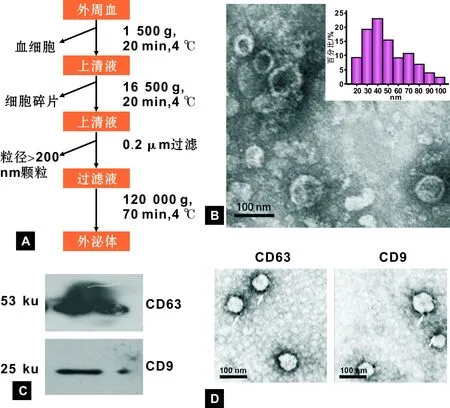
A: 循环外泌体分离步骤; B: 透射电镜下循环外泌体的形态; C: Western blot法检测循环外泌体中CD9和CD63的表达; D: 免疫电镜法检测循环外泌体中CD9和CD63的表达(箭头: 纳米金颗粒)
图 1 口腔癌患者循环外泌体的分离与鉴定
A: Separation procedure of circulating exosomes; B: TEM imag of circulating exosomes; C: The expression of CD9 and CD63 determined with western blot; D: The expression of CD9 and CD63 detected by immune electron microscopy (The white arrows indicate gold nanoparticles)
Fig 1 Isolation and identification of circulating exosomes from oral cancer patients
2.2 口腔癌患者循环外泌体促进口腔癌细胞增殖
将分离纯化的循环外泌体(0~60 mg/L)加入到CAL27细胞中培养72 h,MTT检测循环外泌体对CAL27增殖状态的影响。结果提示,口腔癌患者循环外泌体显著刺激CAL27细胞增殖,且促进增殖的效应与外泌体的浓度有关,即0~40 mg/L时,浓度越高,促增殖效果越强;当大于40 mg/L时,促增殖效应达到平台期(图 2A)。我们进一步检测与细胞周期密切相关的蛋白cylinD1和phospho-Rb在CAL27细胞中的表达,结果提示循环外泌体可上调cylinD1和phospho-Rb的表达(图2B)。
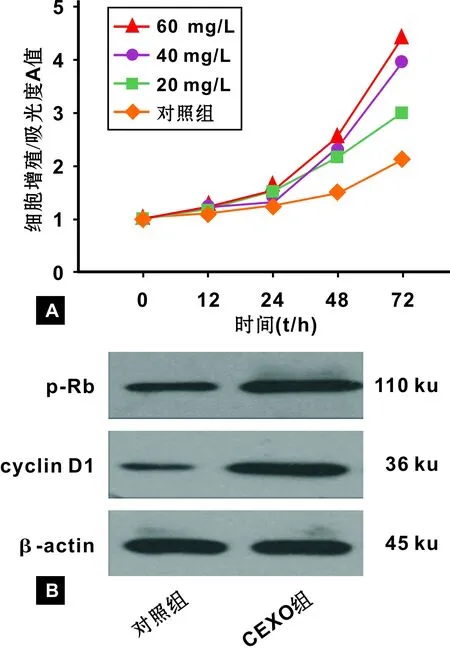
A: 增殖曲线; B: p-Rb和cylin D1的表达图 2 口腔癌患者循环外泌体对CAL27增殖活性的影响A: Growth curves; B: Expression p-Rb and cylin D1Fig 2 Proliferation of CAL27 cells after incubation with circulating exosomes
2.3 口腔癌患者循环外泌体促进口腔癌细胞迁移和侵袭
本研究采用经典的细胞划痕试验来检测口腔癌患者循环外泌体对CAL27细胞迁移能力的影响(图 3A)。细胞划痕试验结果表明:循环外泌体处理组CAL27划痕伤口在24 h基本愈合,而此时对照组划痕伤口尚未愈合,差异有统计学意义(P<0.05)。采用Transwell小室法检测循环外泌体对CAL27细胞侵袭能力的影响(图 3B),12 h和24 h对照组和循环外泌体组穿过基膜的细胞数之间的差异具有统计学意义(P<0.05)。
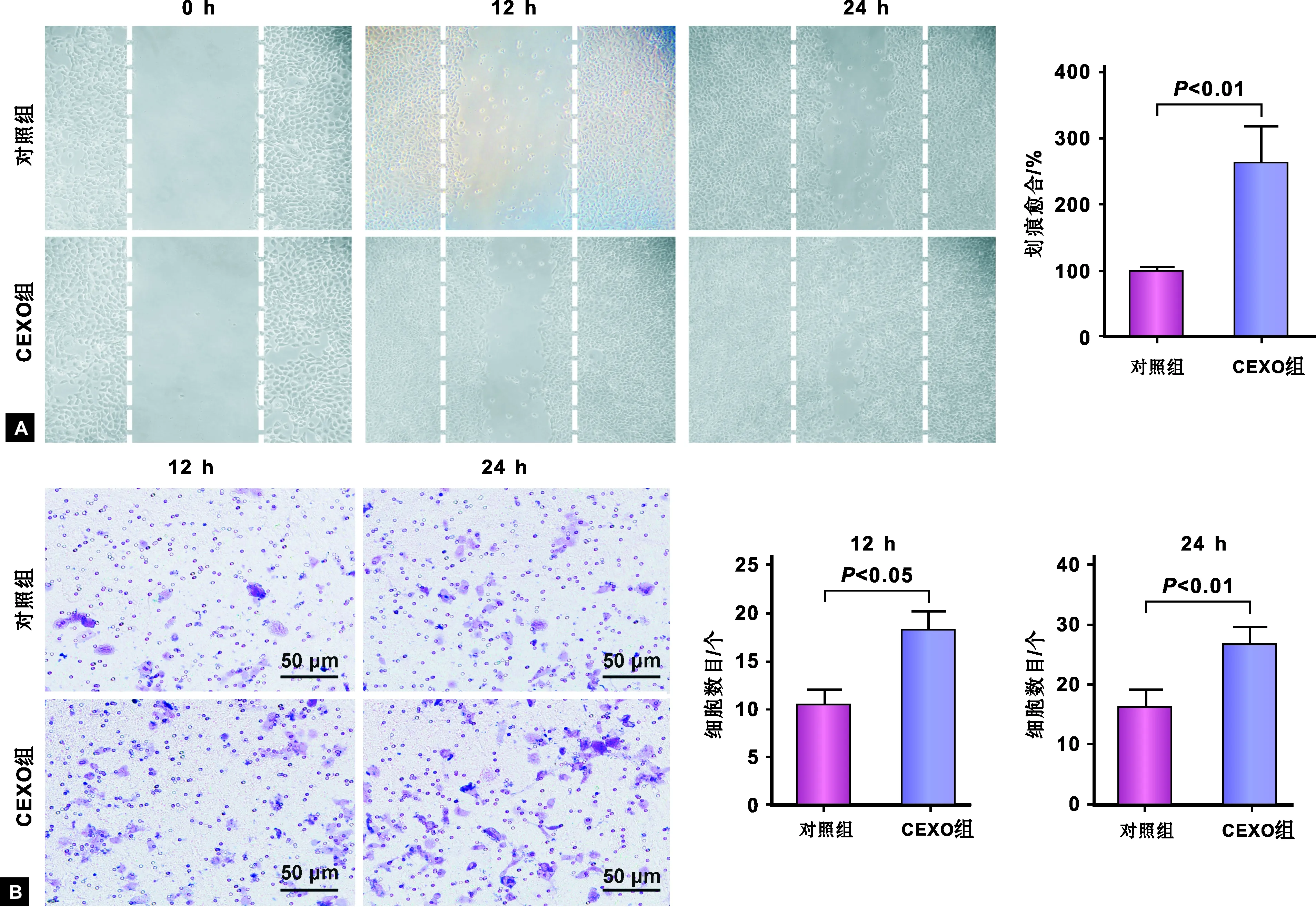
A: CAL27细胞迁移; B: CAL27细胞侵袭图 3 口腔癌患者循环外泌体对CAL27细胞迁移和侵袭能力的影响A: The migration of CAL27 cells; B: The invasion of CAL27 cellsFig 3 The effects of circulating exosomes from oral cancer patients on CAL27 cell migration and invasion
2.4 裸鼠体内环境下口腔癌患者循环外泌体对口腔癌的促进增殖的作用
选择裸鼠动物模型为体内实验模型进行研究。连续观察4 周时,外泌体处理组肿瘤体积明显大于对照组,差异具有统计学意义(P<0.01);肿瘤生长曲线结果提示,外泌组肿瘤生长速度明显快于对照组(图 4A、 4B),差异具有统计学意义(均P<0.05)。将老鼠处死后收获肿瘤组织,并称重,随后固定制成组织切片。外泌体组肿瘤肿瘤组织重量与对照组相比明显增加(图 4C),差异具有统计学意义(P<0.01)。以免疫荧光法检测肿瘤标本中Ki67的表达情况,结果提示外泌体组肿瘤组织中Ki67的表达水平明显高于PBS组(图 4D)。结果表明:口腔癌患者循环外泌体在体内具有促进口腔癌生长的作用。
3 讨 论
细胞源性囊泡根据其大小不同,可分为微粒(microparticles, MPs,直径100~1 000 nm)、外泌体(直径小于100 nm)和凋亡小体(apoptotic bodies,直径大于1 000 nm)三类[12]。外泌体是细胞膜先向内出芽形成胞内多囊泡体,然后多囊泡体再向外与细胞膜融合并释放出的膜性囊泡[13]。与另外2 种囊泡外泌体和凋亡小体相比,外泌体具有独特的生物学特征和功能,并且能从母细胞继承特异性生物信息分子,包括膜抗原、蛋白质[3]。当外泌体在1980 年首次被发现后,其被认为是细胞排泄废物的一种方式,如今随着大量对其生物来源、其物质构成及运输、细胞间信号的传导以及在体液中的分布的研究发现,外泌体具有多种多样的功能[14]。外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等方方面面。有研究表明,肿瘤来源的外泌体参与到肿瘤细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了肿瘤的生长与侵袭[15-16]。
全球每年约有40~50 万口腔癌的新发病例,治疗方法为以手术为主、 结合放疗和化疗的综合治疗。口腔癌的5 年生存率仅为50%~60%,每年造成约20 万人死亡[17-19]。此外,近年来口腔的发病年龄趋于年轻化[20-21]。因此,研究口腔癌的发生、发展,以期寻求更好的治疗方法有重要的临床意义。最新的研究虽然已经发现口腔癌患者循环外泌体含量较正常人明显增高,可能参与口腔癌的发生和发展,并且可以将循环外泌体作为口腔癌患者的生物标志物(biomarker)[2]。但循环外泌体究竟在口腔癌的发生、发展中起什么样的作用,目前仍然不清楚。
A: 1~4 周肿瘤生长情况; B: 1~4 周肿瘤生长曲线; C:对照组和外泌体处理组肿瘤重量; D: 免疫荧光法检测对照组和外泌体处理组肿瘤组织中Ki67的表达水平
图 4 口腔癌患者循环外泌体在裸鼠体内促进CAL27细胞增殖
A:Invivoxenograft tumors after the indicated treatment for 1-4 weeks; B: Growth curves of the xenograft tumors after the indicated treatment; C: Weights of the harvested xenograft tumors; D: The expression of Ki-67 in the xenograft tumor tissues determined by immunofluorescence histochemistry analysis
Fig 4 The effects of circulating exosomes from oral cancer patients on CAL27 cell proliferation in nude mice
本研究通过收集口腔癌患者循环外泌体,并将外泌体作用于口腔癌细胞,观察外泌体对口腔癌细胞的增殖、迁移与侵袭的作用。结果表明,口腔癌患者循环外泌体在体外可显著促进口腔癌细胞的增殖、迁移和侵袭。裸鼠移植瘤试验结果与体外试验结果一致,即口腔癌患者循环外泌体可促进口腔癌细胞的增殖。
综上所述,口腔癌患者循环外泌体可促进口腔癌细胞的增殖、迁移、迁移,本研究的结果可为口腔癌的治疗开辟新的思路。

