抑癌基因PDCD4和PDCD5在膀胱癌组织中的表达及临床意义
陈刚 吕仁广 杨勇 王博 陈广东 刘成会
膀胱癌是最常见的泌尿系肿瘤,我国男性膀胱癌发病率居恶性肿瘤的第七位,女性排在第十位以后[1]。膀胱癌包括尿路上皮癌、鳞状细胞癌和腺细胞癌,其次还有较少见的小细胞癌、混合型癌、癌肉瘤及转移性癌等,其中尿路上皮癌最为常见,占膀胱癌的90%以上[2,3],其主要治疗方法为经尿道电切术,术后辅以膀胱内灌注化疗或免疫治疗,但术后复发率非常高,为40%~80%[4],且绝大多数于术后1~2年内复发。这可能主要因其对常规的治疗手段(如化疗、放疗及免疫治疗等)敏感性较低所致。究其原因,主要在于肿瘤本身易复发及易于产生治疗耐受。因此,深入探讨膀胱癌的发病机制,寻求有效的治疗方法有重要意义。
肿瘤的发生和发展是一个多基因参与、多步骤发展的复杂过程,一方面和细胞增殖或分化异常有关,另一方面也与程序性细胞死亡的异常有关,是细胞增殖与程序性细胞死亡平衡失调的结果。程序性细胞死亡过程即细胞凋亡过程,若促进凋亡基因的表达减少或抑制凋亡的基因表达增多,都将促使细胞恶性增生,导致肿瘤发生。PDCD4 和PDCD5 是新近发现的两种程序性细胞死亡因子。目前的研究表明,在小鼠正常肝脏中PDCD4 的表达水平最高,其次在睾丸、脑、肺、肾及脾,而在心脏和骨骼肌中表达水平较低[5]。在人类多种组织中PDCD4 均有表达,如结肠、肝、脑、肺、食管、肾脏、表皮、胰腺及卵巢等[6]。国外研究报道称PDCD4 是肿瘤抑制基因,抑制肿瘤的转化、进展及翻译过程[7,8]。 研究发现PKB 是P13 信号传导通路中重要的抑制因子,能够调节PDCD4 蛋白的细胞亚定位。正常情况下,PDCD4 蛋白在细胞核及细胞浆中均有表达,而在外界环境发生改变时,如营养条件下降或细胞发生恶性增殖时,PDCD4 蛋白可由细胞核通过其两端的核输出信号(NES)转移到胞浆中,PKB 激酶在其胞核与胞浆的转运中发挥调节作用[9]。研究也同时表明,在人类50 多种组织中发现了PDCD5 mRNA 的表达,包括成年人的肾上腺、睾丸、心脏、胎盘和造血系统中,其在成年组织中的表达明显高于胚胎组织。PDCD4 和PDCD5 均与肿瘤的发生、发展密切相关,因此这两种因子现已成为肿瘤分子生物学研究的热点。
本研究选取膀胱癌组织石蜡切片标本60 例和癌旁非瘤组织60 例,采用免疫组织化学两步法检测PDCD4 蛋白和PDCD5 蛋白在上述组织中的表达情况,寻找其在膀胱癌中表达的规律,并将PDCD4 和PDCD5 蛋白表达结果与膀胱癌的组织学分类、TNM 分期、组织学分级和转移情况等进行相关性分析,以期寻找判断膀胱癌侵袭性及估计预后可靠的分子标记物和抗肿瘤治疗新靶点。
1 材料与方法
1.1 临床资料收集2012年6月~2017年6月我院泌尿外科手术切除的膀胱癌组织及其配对的癌旁非瘤组织石蜡切片标本各60 例。其中男35 例,女25 例;年龄27~79 岁,平均58 岁;其中尿路上皮癌42 例,鳞状细胞癌10 例,腺细胞癌8 例;按TNM 分期非肌层浸润性膀胱癌(Tis、Ta、T1)45 例,肌层浸润性膀胱癌(T2 以上)15 例;按照组织学分级,高分化38 例,中分化17 例,低分化5 例;病理学或影像学检查伴淋巴结转移或远处转移者6 例,无转移者54 例。60 例与其配对的癌旁非瘤组织作为对照。所有患者术前未行放、化疗及生物免疫治疗,所有膀胱癌标本均经病理证实。
1.2 主要仪器与试剂石蜡包埋机(常州中威公司),组织脱水机(湖北孝感仪器厂),石蜡切片机(德国莱卡公司),水浴箱(上海一恒科技有限公司),微波炉(日本松下电器公司),冰箱(德国SIEMENS 公司),电热恒温培养箱(上海华辰医用仪表公司),移液器(赛默飞世尔科技公司),显微镜Olympus BX51(日本Olympus 公司),Image-proplus 显微图象处理系统(美国Media Cybernetics 公司),PDCD4 抗体和PDCD5 抗体(北京博奥森生物技术有限公司),Super Sensitive TM 即用型超敏免疫组化二抗试剂盒(巴傲得生物科技有限公司),抗体稀释液(北京中杉金桥生物技术公司),PBS 和枸橼酸盐缓冲液(北京中杉金桥生物技术公司),苏木素、盐酸酒精、80%乙醇、95%乙醇、无水乙醇、二甲苯、中性树脂(肿瘤实验室提供)。
1.3 方法将固定好的肿瘤组织经自动脱水机脱水、透明、浸蜡、包埋、切片,采用免疫组织化学超敏 法,以PBS 代 替 一 抗(PDCD4 抗 体、PDCD5 抗体)作为阴性对照。将石蜡切片置入60℃烤箱中烤片2h;石蜡切片置于二甲苯Ⅰ中浸泡20min;石蜡切片置于二甲苯Ⅱ中浸泡20min;100%乙醇中浸泡5min×2 次;95%乙醇中浸泡5min;80%乙醇中浸泡5min;双蒸水冲洗5min×2 次;抗原修复:微波热修复,0.01M 枸橼酸钠缓冲液(pH=6)1 000ml烧杯中放入600~800ml 枸橼酸钠缓冲液,盖上铝铂纸,以免液体蒸发过多,高火至液体沸腾,放入塑料片架(内放片子),此时调成中火,维持5min×4次;微波修复完毕后,放于室温自然冷却(内盛塑料片架的烧杯从微波炉里取出),至少30min;PBS 冲洗5min×3 次;用内源性过氧化物酶阻断剂封闭10min,用于阻断组织内可能含有的内源性过氧化物酶;封闭液室温孵育5min,用于清除非特异性背景(注意:此步骤时间不能超过10min,并且根据实际情况,是否需要此步封闭);甩干切片上的多余血清(不要用PBS 洗);用抗体稀释液稀释一抗(PDCD4抗体、PDCD5 抗体)至1∶100,滴加到切片上,置入湿盒中放入4℃冰箱中孵育过夜(预实验证明 1:100 浓度稀释一抗,4℃过夜,染色效果较为理想);过夜后在室温复温45min;PBS 冲洗5min×3 次;用一抗放大剂室温孵育10min,PBS 冲洗5min×3 次;用辣根过氧化物酶聚合物室温孵育10min,PBS 冲洗5min×3 次(注意:辣根过氧化物酶对光敏感,应避光孵育);取30μlDAB 浓缩液到1mlDAB 反应物中,混匀后加到组织上,室温反应5min 或根据显色情况及时用PBS 冲洗终止反应(注意:稀释液可4℃保存2 周);双蒸水冲洗5min×2 次;苏木素复染10s;用大量自来水充分冲洗5min;用1%盐酸酒精洗2s;自来水冲洗返蓝;双蒸水冲洗5min;80%乙醇中浸泡5min;95%乙醇中浸泡5min;100%乙醇中浸泡5min×2 次;石蜡切片置于二甲苯Ⅲ中浸泡10min;滴加适当的中性树脂在组织上,盖上盖玻片封片;拍照,观察。
1.4 阳性结果判断所有免疫组化的切片分别由两名未接触过患者的病理专家独立评分。PDCD4 和PDCD5 的表达以细胞核或细胞浆中出现棕黄色颗粒为阳性,根据细胞阳性比例和着色强度综合制定免疫组织化学半定量记分法推算二者的表达情况。
阳性判断标准:①根据阳性细胞所占百分数定为0~3 分,共四级(A 项):0%为0 分、<10%为1 分、10%~50%为2 分、>50%为3 分。②根据细胞染色深浅定为0~3 分,共四级(B 项):0 分为细胞核或细胞浆上无棕黄色颗粒,与背景无区别;1 分为细胞核或细胞浆上有淡棕黄色颗粒,高于背景底色,也明显高于阴性对照;2 分为细胞核或细胞浆上有着色较清晰的棕黄色颗粒,介于强弱之间;3 分为细胞核或细胞浆上有大量的深棕黄色颗粒,阳性染色强。③判定标准综合A 项+B 项判定方法定为四级标准:0~1 分为阴性(-);2~3 分为弱阳性(+);4~5 分为中等强度阳性(++);6 分为强阳性(+++)。
1.5 统计学方法应用SPSS 16.0 统计学软件进行数据处理。PDCD4 和PDCD5 蛋白在膀胱癌组织中表达阳性率的比较采用卡方检验,而PDCD4 和PDCD5 蛋白在膀胱癌组织中表达染色结果的比较采用秩和检验。采用Spearman 等级相关分析PDCD4 和PDCD5 在膀胱癌组织表达的相关性,设置检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 PDCD4 蛋白在膀胱癌组织中的表达
2.1.1 PDCD4 蛋白在膀胱癌组织及癌旁非瘤组织中的表达 免疫组织化学染色特异性良好,PDCD4蛋白在细胞核及细胞浆中均有表达,其结果显示,在癌旁非瘤组织中PDCD4 蛋白表达的阳性率为100.0%(60/60),分别为中阳性30.0%(18/60),强阳性70.0%(42/60)。而在膀胱癌组织中PDCD4蛋白表达的阳性率为80.0%(48/60),分别为弱阳性23.3%(14/60),中阳性25.0%(15/60),强阳性31.7%(19/60)。膀胱癌组织中PDCD4 蛋白的表达水平明显低于癌旁非瘤组织中PDCD4 蛋白的表达水平(P<0.05)。各类型膀胱癌组织中PDCD4 蛋白表达的阳性率,尿路上皮癌为81.0%(34/42),鳞状细胞癌80.0%(8/10),腺细胞癌75.0%(6/8)。膀胱癌组织中PDCD4 蛋白的表达与肿瘤的组织学分类无关,差异无统计学意义(P>0.05)。见表1、图1。
2.1.2 PDCD4 蛋白在不同组织学分级及TNM 分期中的表达 PDCD4 蛋白在膀胱癌组织不同组织学分级中高分化(Grade1)的阳性表达率为100.0%(38/38),中分化(Grade2)的阳性表达率为82.4%(14/17),低分化或未分化(Grade3)的阳性表达率为20.0%(1/5),差异具有统计学意义(P<0.05),且膀胱癌组织组织学分级越高,PDCD4 蛋白的阳性表达率越低,应用等级相关分析的方法进行整体比较,结果证实PDCD4 蛋白的表达与组织学分级呈显著负相关(r=-0.370,P=0.004),见表2。
PDCD4 蛋白在膀胱癌组织不同TNM 分期中Tis、Ta、T1 期的阳性表达率为100.0%(45/45),T2 期以上的阳性表达率为66.7%(10/15),差异具有统计学意义(P<0.05),且膀胱癌组织TNM分期越高,PDCD4 蛋白的阳性表达率越低,应用等级相关分析的方法进行整体比较,结果证实PDCD4 蛋白的表达与TNM 分期呈显著负相关(r=-0.437,P<0.001)。见表2。
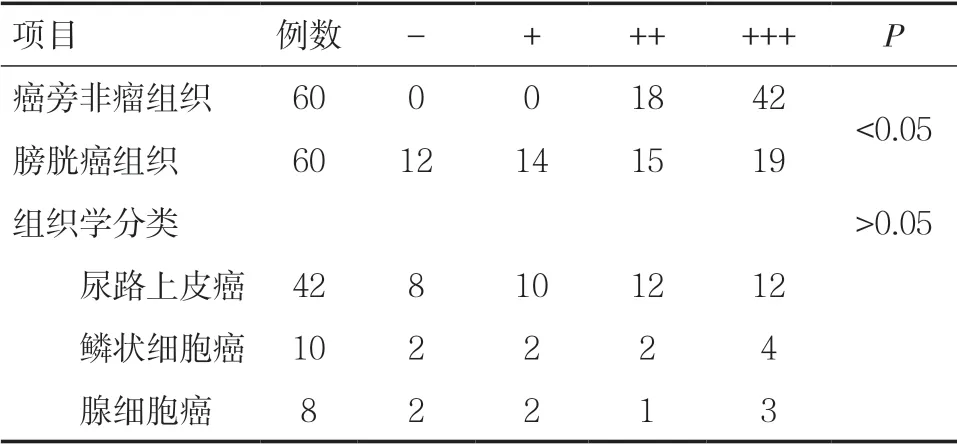
表1 PDCD4 蛋白在膀胱癌组织及癌旁非瘤组织中的表达
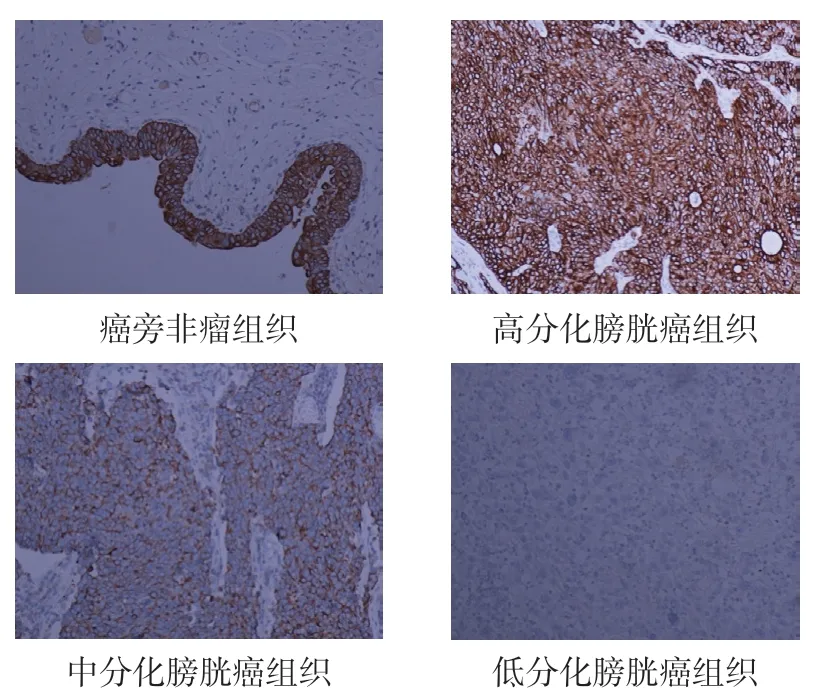
图1 PDCD4 在膀胱非瘤组织和癌组织中的表达(×400)
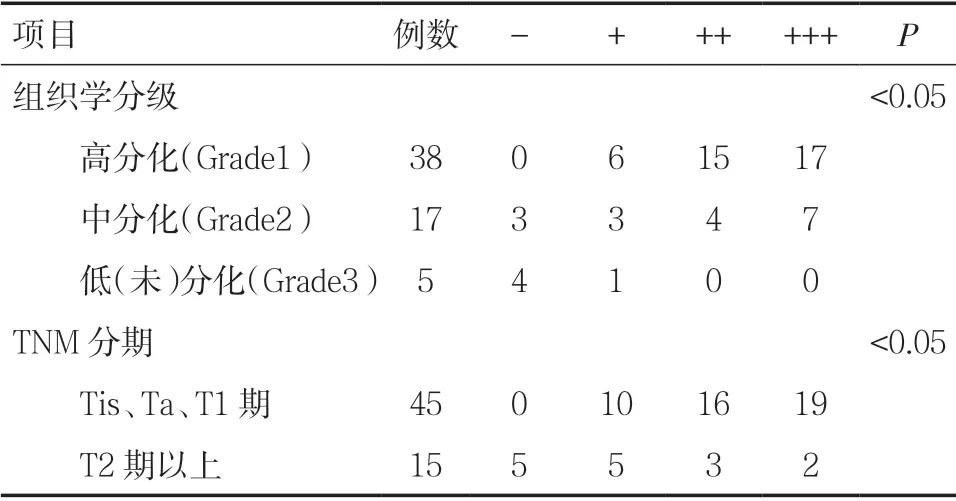
表2 PDCD4 蛋白在不同组织学分级及TNM 分期中的表达
2.1.3 PDCD4 蛋白的表达与不同性别、年龄、肿瘤大小、有无转移膀胱癌的关系 PDCD4 蛋白在男性中的阳性表达率为80.0%(28/35),在女性中的阳性表达率为80.0%(20/25),膀胱癌组织中PDCD4 蛋白的表达与性别无关,差异无统计学意义(P>0.05)。PDCD4 蛋白在<60 岁患者中的阳性表达率为81.8%(27/33),在≥60 岁的患者中的阳性表达率为77.8%(21/27),膀胱癌组织中PDCD4 蛋白的表达与年龄无关,差异无统计学意义(P>0.05)。PDCD4 蛋白在肿瘤≤1cm 患者中的阳性表达率为92.6%(25/27),在肿瘤>1cm 患者中的阳性表达率为69.7%(23/33),两者比较差异具有统计学意义(P<0.05)。PDCD4 蛋白在无转移的膀胱癌的患者中的阳性表达率为88.9%(48/54),在有转移的膀胱癌患者中的阳性表达率为50.0%(3/6),两者比较差异具有统计学意义(P<0.05)。见表3。
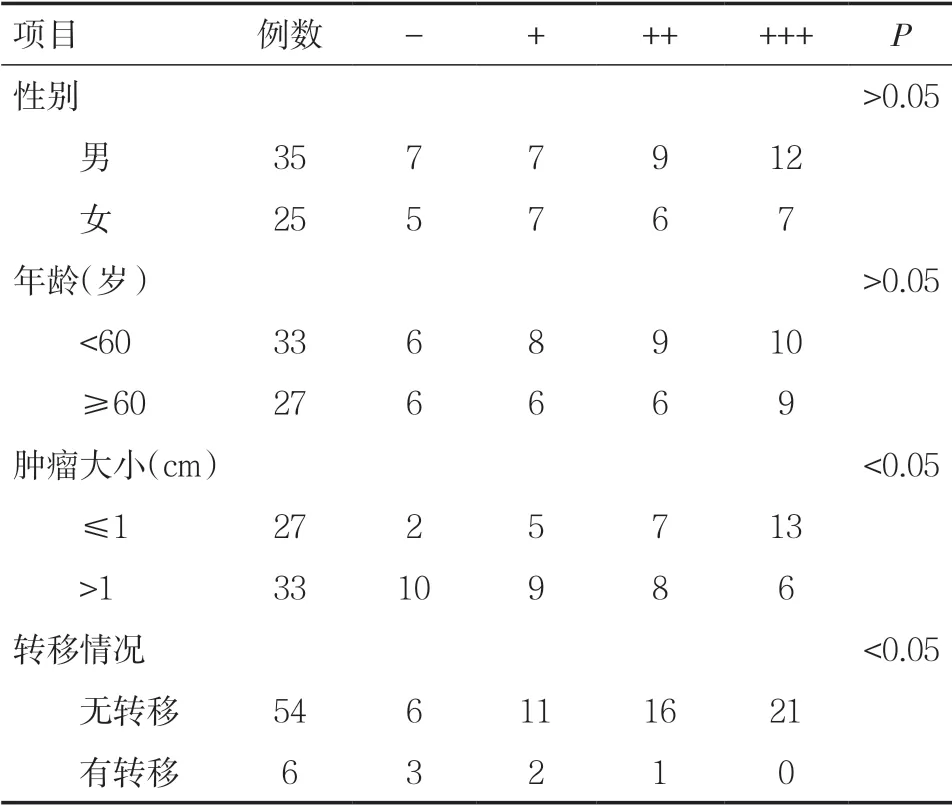
表3 PDCD4 蛋白的表达与不同性别、年龄、肿瘤大小及 有无转移膀胱癌的关系
2.2 PDCD5 蛋白在膀胱癌组织中的表达
2.2.1 PDCD5 蛋白在膀胱癌组织及癌旁非瘤组织中的表达 免疫组织化学染色特异性良好,PDCD5蛋白在细胞核及细胞浆中均有表达,其结果显示,在癌旁非瘤组织中PDCD5 蛋白表达的阳性率为100.0%(60/60),分别为中阳性25.0%(15/60),强阳性75.0%(45/60)。而在膀胱癌组织中PDCD5蛋白表达的阳性率为80.0%(48/60),分别为弱阳性25.0%(15/60),中阳性26.7%(16/60),强阳性28.3%(17/60)。膀胱癌组织中PDCD5 蛋白的表达水平明显低于癌旁非瘤组织中PDCD5 蛋白的表达水平,差异具有统计学意义(P<0.05)。各类型膀胱癌组织中PDCD5 蛋白表达的阳性率分别为尿路上皮癌81.0%(34/42),鳞状细胞癌80.0%(8/10),腺细胞癌75.0%(6/8)。经过统计学分析,膀胱癌组织中PDCD4 蛋白的表达与肿瘤的组织学分类无关,差异无统计学意义(P>0.05)。见表4,图2。
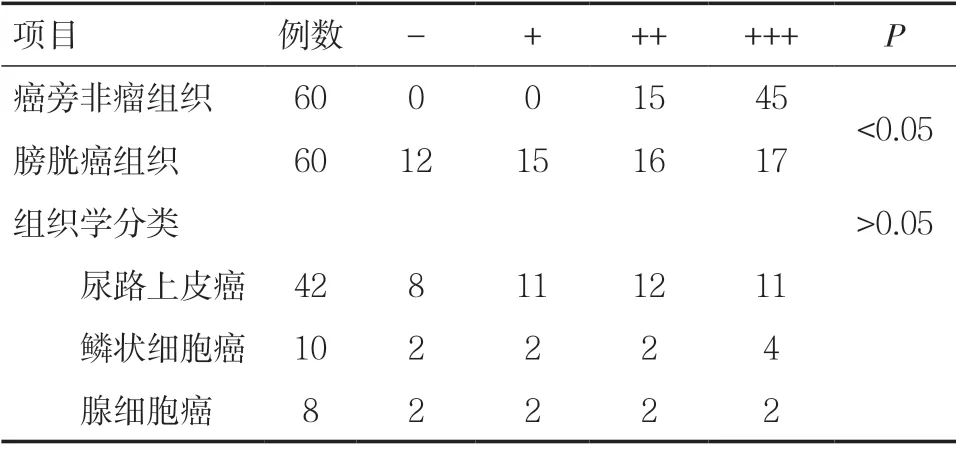
表4 PDCD5 蛋白在膀胱癌组织及癌旁非瘤组织中的表达
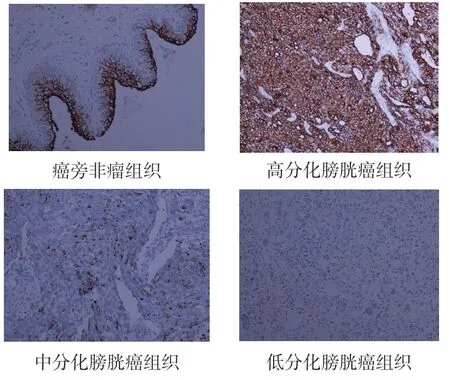
图2 PDCD5 在膀胱非瘤组织和癌组织中的表达(×400)
2.2.2 PDCD5 蛋白在不同组织学分级及TNM 分期中的表达 PDCD5 蛋白在膀胱癌组织不同组织学分级中高分化(Grade1)的阳性表达率为100.0%(38/38),中分化(Grade2)的性表达率为76.5%(13/17),低分化或未分化(Grade3)的阳性表达率为20.0%(1/5),差异具有统计学意义(P<0.05),且膀胱癌组织组织学分级越高,PDCD5 蛋白的阳性表达率越低,应用等级相关分析的方法进行整体比较,结果证实PDCD5 蛋白的表达与组织学分级呈显著负相关(r=-0.403,P=0.001)。见表5。
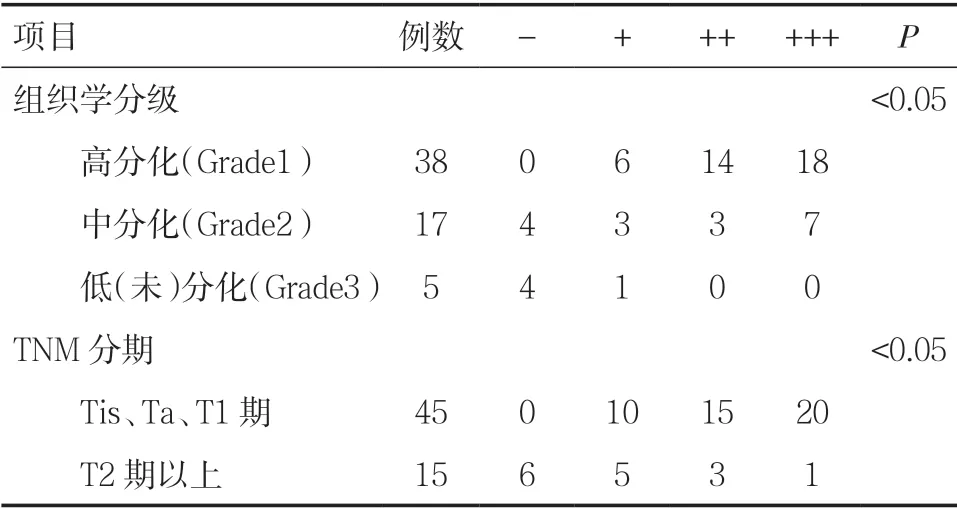
表5 PDCD5 蛋白在不同组织学分级及TNM 分期中的表达
PDCD5 蛋白在膀胱癌组织不同TNM 分期中Tis、Ta、T1 期的阳性表达率为100.0%(45/45),T2期以上的阳性表达率为60.0%(9/15),差异具有统计学意义(P<0.05),且膀胱癌组织TNM 分期越高,PDCD5 蛋白的阳性表达率越低,应用等级相关分析的方法进行整体比较,结果证实PDCD5 蛋白的表达与TNM 分期呈显著负相关(r=-0.523,P<0.001)。
2.2.3 PDCD5 蛋白的表达与不同性别、年龄、肿瘤大小、有无转移膀胱癌患者的关系 PDCD5 蛋白在男性中的阳性表达率为77.1%(27/35),在女性中的阳性表达率为76.0%(19/25),膀胱癌组织中PDCD5 蛋白的表达与性别无关,差异无统计学意义(P>0.05)。PDCD5 蛋白在<60 岁患者中的阳性表达率为78.8%(26/33),在≥60 岁的患者中的阳性表达率为81.5%(22/27),膀胱癌组织中PDCD5 蛋白的表达与年龄无关,差异无统计学意义(P>0.05)。PDCD5 蛋白在肿瘤≤1cm 的患者中的阳性表达率为88.9%(24/27),在肿瘤>1cm 患者中的阳性表达率为66.7%(22/33),差异具有统计学意义(P<0.05)。PDCD5 蛋白在无转移的膀胱癌的患者中的阳性表达率为87.0%(47/54),在有转移的膀胱癌患者中的阳性表达率为66.7%(4/6),差异具有统计学意义(P<0.05)。见表6。
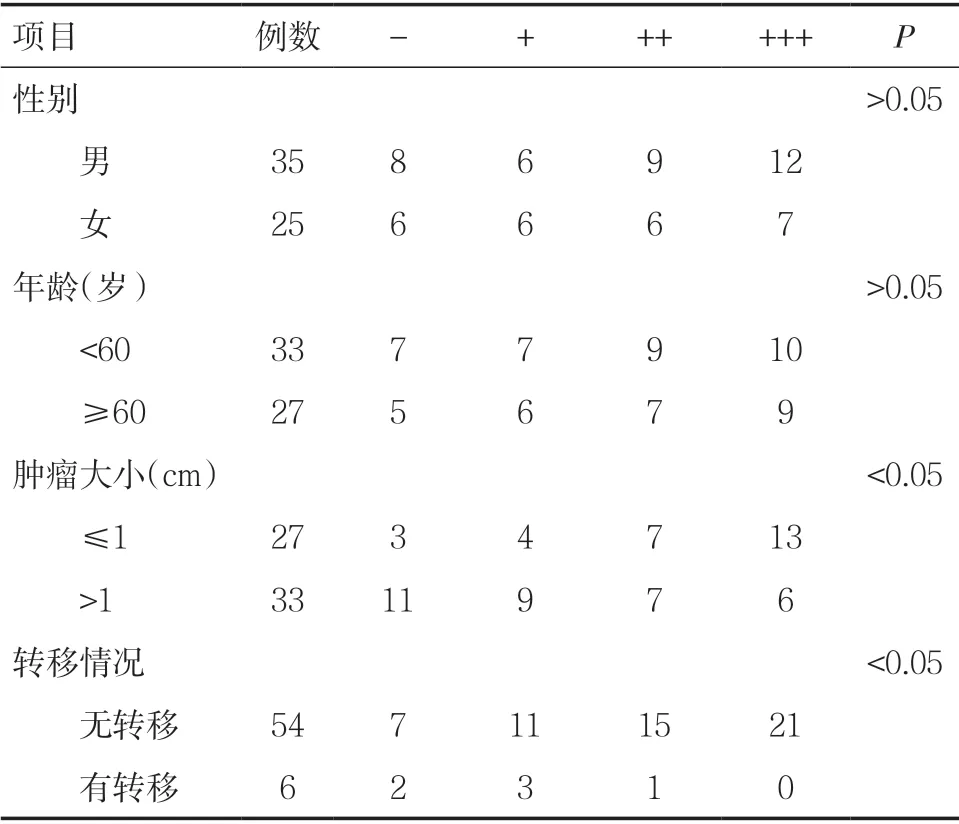
表6 PDCD5 蛋白的表达与不同性别、年龄、肿瘤大小及 有无转移膀胱癌的关系
2.3 膀胱癌组织中PDCD4 蛋白和PDCD5 蛋白表达的相关性60 例膀胱癌组织中有45 例PDCD4蛋白和PDCD5 蛋白同时表达阳性,10 例两者同时表达阴性,经过统计学分析,PDCD4 蛋白和PDCD5蛋白在膀胱癌组织中的表达呈正相关(r=0.748,P<0.001)。
3 讨论
膀胱癌是泌尿系统最常见的恶性肿瘤,发病率居泌尿系统恶性肿瘤的首位,由于膀胱癌多中心性起源及多发性的特点,40%~80%行保留膀胱手术的患者术后复发[2],其中10%的患者发展为浸润性癌或转移。膀胱癌发生转移后,多数患者在2年内死亡。为避免肿瘤复发、延缓肿瘤的进展或根除残余病灶,术后一般都辅助膀胱内灌注治疗,采用合适的药物对延迟和预防浅表性膀胱肿瘤的复发极为必要。影响膀胱癌预后最重要的因素是病理分期,此外肿瘤的大小、组织学分级、患者行为状态评分、肿瘤中是否存在组织坏死、生化指标异常等因素也与膀胱癌的预后有关。目前有关膀胱癌的研究表明,肿瘤的发生和发展是一个多基因参与、多阶段发展的复杂过程,实际上是多种肿瘤相关基因表达失常或多种肿瘤抑制基因失活所致[10,11]。因此,研究生物因子在膀胱癌组织中的表达可能为临床提供必要的诊断、预后指标和治疗标准。
PDCD4 最早由Shibahara 等[12]在小鼠体内发现,在小鼠体内大部分细胞发生凋亡时该基因表达上调。人的PDCD4 基因定位于染色体的10q25.2,含13 个外显子,它的DNA 全长26.9 kb, cDNA 全长约3.5kb,其中编码区约1.4kb[13]。目前研究发现PDCD4 蛋白在细胞核内合成,并转运至胞浆中发挥作用,在蛋白序列上含有两个保守的α 螺旋结构区-MA3(mitogen activated3),使其可以通过MA3 的结构域竞争性地结合到eIF4A 上,从而抑制解螺旋酶活性,抑制肿瘤细胞的翻译过程[14]。本实验免疫组织化学结果显示PDCD4 蛋白在细胞核及细胞浆中均有表达,而在外界环境发生改变时,如营养条件下降或细胞发生恶性增殖时,PDCD4 蛋白可由细胞核通过其两端的核输出信号(NES)转移到胞浆中。目前来自人肿瘤的研究结果说明PDCD4 是一种新的抑癌基因,它的下调或缺失与多种癌症的发生发展有密切关系,如肺癌、胃癌、胶质瘤、卵巢癌、肝癌、黑色素瘤、胰腺癌、乳腺癌、大肠腺癌、神经细胞瘤、口腔肿瘤等。这些研究结果均提示PDCD4 有可能成为肿瘤基因治疗的新靶点。
PDCD5 是北京大学人类疾病基因研究中心从正常培养的白血病细胞株TF-l 细胞中克隆得到的高表达的程序性细胞死亡相关新基因,当时命名为TFAR19(TF-1 cell apoptosis related gene 19)。后经国际人类基因命名委员会建议,命名为PDCD5。PDCD5 基因定位于染色体的19q13.11,基因全长约有6kb,由6 个外显子和5 个内含子组成,分为3个结构域,外显子6 可能是一个编码与促凋亡活性密切相关的功能结构域,cDNA 全长为559bp,包括AATAAA 加尾信号和polyA 尾,其中25-399bp 有一个编码125 个氨基酸的读码框架,在25bp 处有一个ATG 起始密码子。PDCD5 基因的表达受多种因素调控,现有资料表明PDCD5 是凋亡促进剂,而不是凋亡诱导剂[15,16]。PDCD5 作为一个凋亡调控分子,与肿瘤的预后、耐药以及治疗都有着密切的关系。
本实验进一步认识了PDCD4 和PDCD5 在膀胱癌发生、发展中的作用,为今后的研究提供了真实可靠的依据。我们应用免疫组织化学两步法在蛋白水平检测了PDCD4 和PDCD5 在膀胱癌组织及癌旁非瘤组织中的表达情况,其结果显示PDCD4蛋白和PDCD5 蛋白在细胞核及细胞浆中均有表达。在癌旁非瘤组织中PDCD4 蛋白表达的阳性率为100.0%(60/60),而在膀胱癌组织中PDCD4蛋白表达的阳性率为80.0%(48/60),膀胱癌组织中PDCD4 蛋白的表达水平明显低于癌旁非瘤组织中的表达水平(P<0.05)。在癌旁非瘤组织中PDCD5 蛋白表达的阳性率为100.0%(60/60),而在膀胱癌组织中PDCD5 蛋白表达的阳性率为80.0%(48/60),膀胱癌组织中PDCD5 的表达水平明显低于癌旁非瘤组织中的表达水平(P<0.05)。PDCD4蛋白的表达与组织学分级呈显著负相关(r=-0.370,P=0.004),与TNM 分期呈显著负相关(r=-0.437,P<0.001);PDCD5 蛋白的表达与组织学分级呈显著负相关(r=-0.403,P=0.001),与TNM 分期呈显著负相关(r=-0.523,P=0.001)。最后进行了分组统计结果,显示不同性别、年龄的膀胱癌患者PDCD4和PDCD5 的表达均差异无统计学意义(P>0.05);而不同肿瘤大小和有无转移的膀胱癌患者PDCD4和PDCD5 的表达差异有统计学意义(P<0.05)。本实验研究发现60 例膀胱癌组织中有45 例PDCD4蛋白和PDCD5 蛋白同时表达阳性,10 例两者同时表达阴性,应用Spearman 等级相关分析结果示,PDCD4 蛋白和PDCD5 蛋白在膀胱癌组织中的表达呈正相关(r=0.748,P<0.05)。以上实验结果说明,PDCD4 和PDCD5 可能在不同程度上参与了膀胱癌发生、发展过程中的细胞凋亡的调控。细胞凋亡是一个复杂的基因调控过程,靠凋亡促进因子和抑制因子相互作用来保持平衡,细胞最终是否走向凋亡取决于促进因子和抑制因子相互作用的最终结果。该实验说明各种因素所致的膀胱上皮细胞演变为肿瘤细胞后,其凋亡相关蛋白的表达呈现下降水平,且随着肿瘤的演变,凋亡相关蛋白的表达呈进行性下降。
综上所述,PDCD4 和PDCD5 是两个与膀胱癌相关的抑癌基因。在膀胱癌中的表达均存在不同程度的下降或缺失,并与膀胱癌的分化恶性程度相关。鉴于抑癌基因PDCD4 和PDCD5 的特殊生物学特性及其与膀胱癌关系的复杂性,可以预测这两种因子在膀胱癌的诊断和治疗上可能产生积极的作用,可以充分利用分子生物学的技术调控PDCD4和PDCD5 的基因表达,阻滞细胞增殖,促进细胞凋亡,将有可能发挥抑制膀胱尿路上皮细胞生长的作用,从而达到治疗膀胱癌的目的,这将可能成为人类膀胱肿瘤基因治疗的突破口。

