多西紫杉醇联合表阿霉素序贯化学治疗对三阴性乳腺癌患者血清学指标的影响
王运伟,刘中强,夏熙学,杨国鹏,张玉邦
(河北省沧县医院,河北 沧州 061009)
乳腺癌是女性常见恶性肿瘤,已成为严重威胁女性身体健康的主要病因[1]。三阴性乳腺癌(triple negative breast cancer,TNBC)是指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因(Her-2)均为阴性的乳腺癌[2]。TNBC占所有乳腺癌病理类型的10.0% ~20.8%,具有特殊的生物学行为和临床病理特征,预后较其他类型乳腺癌差(患者5年生存率低于15%)[3]。目前,化学治疗(简称化疗)是改善TNBC患者预后的主要方法,多西紫杉醇和表阿霉素应用广泛,但两者联用产生的不良反应重,患者耐受性差[4]。有研究指出,TNBC患者接受多西紫杉醇和表阿霉素的序贯治疗可达到联用效果[5]。本研究中拟采用多西紫杉醇联合表阿霉素序贯化疗治疗TNBC,为临床推广提供临床试验依据。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》中 TNBC的诊断标准[6];年龄 18~50岁;有明确病灶,并实施手术治疗;肿瘤TNM分期[7]为Ⅰ~Ⅲ期;预计生存期不短于3个月;浸润性癌;美国东部肿瘤协作组体能状态评分不低于2分[8];单侧乳腺癌;规律化疗;患者签署知情同意书,自愿接受治疗。
排除标准:对多西紫杉醇、表阿霉素过敏;放化疗史;合并其他部位原发肿瘤病灶;化疗前经影像学检查显示无远处转移;卡氏(Kamofasky)生活质量评分低于70 分[9]。
病例选择与分组:选取我院2016年12月至2017年12月就诊的女性TNBC患者106例,随机分成两组,各53例。两组患者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表 1。
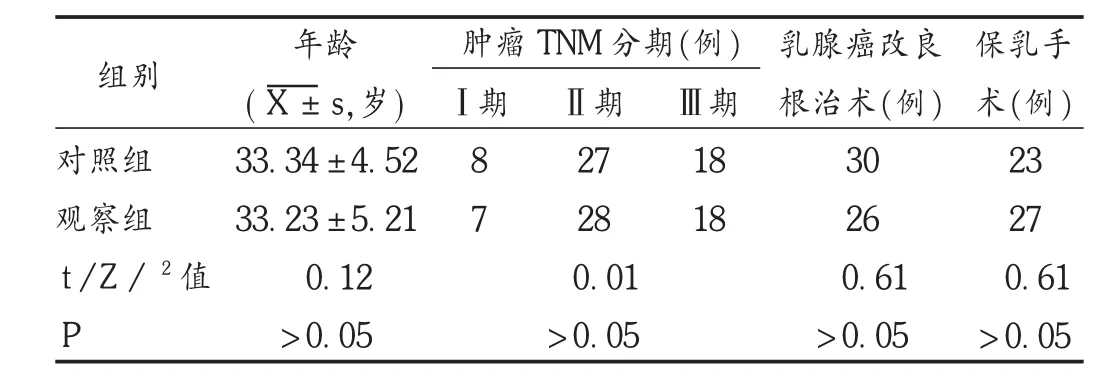
表1 两组患者一般资料比较(n=53)
1.2 方法
两组患者术后均给予规范化疗,化疗前均口服地塞米松片(广东华南药业集团有限公司,国药准字H44024469,规格为每片 0.75 mg),化疗期间常规检测肝肾功能[包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、血清肌肝(SCr)、尿素氮(BUN)]。对照组患者给予盐酸表柔比星注射液(浙江海正药业股份有限公司,国药准字H20041211,规格为每支5 mL∶10 mg)75 mg/m2(第 1~2 天,静脉滴注)+多西紫杉醇注射液(太极集团四川太极制药有限公司,国药准字H20123401,规格为每支 1 mL ∶40 mg)75 mg/m2(第 3 天,静脉滴注),3周为1个周期,共6个周期;观察组前4个周期给予表阿霉素 75 mg/m2(第 1~2天,静脉滴注),后 4个周期多西紫杉醇 100 mg/m2(第 1天,静脉滴注),3周为1个周期,共8个周期。
1.3 观察指标与疗效判定标准[6]
血清学指标:利用酶联免疫吸附(ELISA)法检测患者血清中缺氧诱导因子(HIF-1α)、血管内皮生长因子(VEGF)、内皮素(ET)水平,试剂盒均由上海江莱生物科技有限公司提供;不良反应:记录化疗期间出现的血液系统、肝肾功能、消化系统不良反应情况;预后:比较两组患者术后3年复发率、转移率及死亡率。完全缓解:肿瘤完全消失;部分缓解:肿瘤缩小不低于50%;疾病稳定:肿瘤缩小低于50%或肿瘤增大低于20%;疾病进展:肿瘤增大不低于20%。有效=完全缓解+部分缓解,控制=完全缓解+部分缓解+疾病稳定。
1.4 统计学处理
2 结果
结果见表2至表5。

表2 两组患者临床疗效比较[例(%),n=53]
表3 两组患者血清学指标比较(±s,pg/mL,n=53)

表3 两组患者血清学指标比较(±s,pg/mL,n=53)
注:与本组化疗前比较, P <0.05;与对照组化疗后比较, P <0.05。
HIF-1 VEG ET组别对照组观察组化疗前175.15 ±6.34 175.13 ±6.32化疗后146.03 ±4.73 123.67 ±4.74化疗前346.48±6.67 346.52±6.42化疗后244.65 ±5.92 210.48 ±5.28化疗前84.25 ±4.76 84.26 ±4.74化疗后54.76 ±1.45 48.45 ±1.07
3 讨论
TNBC具有较强的肿瘤侵袭能力,易向远处转移,内脏转移和脑转移发生率较高,预后差,死亡率较高[10]。多西紫杉醇属紫杉烷类抗肿瘤药物,通过特异性结合到癌细胞中微管蛋白(分为α-微管蛋白和β-微管蛋白)的特定部位,从而起到防止其解聚的作用,使癌细胞的分裂永远停留在G2和M期,导致癌细胞无法复制,最终造成癌细胞死亡[11-12]。表阿霉素属蒽环类抗肿瘤药物,可通过嵌入DNA双链的碱基之间,形成稳定复合物,抑制DNA复制与RNA合成,从而阻止癌细胞分裂;可通过抑制拓扑异构酶Ⅱ,影响DNA超螺旋转化为松弛状态,从而阻止DNA复制与转录;还可通过螯合铁离子后产生自由基从而破坏DNA、蛋白质及细胞膜结构[13]。有研究表明,多西紫杉醇与表阿霉素均需要通过剂量密集给药才能发挥最大抗肿瘤作用,从而改善预后,但剂量密集给药会增加药品不良反应,导致耐受性差而中断化疗[14]。多西紫杉醇与表阿霉素的序贯治疗并未减少化疗药物总量,而是强调多种化疗药物不再同时给药,且延长化疗周期[15]。本研究结果显示,两组有效率和控制率比较无明显差异,说明序贯化疗并未降低化疗效果,与王薇等[16]报道一致。
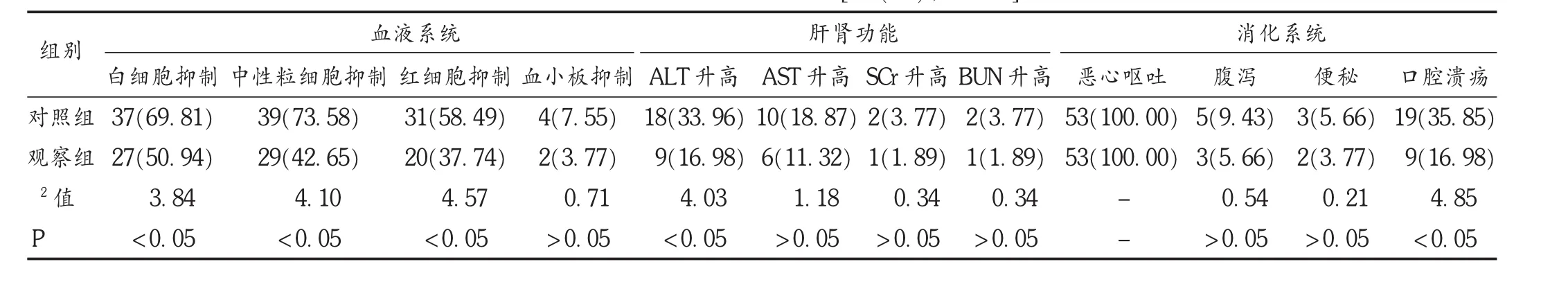
表4 两组患者不良反应比较[例(%),n=53]
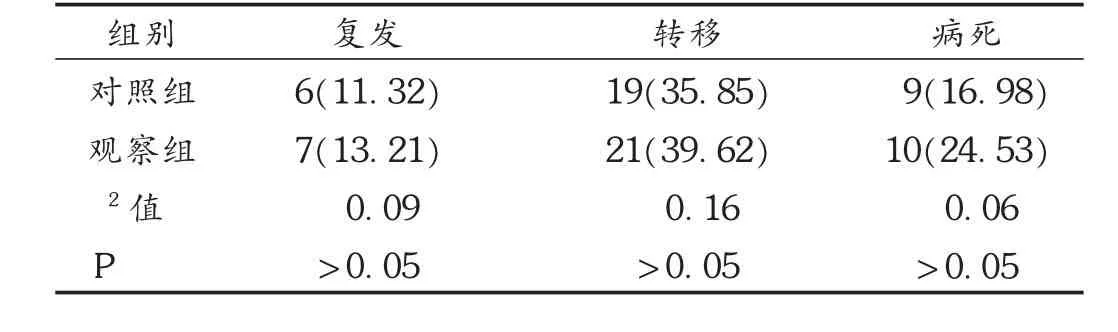
表5 两组患者预后比较[例(%),n=53]
VEGF能特异性促进血管内皮细胞增殖,参与内皮细胞活化、迁移、入侵和生存的蛋白在多种实体恶性肿瘤中具有较高的表达[17]。乳腺肿瘤的生长和转移依赖血管的生成,而血管的生成主要受 VEGF调节[18]。HIF-1α是在缺氧条件下存在于人体内的一种异源二聚体,通过诱导VEGF和糖酵解相关酶的表达,增加供血、供氧、供能,维持癌细胞的代谢功能[19]。ET是一种由内皮细胞合成的具有强烈缩血管作用的生物活性物质,同时还作为一类促分化剂和细胞生长因子,参与多种肿瘤的发生和发展[20]。闫朝岐等[21]发现,ET在乳腺癌组织、乳腺纤维瘤及癌旁正常组织中的表达具有显著性差异,其中ET在乳腺癌组织中的表达量最高,在癌旁正常组织中的表达量最低;ET在乳腺癌各临床分期标本中的表达也有显著差异,分期越晚,表达量越高。本研究结果显示,两组患者的HIF-1α,VEGF,ET水平较化疗前明显降低,且观察组降低幅度大于对照组,说明序贯化疗可明显降低TNBC患者血清中HIF-1α,VEGF,ET的水平,从而抑制癌细胞的生长和代谢过程。
白细胞抑制是化疗药物的常见不良反应,发生率可达50%~80%,有些TNBC患者甚至因白细胞急剧减少导致感染而终止化疗[22]。肝肾功能异常是化疗药物的另一类不良反应,一旦出现应综合考虑是否减少用药量或停止化疗[23]。消化系统不良反应是化疗药物的常见不良反应。本研究结果显示,观察组白细胞、中性粒细胞、红细胞抑制的发生率均明显低于对照组,观察组ALT升高的发生率明显低于对照组,两组化疗期间恶心呕吐的发生率均为100.00%,观察组口腔溃疡的发生率明显低于对照组,说明序贯化疗可明显减少化疗期间白细胞、中性粒细胞、红细胞抑制,ALT升高,口腔溃疡发生率。国外有报道,TNBC患者在给予多西紫杉醇和表阿霉素后,肾功能损伤的发生率约为10%[24]。但本研究中出现肾损伤的患者比例远低于10%,这可能与TNBC患者化疗后肾损伤的发生与多种因素的影响有关。此外,术后3年两组复发率、转移率、病死率比较无明显差异,说明序贯化疗与联合化疗对TNBC预后的影响基本相当。
综上所述,多西紫杉醇联合表阿霉素序贯化疗用于三阴性乳腺癌,临床疗效及预后均与联合化疗基本相当,但序贯化疗可明显降低血清HIF-1α,VEGF,ET水平,明显减少化疗期间白细胞、中性粒细胞、红细胞抑制,以及ALT升高、口腔溃疡的发生率,值得临床推广。

