吉兰-巴雷综合征患者血清尿酸和白蛋白及β羟基丁酸水平与疾病严重程度的关系
姚绍莉 陈虹西 张勤 周红雨
氧化应激反应在疾病的发病机制中,尤其是在炎性反应和自身免疫介导的组织破坏的发生和发展中起重要作用[1]。研究表明,过氧亚硝酸盐与免疫相关疾病的免疫病理机制有关,尿酸作为一种已知的过氧亚硝酸盐清除剂,是一种天然的具有金属螯合性的抗氧化剂[2],其在人类血液中自由基清除活性高达60%[3]。血清白蛋白亦具有抗氧化性,在细胞外液中起重要的抗氧化作用[4]。研究表明,G-蛋白偶联受体羟基羧酸受体(HCA2)在调节多组织炎性反应和临床结局中起重要作用[5]。β羟基丁酸(β-HBA)是HCA2的内源性配体,是机体处于负能量平衡时在肝脏生成的一种酮体并可激活一系列炎性反应调制信号网。尿酸和白蛋白作为抗氧化剂在自身免疫性疾病中已被广泛研究,包括多发性硬化、视神经脊髓炎、类风湿关节炎、重症肌无力等。而氧化应激反应对周围神经炎性损伤的影响尚存在争议。吉兰-巴雷综合征(GBS)是神经内科常见的周围神经炎性疾病,目前针对GBS患者体内的抗氧化状态尚不清楚。此外,关注β-HBA与炎性反应性周围神经病变关系的研究亦很少。本研究对GBS患者血清尿酸、白蛋白和β-HBA的水平及其与GBS严重程度之间的相关性进行了探讨。
1 对象和方法
1.1对象收集2009年9月至2016年8月四川大学华西医院神经内科收治的GBS患者156例,其中男85例,女71例,发病年龄14~85岁,平均(48.4±18.6)岁。以急性炎性脱髓鞘性多发性神经病最常见,共143例(91.7%),急性运动轴索性神经病与Miller-Fisher 综合征各5例(3.2%),其他未分类(包括Bickerstaff脑干脑炎、有或无合并自主神经功能障碍的脑神经变异型和咽颈臂变异型)共3例。其中66.03%为重型GBS,70.5%患者使用了静脉注射丙种球蛋白治疗。纳入标准:符合GBS诊断标准[6];大于14岁的住院患者;因超80%的GBS患者在3周内达到疾病最高峰[7],起病的前3周被认为是急性期,该组患者病程均在3周内。排除标准:肝脏疾病或血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶、肌酐浓度超出正常值范围;有痛风和肾衰竭病史;正在服用阿司匹林、噻嗪类利尿剂、类固醇和其他可能影响尿酸水平药物者。另选择同期作者单位行体检的健康志愿者共497名作为健康对照组,其性别构成和年龄与患者相匹配。排除标准同GBS患者。该研究得到四川大学华西医院伦理委员会的批准通过。
1.2方法
1.2.1临床资料收集:收集患者人口学资料、临床表现、实验室检查结果、Hughes功能评分及治疗情况。实验室检查项目包括:于入院第2天清晨采集空腹静脉血,采用自动分析仪(Johnson,Vitors 5600)测定观察对象血尿酸、白蛋白、β-HBA、丙氨酸氨基转移酶(参考范围0~40 IU/L)、 天冬氨酸氨基转移酶 (参考范围0~35 IU/L)、空腹血糖及血肌酐水平。
1.2.2疾病严重程度评估:于患者住院期间病情达高峰时进行Hughes功能评分评估残疾严重程度[8],0分:健康,1分:有神经病变的轻度症状或体征,但能手工劳动/跑步,2分:无支持情况下能行走(开阔空间走5 m),但不能手工劳动/跑步,3分:在支持情况下能行走(开阔空间走5 m),4分:被动卧床或坐轮椅,5分:需辅助通气(白天或夜间任何时候),6分:死亡。Hughes评分<3分定义为轻型GBS,评分≥3分定义为重型GBS。
1.3统计学处理采用STATA 12.1进行统计学分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料用均数±标准差表示,两均数间比较采用t检验(然后用多元线性回归校正年龄和性别),多组均数间比较采用单因素方差分析分析;非正态分布的计量资料采用中位数(四分位数间距)表示,两组间比较采用Mann-Whitney检验,多组间比较采用秩和检验;GBS患者残疾程度与血清尿酸、白蛋白和β-HBA水平的相关性采用Spearman相关分析;GBS患者残疾程度与尿酸、β-HBA水平等的关系采用多元线性回归分析。取α=0.05。
2 结果
2.1两组血清尿酸、白蛋白和β-HBA水平比较GBS患者血清尿酸和白蛋白水平低于健康对照组(均P<0.01),而β-HBA水平高于健康对照组(P<0.01)。结果见表1。采用多元线性回归对年龄和性别进行校正后GBS患者血清尿酸和白蛋白水仍低于健康对照组(均P<0.01)。
2.2不同入院时间GBS患者血清尿酸、白蛋白和β-HBA水平根据GBS患者发病至入院的天数,分为≤7 d、7~14 d、14~21 d组,各组血清尿酸、白蛋白及β-HBA水平比较无统计学差异(表2)。
注:GBS:吉兰-巴雷综合征,β-HBA :β羟基丁酸;表2、3同。a数据以中位数(四分位数间距)表示;表2同。bGBS组进行该指标检测的例数为129例,对照组为85例
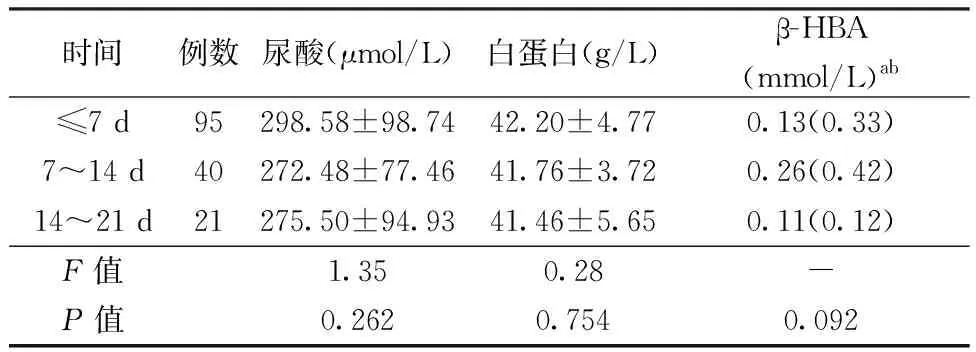
表2 GBS患者发病至入院不同时间血清尿酸、白蛋白和β-HBA水平比较
注:-:采用秩和检验,无数据;b129例GBS患者进行检测,其中≤7 d组78例,7~14 d组30例,14~21 d组21例
2.3疾病严重程度与尿酸、白蛋白和β-HBA的相关性疾病严重程度与尿酸及白蛋白水平间无相关性(r=-0.135,P=0.093;r=-0.023,P=0.771),而与β-HBA水平存在一定相关性(r=0.198,P=0.020),但相关系数小。采用多元线性回归分析模型校正肝功能、肾功能、年龄、性别、糖尿病等对β-HBA水平的影响,结果显示β-HBA水平仍与Hughes评分呈正相关(表3)。
3 讨论
3.1GBS患者血清尿酸和白蛋白水平许多研究证明血清尿酸和白蛋白水平在多发性硬化、视神经脊髓炎、重症肌无力、帕金森病、多系统萎缩、阿尔茨海默病等自身免疫性和神经退行性疾病患者体内水平均降低,提示尿酸和白蛋白水平与上述疾病有关,但其在神经系统疾病发病机制中的作用尚不确定。急性期GBS患者血清尿酸和白蛋白水平降低是疾病的诱因还是结果尚不清楚。有研究发现多发性硬化患者尿酸水平降低,但与MRI新发病灶、残疾或疾病亚型不相关;此外,该研究亦观察到其他神经系统疾病的尿酸水平取决于不同的神经系统疾病亚型[9]。某些研究已经确定,尿酸浓度与疾病活动和免疫调节作用或免疫抑制药物密切相关,有学者推测尿酸可以用来监测疾病活动并判断疗效[10-12]。本研究结果显示,与健康对照组比较,急性期GBS患者血清尿酸和白蛋白水平明显下降,但与疾病严重程度、疾病类型和病程无关。目前关于GBS患者尿酸和白蛋白水平降低的具体机制尚不清楚。既往包括临床研究和基于动物模型的研究已确定尿酸是氧化应激反应的氧化剂[13-14]。尿酸可以螯合铁和铜等金属,将其转化成活性较低的形式而不能催化自由基反应[15]。与此相反,有些学者认为尿酸可作为一种抗氧化剂使用。采用尿酸治疗可提高实验性自身免疫性脑脊髓炎小鼠血清尿酸水平,并可促进其神经功能恢复[14]。因此,对于血清尿酸水平降低的GBS患者来说,补充尿酸或其前体肌苷被认为是一种补充疗法[9]。同型半胱氨酸被认为具有中枢神经系统毒性,而白蛋白是血浆中与同型半胱氨酸结合的主要蛋白,推测其可能通过结合同型半胱氨酸而减少其对中枢神经系统的损害。白蛋白是活性氧(ROS)和活性氮(RNS)的靶点,通过与其结合而限制其对其他分子的破坏。白蛋白也可通过结合铁和血红素来减少ROS和RNS的产生[16]。然而,亦有研究指出,白蛋白可能通过诱导促炎细胞因子的产生或干扰钾稳态来促进病理过程,使神经元更容易被谷氨酸兴奋[16]。一旦白蛋白进入中枢神经系统,即可发挥有益或有害作用,其具体可发挥哪种作用很大程度上依赖于它所处的微环境[16]。作者认为,尿酸和白蛋白可能参与了GBS患者急性期的抗氧化反应,但血清尿酸和白蛋白不能阻止游离自由基对周围神经的损害;另外,血清尿酸和白蛋白可能被作为抗氧化剂在基质中被消耗,但确切结论需要进一步研究证实。

表3 GBS患者Hughes评分与临床特征间的多元线性回归分析结果
注:a为标准化Beta值
3.2GBS患者血清β-HBAβ-HBA在多种疾病中的抗炎和神经保护作用已引起关注,如多发性硬化、帕金森病、缺血性卒中、动脉粥样硬化和乳腺癌等。然而,这个结论存在争议:一些研究指出β-HBA可显著降低多聚糖蛋白质和同种型一氧化氮合酶、环氧化酶-2、肿瘤坏死因子、白细胞介素1(IL-1)、IL-6的mRNA表达水平;然而,有研究表明,β-HBA既不能诱发也不能预防体外培养的大鼠大脑的氧化应激反应[17]。本研究结果显示,GBS患者血清β-HBA水平显著高于健康对照组,经校正肝功能、肾功能、性别、年龄和糖尿病后其与疾病严重程度呈正相关,但相关系数偏小,尚不足以表明血清β-HBA水平与疾病严重程度之间的因果关系,需要进一步研究证实。β-HBA在炎性周围神经病发病机制中的作用至今仍不清楚,推测其可能的机制为:β-HBA在疾病开始时参与抗炎反应,但这种炎性反应过于强烈,炎性反应的级联瀑布反应引起了周围神经损伤。
综上所述,本研究结果显示急性期GBS患者血清尿酸和白蛋白水平降低,而β-HBA水平升高,且β-HBA水平与疾病严重程度呈正相关,表明在GBS早期的炎性反应中抗氧化反应被激活,早期阻断该通路可能有利于GBS的治疗。但由于本研究为横断面研究,未能对GBS患者血清尿酸、白蛋白和β-HBA水平的动态变化进行观察,亦未对其水平变化与GBS患者长期预后间的相关性进行分析,同时也未考虑GBS患者心理健康状态可能对患者残疾评分的影响,因此,有关血清尿酸、白蛋白及β-HBA水平与GBS发病的确切关系需进一步研究。

