微生物还原石墨烯修饰碳毡电极的电化学特征
郑 飞,朱维晃*,高昊翔
微生物还原石墨烯修饰碳毡电极的电化学特征
郑 飞1,2,朱维晃1,2*,高昊翔1,2
(1.西安建筑科技大学,陕西省环境工程重点实验室,陕西 西安 710055;2.西安建筑科技大学,西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
本文探讨了腐败希瓦氏菌(ATCC 8071)与生物呼吸驱动下自组装3D-br-GO修饰碳毡电极之间相互作用的电化学特性,并且进一步探究了施加+0.1V(vs. Ag/AgCl)电势于生物电极对其相互作用的影响.X射线衍射检测表明GO在微生物呼吸驱动下生成了还原态氧化石墨烯(br-GO).扫描电镜图像显示GO修饰电极表面有大量的br-GO包裹细菌的复合结构,说明br-GO对微生物具有较好的生物相容性,且由微生物呼吸驱动得到的三维br-GO自组装地修饰到生物电极上增加了其比表面积和细菌负载量.通过生物膜生长过程中的产电监测、循环伏安法测试,结果表明GO的修饰有利于细菌附着于电极形成活性生物膜,促进了微生物与电极之间的电子转移.而施加+0.1V(vs. Ag/AgCl)电势于GO修饰的电极,结果显示电极上仅有少量的细菌负载,没有形成活性生物膜,微生物与电极之间的电子转移行为明显减少,表明施加+0.1V(vs. Ag/AgCl)电势可能对电极上微生物呼吸生长有抑制作用.
还原态氧化石墨烯;电极电势;腐败希瓦氏菌;电子转移
微生物在呼吸过程中将产生的电子转移给细胞外的电子受体,该过程称之为胞外电子转移(Extracellular electron transfer, EET)[1].由于EET过程涉及到电子的得失,与环境介质中污染物的还原和降解等过程联系密切,因此对生物地球化学、环境保护和能源利用等领域具有重要的参考意义.目前希瓦氏菌属和地杆菌属是最具代表性的两种模式微生物.研究表明希瓦氏菌可以通过膜外c型色素蛋白(OMCs)进行直接的电子转移(Direct electron transport, DET),和通过自分泌氧化还原介质(如核黄素)进行间接的电子转移(Mediated electron transport, MET)[2-3].地杆菌属,如硫还原地杆菌()只能通过唯一的直接电子转移路径进行胞外电子传递[4].胞外电子传递的过程受很多因素影响,除菌属外最重要的两个因素是电极材料和电极电势[5-6].理想的电极要求对细菌有良好的生物相容性[7],能够满足多种传递路径实现电子转移,同时电极要有大的比表面积来负载更多的微生物量[8],考虑到经济成本等问题,电极一般使用经济廉价材料[9].Yuan等[10]采用微生物催化还原氧化石墨烯(GO)得到的石墨烯框架结构促进细胞外电子转移,这种石墨烯框架结构的存在有利于电极上形成活性生物膜.Yong等[8]构建了一个自组装三维还原氧化石墨烯与细菌杂化的生物膜,这种生物膜实现了MR-1和电极之间的双向电子转移.通过微生物催化还原形成的石墨烯能增强“微生物-电极”间的相互作用,促进电子的转移,但电极的电化学活性有明显的延后现象.此外,电极电势的运用对微生物在电极表面的附着和生物膜的形成也有显著影响.有研究表明施加正电势有利于微生物获得驱动力向电极表面附着[11-12],但可能对电极表面的生物群落组成有影响[13].在电极电势作用下,细菌胞外活性物质的表达存在显著差异[14-15],生物膜电极上也呈现不同的电子转移机制[16].石墨烯在不同时间段对电极的修饰,以及外电势施加的影响对腐败希瓦氏菌与碳毡电极相互作用过程中的电化学特征还少有研究.
因此,在不同条件下(氧化石墨烯(GO)添加的不同时间、电极电势的施加)对腐败希瓦氏菌呼吸驱动产生的自组装三维还原态石墨烯(br-GO)修饰的电极,以及微生物与br-GO修饰的电极之间的相互作用过程对胞外电子传递的影响还值得进一步深入研究.基于此,本文探究了不同条件下的br-GO修饰的碳毡电极的生物电化学活性以及“微生物-电极”之间的电子传递特征.研究结果为认识腐败希瓦氏菌与生物膜电极之间的相互作用特性提供了见解,为今后开发制备高活性生物膜电极提供了更多的思路.
1 材料与方法
1.1 细菌培养和生物膜形成
腐败希瓦氏菌(ATCC 8071)接种到电化学电池之前,先在灭菌LB培养基中32℃和150r/min好氧培养12h,至吸光度OD600接近1.0.菌液经过离心得到肉红色细菌球粒,说明培养成功.然后使菌体重新悬浮于100mL电解液(5%的LB培养基和95%的M9缓冲溶液,包含18mmol/L的乳酸钠).LB培养基成分为:蛋白胨(10g/L),酵母膏(5g/L),NaCl (5g/L),并用5mol/L NaOH调节pH接近7.0.M9缓冲液成分为:Na2HPO4(6g/L),KH2PO4(3g/L), NH4Cl(1g/L),NaCl(0.5g/L),MgSO4(1mmol/L),CaCl2(0.1mmol/L).为了形成电化学活性生物膜.细菌细胞悬浮液被转移至单室三电极系统中,然后在悬浮液中加入11mL GO分散液(1g/L),即在反应器中得到GO浓度为0.1g/L.在三电极体系下,浸没于电解液的碳毡(1cm×2cm)作为工作电极,且用于细菌的附着形成生物膜,银/氯化银电极(Ag/AgCl/KCl sat.)作为参比电极,铂丝用于对电极.单室反应器通氮气20min以保证厌氧环境,然后密封反应器,在恒温32℃水浴,50r/min的磁力搅拌下观察生物膜形成.相同条件下,11mL GO分散液(1g/L)在生物膜自然生长后的第26h添加设置对照试验(CF/GO/26h).同时,在相同条件下,11mL GO分散液(1g/L)在起始时刻添加,且工作电极上施加+0.1V(vs. Ag/AgCl)电势,设置实验组(CF/GO/+0.1V).自然生长的电极生物膜是在不施加任何电势和不添加GO的条件下形成,作为空白对照(CF).这样,即CF/GO、CF/GO/26h、CF/GO/ +0.1V、CF四个实验组.
1.2 电化学测量
单室反应器中,微生物在GO修饰的电极上生长,包括CF/GO、CF/GO/26h,以及微生物在未经GO修饰的电极(CF)上自然生长,工作电极上均不施加电势,仅用数据采集卡记录工作电极与参比电极间的电势差,观察电势差变化,以此来反映电极上生物膜的生长情况.而在CF/GO/+0.1V实验组上,采用CHI 660E(上海辰华公司)型电化学工作站在三电极体系下对工作电极施加+0.1V电势,观察电流对时间(i-t曲线)的变化趋势,以此来反映电极上生物膜的生长情况.循环伏安(Cyclic voltammetry, CV)通过CHI 660E型电化学工作站在三电极体系下测试.CV测试在10mV/s的扫描速率下进行,电压扫描范围为-0.8V~0.7V.
1.3 生物膜电极与br-GO的表征
单室反应器电解液中的黑色絮状体br-GO通过过滤,3次水洗和离心,冷冻干燥获得固体br-GO,用于XRD检测.电解液中过滤获得的未经离心清洗的br-GO用2.5%戊二醛固定24h然后不同梯度乙醇(25%,50%,75%,85%,95%,100%)脱水,室温干燥,用于SEM检测.生物膜电极(碳毡)同样用戊二醛固定,乙醇脱水,干燥后做SEM表征.
2 结果与讨论
2.1 微生物自组装三维还原态石墨烯(br-GO)和br-GO修饰电极的表征
由于微生物的呼吸驱动,棕黄色电解液约在48h后完全变为黑色絮状混合液,表明水溶性GO(棕黄色)被还原为br-GO絮状体(黑色),图1E和F显示了br-GO是一个三维的大孔径分层结构.如图1A所示,未修饰的自然生长的生物膜电极表面较为光滑,仅有少量的细菌附着在上面.与自然生长的生物膜相比,CF/GO与CF/GO/26h电极表面几乎被微生物呼吸驱动下形成的br-GO所覆盖(图1B,D),呈现出一种三维立体结构,使得电极表面具有更大的比表面积,富集了更多的细菌,因此有利于活性生物膜在电极表面的形成.图1C中CF/GO/+ 0.1V电极上虽然也被三维br-GO覆盖但附着的细菌相对较少,表明这种电极电势的施加不利于电极修饰过程的进行.电极上微生物菌落结构呈现不同的形态,将会导致生物膜电极的电化学活性显现较大差异.

图1 不同膜电极和br-GO的SEM图
(A) CF, (B) CF/GO, (C) CF/GO/+0.1V, (D) CF/GO/26h, (E) br-GO and (F) br-GO
XRD图谱显示,纯石墨粉在26.5°左右有一个强度很高很尖锐的峰(图2A),这是石墨晶面典型的衍射峰.由Hummers法[17]制备的GO的XRD图谱显示在2=11°左右出现了比较尖锐的衍射峰,由布拉格方程(Bragg’slaw)2sin=得GO的层间距为0.8nm(=1)[18].GO被微生物催化还原形成的br-GO,其XRD图谱显示11°左右的GO衍射峰消失,而在22.6°左右出现了一个比较宽泛的衍射峰,它的层间距为0.39nm.衍射峰的变化和层间距的减小表明GO在微生物呼吸驱动下被催化还原成了br-GO[19].
2.2 修饰过程中电极的生物电化学参数特征
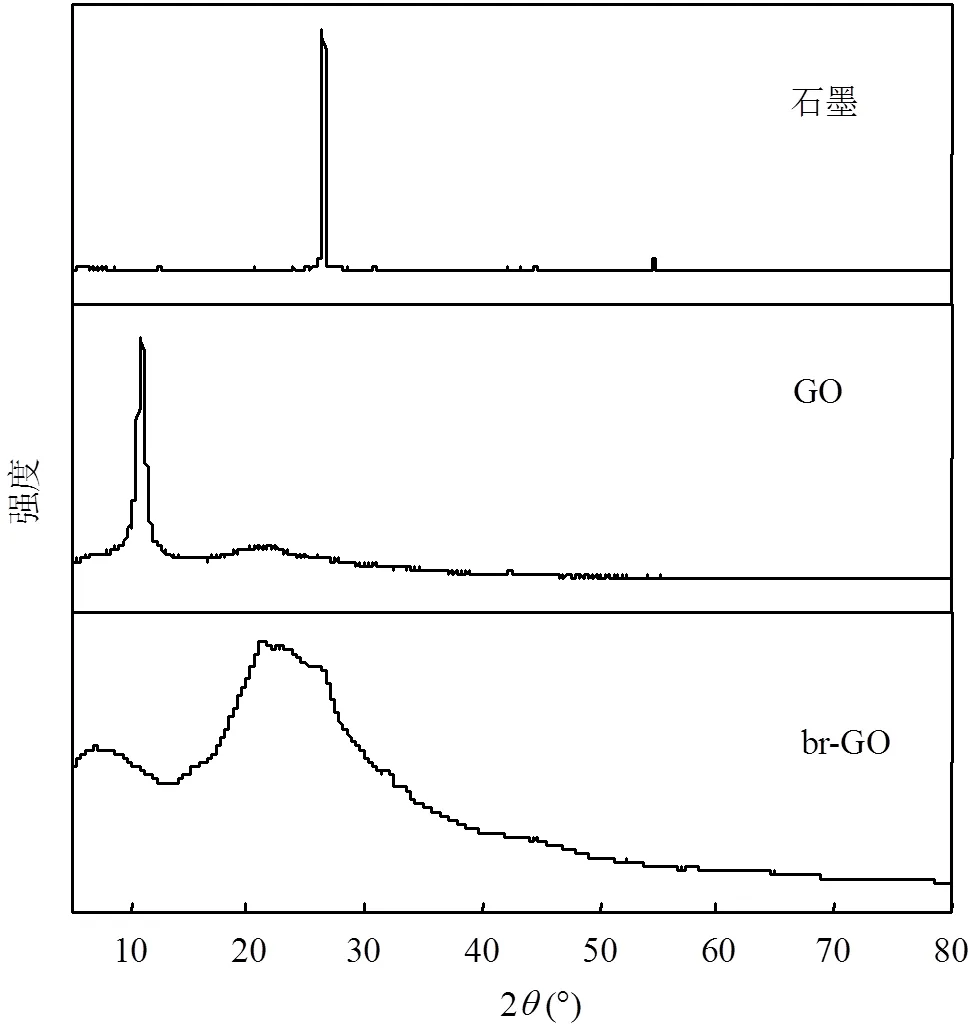
图2 石墨,GO和br-GO的XRD图谱
如图3A所示,经过GO修饰的电极(CF/GO, CF/GO/26h)电势差输出值与未修饰电极(CF)电势差输出值的变化趋势存在较大差异.CF/GO电极上电势差随时间不断地持续增大且最终稳定在0.51V (vs. Ag/AgCl)左右;CF/GO/26h电极上电势差在GO加入之后反映出了与CF/GO类似的增长变化趋势,且最终达到了最大值约为0.47V(vs. Ag/AgCl);而CF的电极上电势差变化趋势非常平缓,始终处于较低的水平,且最大的电势差输出值不超过0.1V(vs. Ag/AgCl).GO修饰的电极(CF/GO, CF/GO/26h)电势差输出值的变化可以反映出,自组装三维br-GO修饰的电极表面富集越来越多的微生物,这些微生物细胞利用基质在呼吸的过程中释放出大量电子,使得电极表面积累的电子密度增加从而使电势差上升.图3A也反映出,在生物膜自然生长后的第26h添加GO,电势差输出值突然下降,从原来的0.125V左右降低至0.1V以下,这是因为添加GO后微生物释放的电子有一部分被GO抢夺用于将其还原成br-GO[19],使得微生物与电极间电子传递减弱,但是随后br-GO负载到电极上促使了微生物与电极间的电子传递.有研究表明br-GO生成的初期会对微生物产生抗菌性[20],因为CF/ GO/26h的电极表面已经形成了初步的生物膜,微生物细胞膜外分泌聚合物避免br-GO颗粒对细菌细胞造成损害[21],所以经GO修饰以后CF/GO/26h电极的生物相容性仍然较好,电极的生物电化学活性逐渐增强.同时值得注意的是第26h添加GO,微生物的适应时间(约5h)比起始添加GO(约10h)要缩短近一半,这也是因为CF/GO/26h体系下微生物在前26h在电极上自然生长逐步形成了有活性的稳定菌落.
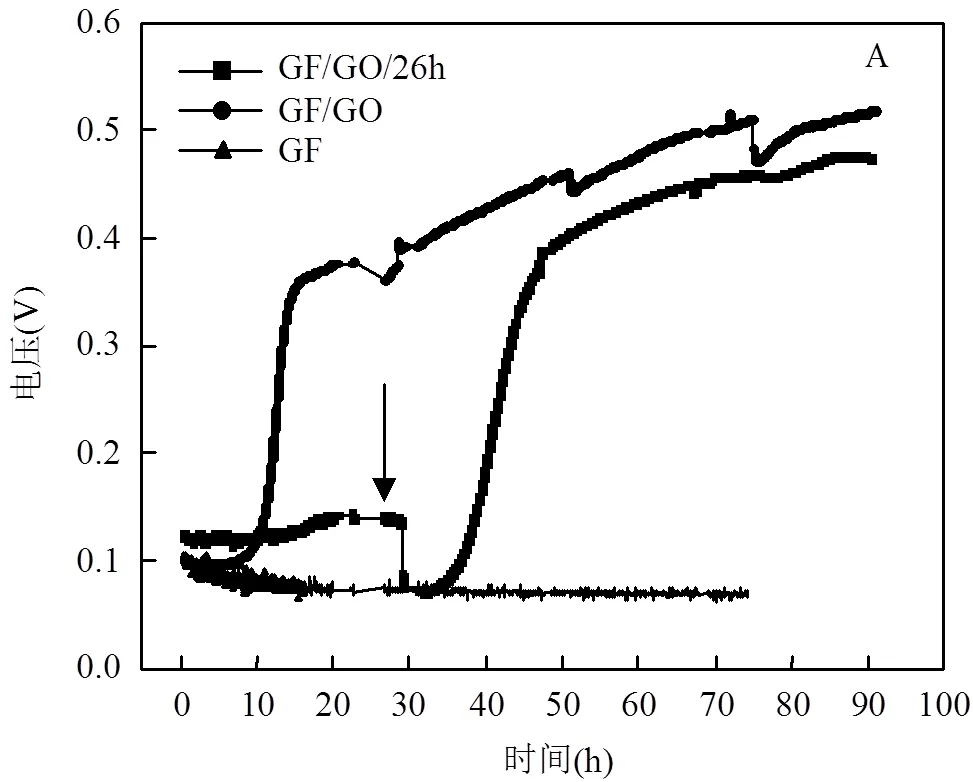
如图3B所示,CF/GO/+0.1V电极上施加+0.1V (vs. Ag/AgCl)电势产生的反应电流变化微弱,电流输出值接近于背景值.这表明在GO修饰的电极施加+0.1V(vs. Ag/AgCl)电势,不利于GO对碳毡电极的修饰过程,GO修饰作用对电极电化学性能改善没能充分表现出来,故与未经修饰电极有相似的生物参数特征.虽然电极上施加正电势有利于细菌(通常带负电荷)向电极的富集,但是过高的正电势可能会对微生物生长有抑制作用[22],也有研究表明过高的正电势使微生物细胞外进行直接电子转移的色素蛋白被氧化[23],从而抑制电子传递过程.
2.3 br-GO修饰电极的生物电化学的循环伏安法表征及其与微生物之间电子传递特征
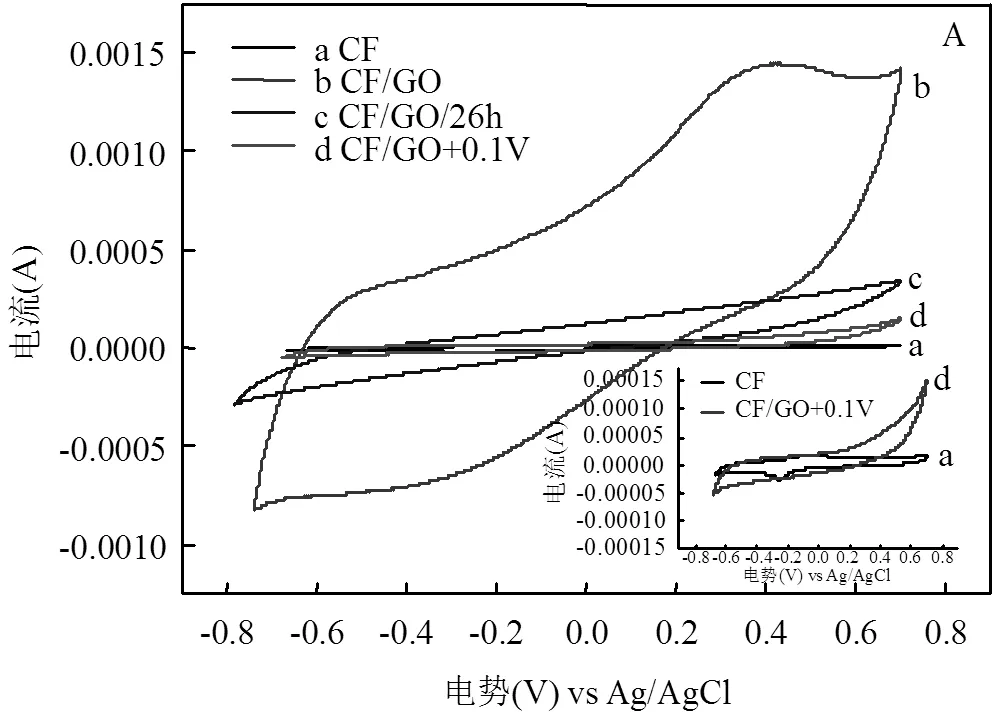
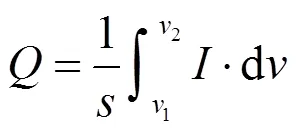
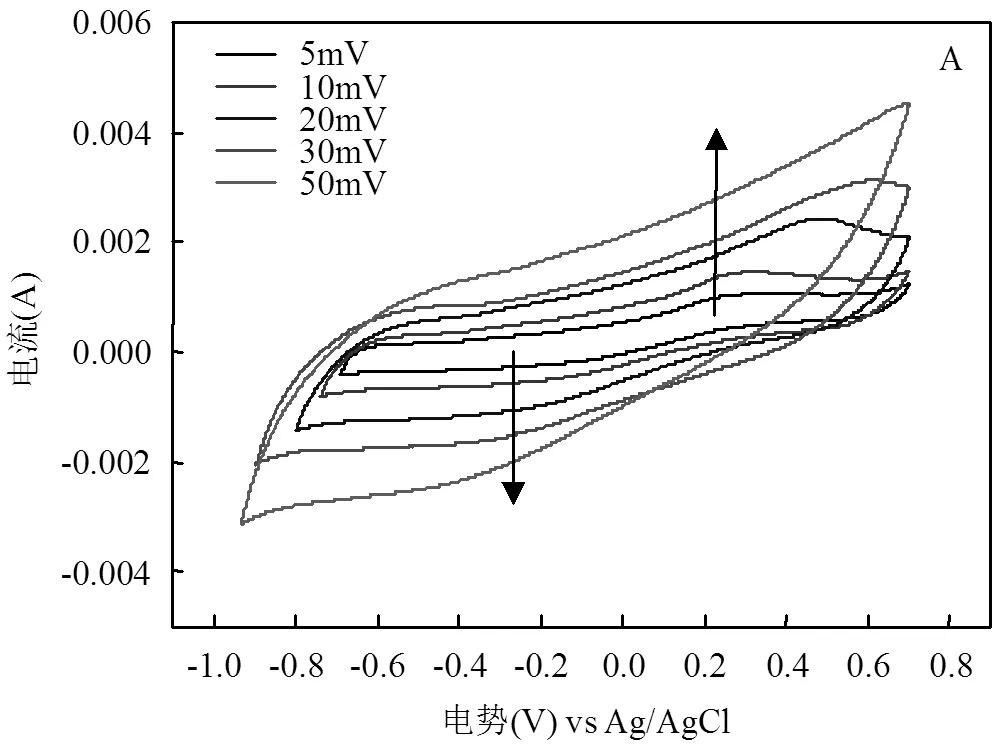
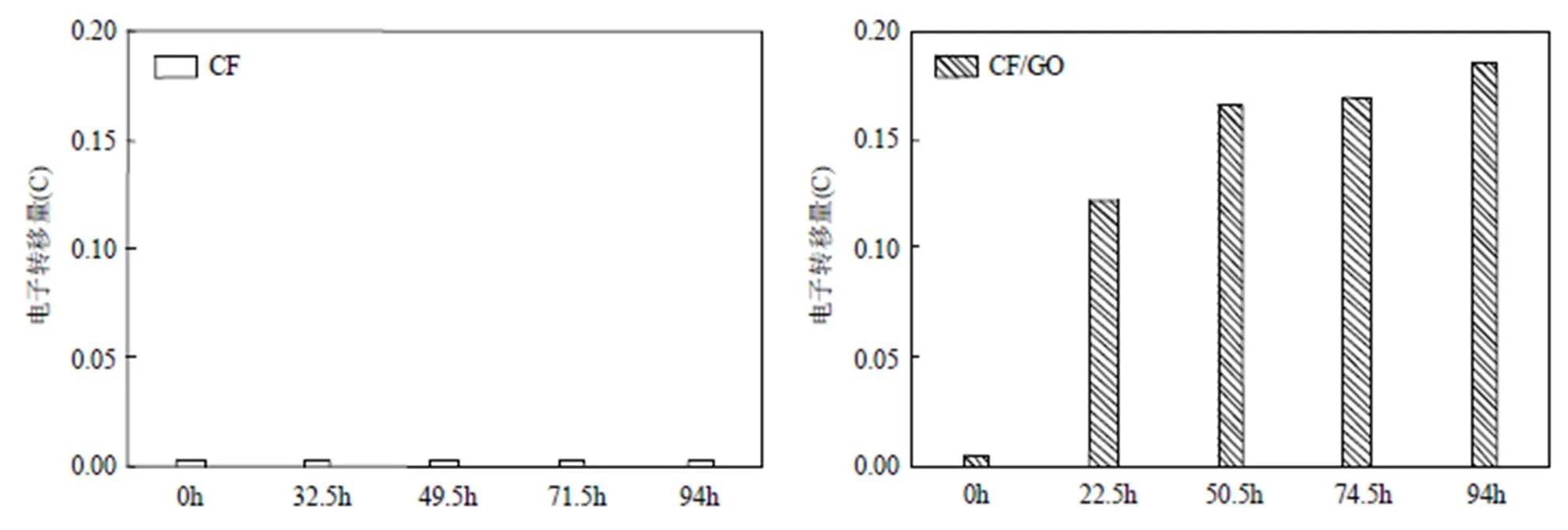
图6和图7所示为生物膜生长过程中各个时间节点上的CV曲线及电子转移量的变化,反映了微生物与电极间的电子转移的变化趋势.由图可知,生物膜自然生长(CF)的CV曲线变化微弱,电子转移量始终较小,说明微生物与电极间的电子转移活动始终处于较弱状态.其CV曲线上始终出现氧化还原峰,从峰的强度可以看出49.5h左右电极上微生物活性最强.文献研究表明氧化还原峰为电子转移的特征峰,能够反映电极上的电子传递形式,CV测试在不同扫描速率下的氧化还原峰电流与扫描速率或扫描速率的平方根的线性关系(图5B),表明其峰电流与扫描速率呈线性关系,电极界面反应过程受吸附控制,其峰电流也与扫描速率的平方根呈正比关系,电极界面反应过程受扩散控制,表明了CF电极上的电子转移为直接和间接方式传递的[9].在图6B中CF/GO电极的CV曲线变化十分显著,电子转移量得到明显提高,表明微生物与电极间的电子转移为明显增强的过程,22.5h因3D br-GO在电极表面原位形成,CV的响应电流显著增大,微生物呼吸的定向电子传递过程得以启动.CF/GO/26h体系下,在添加GO修饰之前其CV曲线基本不变(图6C),但是在GO加入之后,CV曲线的环绕面积逐渐增大,反映了GO对电极的修饰使得微生物与电极间的电子转移得到增强.添加GO之前,CV曲线上出现了一个氧化还原峰,而添加GO后CV曲线上氧化还原峰不再明显被观察到,这与前述所得结果是一致的.图6D中反映的CF/GO/+0.1V电极CV曲线变化较小,响应电流仅有轻微的增加,其电极的电化学活性远没有CF/GO强,这进一步表明在施加+0.1V电势下微生物与电极间的电子传递受到了抑制.在0h时刻,CV曲线上出现了一对氧化还原峰(-0.25V和-0.1V附近),反映了初期电极上存在有关电子转移的活性物质,在后续经GO修饰和施加+0.1V条件下,该活性物质的特征氧化还原峰消失,这与br-GO本身特性和色素蛋白被电势氧化而失去电子传递能力有关.

图6 不同电极在不同反应时间的CV曲线(A)CF,(B)CF/GO,(C)CF/GO/26h,(D)CF/GO+0.1V
Fig.6 Cyclic voltammetry curvesof different bio-electrodes at different reaction times.(A) CF,(B) CF/GO, (C) CF/GO/26h,(D) CF/GO+0.1V
3 结论
3.1 经GO修饰的电极比表面积增加,生物负荷量增多,形成了高活性电化学生物膜,促进了胞外电子传递.GO修饰使微生物与电极间相互作用增强是由于微生物呼吸驱动催化还原生成的br-GO,它显示了良好的物理化学特性.
3.2 在起始时加GO更有利于自组装三维br-GO结构在原位的形成,生物电极上富集的细菌更多,微生物与电极间表现出更为活跃的电子传递活动,生物膜电极的电化学活性强.添加GO后电极的生物电化学活性在生物膜生长初期存在明显的滞后现象,这归咎于微生物释放的电子有一部分被GO抢夺用于将其还原成br-GO,使得微生物与电极间电子传递减弱,但是随后br-GO负载到电极上促使了微生物与电极间的相互作用.
3.3 +0.1V(vs. Ag/AgCl)电极电势的应用,不利于GO对碳毡电极的修饰过程,抑制了电极上活性微生物的生长,影响了电子转移过程,微生物与电极间相互作用减弱.
[1] Logan B E, Regan J M. Electricity-producing bacterial communities in microbial fuel cells [J]. Trends in Microbiology, 2006,14(12):512- 518.
[2] Xiong Y, Shi L, Chen Bet al. High-affinity binding and direct electron transfer to solid metals by the shewanella oneidensis MR- 1outer membrane c-type cytochrome omca [J]. Journal of the American Chemical Society, 2006,128(43):13978-13979.
[3] Harald von Canstein J O, Sakayu Shimizu, and Jonathan R. Lloyd. Secretion of flavins by shewanella species and their role inextracellular electron transfer [J]. Applied and Environmental Microbiology, 2008,74(3):615-623.
[4] Dolch K, Danzer J, Kabbeck Tet al. Characterization of microbial current production as a function of microbe–electrode-interaction [J]. Bioresource Technology, 2014,157:284-292.
[5] Yu F, Wang C, Ma J. Applications of graphene-modified electrodes in microbial fuel cells [J]. Materials, 2016,9(10):807.
[6] Grobbler C, Virdis B, Nouwens Aet al. Effect of the anode potential on the physiology and proteome of shewanella oneidensis mr-1 [J]. Bioelectrochemistry, 2018,119:172-179.
[7] Ci S, Cai P, Wen Zet alGraphene-based electrode materials for microbial fuel cells [J]. Science China Materials, 2015,58(6):496-509.
[8] Yong Y C, Yu Y Y, Zhang X Het alHighly active bidirectional electron transfer by a self-assembled electroactive reduced- graphene-oxide-hybridized biofilm [J]. Angewandte Chemie International Edition, 2014,53(17):4480-4483.
[9] Yuan H, He Z. Graphene-modified electrodes for enhancing the performance of microbial fuel cells [J]. Nanoscale, 2015,7(16):7022- 7029.
[10] Yuan Y, Zhou S, Zhao B,et al. Microbially-reduced graphene scaffolds to facilitate extracellular electron transfer in microbial fuel cells [J]. Bioresource Technology, 2012,116:453-458.
[11] Kumar A, Siggins A, Katuri Ket al. Catalytic response of microbial biofilms grown under fixed anode potentials depends on electrochemical cell configuration [J]. Chemical Engineering Journal, 2013,230:532-536.
[12] Srikanth S, Venkata Mohan S,Sarma P N. Positive anodic poised potential regulates microbial fuel cell performance with the function of open and closed circuitry [J]. Bioresource Technology, 2010,101(14): 5337-5344.
[13] Torres C I, Krajmalnik-Brown R, Parameswaran Pet alSelecting anode-respiring bacteria based on anode potential: Phylogenetic, electrochemical, and microscopic characterization [J]. Environmental Science & Technology, 2009,43(24):9519-9524.
[14] Wagner R C, Call D F, Logan B E. Optimal set anode potentials vary in bioelectrochemical systems [J]. Environmental Science & Technology, 2010,44(16):6036-6041.
[15] Zhu X, Yates M D, Hatzell M Cet alMicrobial community composition is unaffected by anode potential [J]. Environmental Science & Technology, 2014,48(2):1352-1358.
[16] Pinto D, Coradin T, Laberty-Robert C. Effect of anode polarization on biofilm formation and electron transfer in shewanella oneidensis/ graphite felt microbial fuel cells [J]. Bioelectrochemistry, 2018,120: 1-9.
[17] Hummers W S, Offeman R E. Preparation of graphitic oxide [J]. Journal of the American Chemical Society, 1958,80(6):1339-1339.
[18] Gurunathan S, Han J W, Kim E Set alReduction of graphene oxide by resveratrol: A novel and simple biological method for the synthesis of an effective anticancer nanotherapeutic molecule [J]. International Journal of Nanomedicine, 2015,10:2951-2969.
[19] Deng F,Sun J, Hu Y Y, et al. Biofilm evolution and viability during in situpreparation of a graphene/exoelectrogencomposite biofilm electrode for a high-performance microbial fuel cell [J]. RSC Advances, 2017,7:42172-42179.
[20] 陈 洁,孙 健,胡勇有.石墨烯修饰电极微生物燃料电池及其抗菌性研究进展 [J]. 环境科学学报, 2016,36(2):387-397.Chen J, Sun J, Hu Y Y. Recent advances in microbial fuel cells with graphene-modified electrodes and the antibacterial activity of graphene. [J]. Acta Scientiae Circumstantiae, 2016,36(2):387-397.
[21] Chen J, Hu Y Y, Tan Xet alEnhanced performance of microbial fuel cell with in situ preparing dual graphene modified bioelectrode [J]. Bioresource Technology, 2017,241:735-742.
[22] Wang X, Feng Y, Liu Jet alPerformance of a batch two-chambered microbial fuel cell operated at different anode potentials [J]. 2011, 86:590-594.
[23] A. T M, T. A L. Oxidizing electrode potentials decrease current production and coulombic efficiency through cytochrome c inactivation in shewanella oneidensis mr-1 [J]. Chem. Electro. Chem, 2014,1(11):2000-2006.
[24] Kang J, Kim T, Tak Yet al. Cyclic voltammetry for monitoring bacterial attachment and biofilm formation [J]. Journal of Industrial and Engineering Chemistry, 2012,18(2):800-807.
[25] Virdis B, Dennis P G. The nanostructure of microbially-reduced graphene oxide fosters thick and highly-performing electrochemically-active biofilms [J]. Journal of Power Sources, 2017,356:556-565.
[26] Carmona-Martínez A A, Harnisch F, Kuhlicke Uet al. Electron transfer and biofilm formation of shewanella putrefaciens as function of anode potential [J]. Bioelectrochemistry, 2013,93:23-29.
[27] 黄力华,李秀芬,任月萍,等.石墨烯掺杂聚苯胺阳极提高微生物燃料电池性能 [J]. 环境科学, 2017,38(4):1717-1725. Huang L H, Li X F, Ren Y P, et al. Performance improvement of microbial fuel cell with polyanilinedoppedgraphene anode [J]. Environmental Sciences, 2017,38(4):1717-1725.
[28] Kokko M E, Mäkinen A E, Sulonen M L Ket alEffects of anode potentials on bioelectrogenic conversion of xylose and microbial community compositions [J]. Biochemical Engineering Journal, 2015, 101:248-252.
Electrochemical characteristics of microbe reduced graphene modified carbon felt electrodes.
ZHENG Fei1,2, ZHU Wei-huang1,2*, GAO Hao-xiang1,2
(1.Key Laboratory of Environmental Engineering, Shaanxi Province, Xi’an University of Architecture and Technology, Xi’an 710055;2.Key Laboratory of Northwest Water Resource, Environment and Ecology, Ministry of Education, Xi’an University of Architecture and Technology, Xi’an 710055)., 2019,39(2):823~830
In the current study, electrochemical characteristics of interaction betweenATCC 8071 and self-assembled 3D bio-reduced GO (3D-br-GO) modified carbon felt electrodes driven by biological respiration were investigated, and the effect of +0.1V (vs. Ag/AgCl) potential applied to the bioelectrode on the interaction was further explored. X-ray diffraction showed that GO was reduced to br-GO driven by microbial respiration. SEM images showed a large number of br-GO/bacteria composites shaped on the GO-modified electrode surface, which indicated that the br-GO had good biocompatibility, and the self-assembled 3D-br-GO modified electrode could increase its specific surface area and bacterial loading capacity. By monitoring of electricity production during biofilm growth, and testing of cyclic voltammetry, the results showed that the modification of GO was beneficial for the bacteria to attach onto the electrode in order to form active biofilm and enhanced the electron transfer between microbe and electrode. Whereas, the applied potential of +0.1V (vs. Ag/AgCl) on the GO modified electrode resulted in only a small quantity of bacteria colonized on the electrode, and no formed active biofilm. The electron transfer behavior between the microbe and the electrode was significantly reduced, indicating that the applied potential of +0.1V (vs. Ag/AgCl) may inhibit the growth of microorganisms on the electrode surface.
br-GO;electrode potential;;electron transfer
X172
A
1000-6923(2019)02-0823-08
郑 飞(1992-),男,安徽池州人,西安建筑科技大学硕士研究生,主要从事微生物燃料电池电极修饰电化学特征研究.
2018-07-05
国家自然科学基金资助项目(41373093)
*责任作者, 教授, zhuweihuang@xauat.edu.cn

