运用酸碱质子理论推写强制弱类化学方程式
包兴隆
(浙江省金华市东阳市外国语学校 321000)
在化学领域也存在弱肉强食的丛林法则,在化学反应中“以强制弱”现象尤为普遍.如在复分解反应中,以强酸(强碱)制弱酸(弱碱)、难挥发性物质制易挥发性物质、溶解度大的物质制溶解度小的物质、强电解质制弱电解质;在氧化还原反应中,强氧化剂(强还原剂)制弱氧化剂(弱还原剂);在竞争型的离子反应中,化学性质强的物质之间在同等条件下优先发生化学反应.
其中有关强酸制弱酸规律的应用,尤其是化学方程式的书写学生往往困惑重重.
一、学生存在的困惑
1.CO2通入到CaCl2、BaCl2等盐溶液中为什么无现象;
2.CO2通入到苯酚钠溶液中为什么只能生成NaHCO3;
3.CO2通入到NaAlO2溶液中为什么可生成NaHCO3和Na2CO3.
其实就是要理清:①微粒间能否发生反应;②反应后生成微粒是什么(单一还是多种可能).
二、运用酸碱质子理论推写方程式
1.理论依据
酸碱质子理论认为:凡是可以释放质子(氢离子、H+)的分子或离子为酸,凡是能接受质子的分子或离子则为碱.

2.以S、C相关微粒为例推写化学方程式
结合酸碱质子理论可以将下列物质分类(见表1).
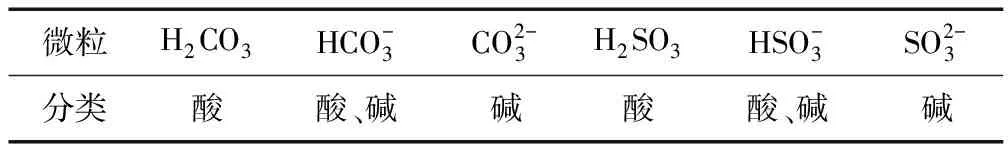
表1
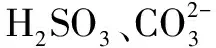
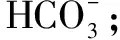

表2
综上所述,微粒间能否发生强酸制弱酸反应,反应后微粒的存在状态是否与物质用量有关,还是要紧抓微粒间的相对的酸性强弱关系,具体情况具体分析.
三、以强酸制弱酸规律的反常情况
1.发生氧化还原反应导致逆向反应.如:



2.生成难溶、难电离、易挥发的物质导致逆向反应.如:

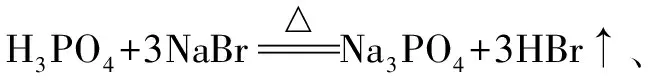

Pb(CH3COO)2+2HNO3.
总之,在课堂教学的过程中要始终保持辩证的观点去分析解决问题.防止学生形成思维定势,培养学生的创新思维.
从反应自发性分析,以强制弱是物质性质、能力等从强转弱自发进行的过程;从离子浓度变化分析,以强制弱是溶液内部争夺离子的过程.
虽然化学反应繁多复杂,学习比较困难,但仍有条理、顺序、结构,遵循着一定的变化规律.当面临竞争型离子方程式书写、电离水解平衡、沉淀溶解平衡和电化学等复杂问题时,用以强制弱的规律辩证的分析解决问题效果会事半功倍.只要把握好规律,就能掌握各类反应的应对诀窍,为学好化学打下坚实的基础.

