低剂量氚照射对仔鼠中枢神经系统的影响及其机理研究
王 冰,吕慧敏,刘玉龙,高卫民,王春燕,董金婵,张 伟,陈炜博
(1. 中国医学科学院放射医学研究所,天津,300192;2.中国疾病预防控制中心辐射防护与核安全医学所,北京,100088;3. 苏州大学附属第二医院,江苏 苏州,215004)
0 引言
随着世界能源需求不断增长,核电作为清洁能源具有广阔的发展前景。中国目前是全球核电发展最快的国家。截至2019年2月,我国大陆在运行核电机组达到45台。我国能源发展“十三五”规划中提出“到2020年运行核电装机力争达到5 800万千瓦,在建核电装机达到3 000万千瓦以上”。至此,我国已然跻身于核电大国,核电甚至成为了我国核技术应用领域的“国家名片”之一。同时,核技术在国民经济各个领域的应用也十分广泛。核能的发展和核技术的广泛应用造福于人类的同时,也给人类带来了灾难和危险。前苏联切尔诺贝利核电站事故(1986.04)和日本福岛核事故(2011.03)后,人们已经行动起来,在避免或減少核与辐射事故的发生方面做了大量工作,全方位提高了核能安全水平,核应急工作日益紧迫。
随着核聚变的快速发展,重要核素氚的环境排放量增加以及在各领域的广泛应用,增加了人们受到氚照射的机会。环境中的氚主要以氚水形式存在,氚水可通过食物链、呼吸和皮肤接触等途径进入人体造成危害。进入母体后的氚可通过胎盘和乳汁无阻挡地进入胚胎、胎儿和新生子代的脑组织,氚宫内照射对子代可能产生的生物效应很难得到人的资料,故实验动物的研究成为本领域的重要课题[1-2]。
在进行《低剂量氚照射对仔鼠中枢神经系统的影响及其机理研究》项目研究期间(1988—2002),连续获得1项国家自然科学研究基金、3项卫生部科学研究基金及3项卫生部工业卫生实验所所长基金资助。本研究超额完成了基金规定的内容[3-7]。研究结果汇总如下。
1 实验材料
1.1 实验动物
(1) Wistar大鼠:10周龄,体重250±10 g,北京医科大学动物部提供。动物合格证号:医动字第01-3056,1995。
(2) C57BL/6J小鼠:10周龄,体重22±2 g,中国预防医学科学院微生物流行病研究所提供。动物合格证号:医动字第01-3059号,1995。
(3) ICR小鼠胚胎:11天龄。
1.2 辐射源
(1)氚水:中国科学院上海原子能所提供,用蒸馏水稀释后,经Pharmacia WALLAC 1410型液闪标定。
(2)有机结合氚(OBT):3H-胸腺嘧啶核苷(3H-TdR),从NEN购买。
1.3 主要仪器
液闪标定仪,Pharmacia WALLAC 1410型,瑞典;γ计数仪,FJ2003/50型;Y型迷宫,60 cm×45 cm×15 cm,电网连接220 V电源,TDGC调压器;YL3型回转式切片机,上海仪表厂;二氧化碳培养箱,Baxter USA;微电极拉制仪,Sachs-Flaming PC-84,USA;微电极抛光仪,Narishige Scientific Instrument Lab,Japan;倒置显微镜,Olympus;解剖显微镜,Carlzeiss,West Germany;膜片钳记录和分析软件,P-clamp 5.5.1;放大器和Pclamp接口,TL-Ⅰ Axon Instruments;X射线机,Pantak 320S,Kanda;Nishikicho 2 Chome, Japan;FACSCalibur流式细胞仪,Becton Dickinson Immunocytometry Systems,USA。
1.4 主要试剂
RIA放免药盒,中国人民解放军总后科工委科盾新技术开发公司提供;胰蛋白酶,新疆化学试剂厂;马血清,军事医学科学院放射医学研究所提供;MEM,Gibco,USA;Hepes和谷氨酰胺,Sigma;河豚毒(TTX),秦皇岛市水产品研究所;焦油紫,北京医科大学神经解剖教研室提供;苦味酸,广东介山化工厂;DNA marker,Gibco BRL;羊多克隆抗p53抗体,USA;兔抗羊IgG抗体,USA。
2 实验方法
2.1 照射
Wistar大鼠雌鼠与同龄雄鼠1∶1合笼过夜12 h,次日晨以检查到阴栓定为妊娠零天。孕龄13 d按体重随机分为3个实验组和1个对照组,实验组腹腔一次性注入氚水,对照组腹腔一次性注入蒸馏水。
C57BL/6J小鼠雌鼠与同龄雄鼠2∶1合笼过夜12 h,次日晨以检查到阴栓确定为妊娠零天。孕龄12.5 d按体重随机分为3个实验组和1个对照组,实验组腹腔一次性注入氚水,对照组腹腔一次性注入蒸馏水。
Wistar大鼠和C57BL/6J小鼠的3个实验组注入氚水活度分别为24.09×104(低剂量组)、48.18×104(中剂量组)和144.54×104Bq/g(高剂量组)。以下文中分别以低剂量组、中剂量组、高剂量组说明。
3H-TdR用DMEM10稀释调节到浓度为21.0 kBq/mL。在ICR小鼠11天龄胚胎MBC培养基中,加入含有HTO的DMEM10(5.616 MBq/mL),培养20 h,进行氚β射线照射,细胞核受氚照射剂量为0.42 Gy。
2.2 组织氚活度测量
动物经麻醉或脱颈处死,采集生物样品,样品称重并处理后,用液闪测定总氚活度。
2.3 组织水分含量测定[8-10]
采用冷冻干燥法。妊娠小鼠、胎儿、哺乳小鼠和新生仔鼠体内水分含量的平均值分别是82%、96%、78%和81%。
2.4 氚生物半衰期的计算
动物湿组织中总氚生物半衰期(Tb)是通过氚存留曲线计算的,即收集组织样品时氚活度与注射氚活度的百分比。单次腹腔注入氚水,妊娠和哺乳小鼠的Tb值分别是1.59和1.69 d,成年雄性和雌性小鼠的Tb值分别是1.96和2.06 d[8-9]。
2.5 仔鼠氚剂量估算
胎儿体内水含量几乎占100%。孕鼠单次腹腔注射氚水后,仔鼠体内总氚累积吸收剂量(DT)应为宫内胎儿接受氚照射的吸收剂量(DF)和出生后某一时期氚吸收剂量(DN)的总和。此时,通过乳汁和有机结合氚的剂量可以忽略。氚水照射后10天,24.09×104、48.18×104和144.54×104Bq/g照射组的子代小鼠剂量分别为0.036、0.071和0.213 Gy;子代大鼠的剂量分别为0.044、0.088和0.264 Gy[10-15]。
培养的ICR小鼠11天龄胚胎受氚照射的剂量为1.68 Gy[16]。
2.6 妊娠和哺乳期氚分布和转移[11-14]
妊娠第一天的小鼠按每克体重单次腹腔注射氚水,活度为1.82×105Bq, 收集妊娠鼠及胎儿的组织器官样品并测量氚浓度。
哺乳第一天的小鼠按每克体重单次腹腔注射氚水,活度为1.85×105Bq。怀孕不同时间的孕鼠单次腹腔注射氚水,分别采集分娩后3.5 d的哺乳鼠和受乳鼠的生物样品,并测量氚活度。
2.7 生物学指标[18-33]
2.7.1仔鼠生长发育和生理标志
检查指标包括张耳、开眼、出牙、睾丸下降、阴道张开。
张耳:仔鼠双耳张开呈完全直立位为达标。从出生后第3天龄开始检测并记录达标天龄,直到全部仔鼠达标。
开眼:仔鼠双眼被膜处同时可见裂隙即为达标。从出生后第10天龄开始检测并记录达标天龄,直到全部仔鼠达标。
出牙:仔鼠有一颗门齿长出牙床突破牙龈即为达标。从出生后第9天龄开始检测并记录达标天龄,直到全部仔鼠达标。
睾丸下降:抓住雄性仔鼠前肢垂直放置,睾丸降到阴囊(可以触及)即达标。从出生后第19天龄开始检测并记录达标天龄,直到全部仔鼠达标。
阴道张开:仔鼠阴唇向旁拉开时可见膜开口即为达标。从出生后第25天龄开始检测并记录达标天龄,直到全部仔鼠达标。
2.7.2仔鼠新生反射和感觉功能
检查指标包括断崖回避、平面翻正、负趋地性、空中翻正、抓握反射、听觉惊愕、视觉定位、趋母性试验、痛觉反应潜伏期的测定。
断崖回避:将小鼠的头向前置于台面边缘,3 s内躯体纵轴转过90°为阳性,连续3次呈阳性反应为达标。从出生后第3天龄开始检测并记录达标天龄,直到全部的仔鼠达标。
平面翻正:将仔鼠仰卧于表面稍粗糙的硬质平板上,并使之保持片刻。松手后其能在3 s内翻正呈俯卧位并连续3次成功即为达标。从出生后第4天龄开始检测并记录达标天龄,直到全部的仔鼠达标。
负趋地性:将仔鼠头向下置于25°斜面, 在15 s内其完成转头并向斜面上方运动则达标。从生后第3天龄起检测并记录达标天龄,直到全部仔鼠达标。
空中翻正:地面放置海绵垫,在距离海绵垫45 cm高处将仔鼠置于仰卧位,然后松手使其自然落下,仔鼠在连续两次下落过程中均能自行转体并呈俯卧位落地(四肢着地)为达标。从出生后第11天龄开始检测并记录达标天龄,直到全部仔鼠达标。
抓握反射:提起仔鼠尾部使其四肢悬空,用一尖锐硬质小棒轻触其左后肢掌心,发生屈曲反射即为达标。从生后第11天龄起检测并记录达标天龄,直到全部仔鼠达标。
听觉惊愕:在仔鼠无意识准备的情况下,突然给予声鸣(哨声)刺激,阳性反应为仔鼠全身出现可见的抽动,连续2次刺激反应呈阳性反应为达标。出生后第9天龄开始检测并记录达标天龄,直到全部仔鼠达标。
视觉定位: 提起仔鼠尾部使其四肢悬空,头部尽量接近距地45 cm且与地面平行的方形铁丝网边缘,注意不要使其胡须与之接触。仔鼠连续2次将前肢伸向其边缘即为视觉发育正常(达标)。从生后第14天龄起检测并记录达标天龄,直到全部仔鼠达标。
趋母性试验: 将母鼠置于以过道连接的2个无异味小笼之一中,其仔鼠依次放于过道中央。在3 min内仔鼠发生向其母亲方向的运动即为达标。从生后第14天龄起检测并记录达标天龄,直到全部仔鼠达标。
痛觉反应潜伏期的测定:金属盘浮于55 ℃恒温水育箱中放置10 min,使金属盘与水温一致。把雌性仔鼠放于盘上,当仔鼠因热刺激引起疼痛而出现踢后腿或舔后足或四肢乱动等反应时取出动物。记录放入金属盘到出现疼痛反应的时间,作为痛觉反应潜伏期。仔鼠于出生后46和47天龄分别检测。
2.7.3仔鼠运动协调功能和活动度
指标包括转体、足展开、前肢悬挂、连续通道活动。
转体:仔鼠在30 s内身体纵轴旋转90°为阳性。从出生后第2天龄开始检测并记录达标天龄,直到全部仔鼠达标。
足展开:仔鼠双侧后足最外趾涂以黑色液体,在距离台面30 cm高处自然下落至台面白纸上,测量两点间距离。仔鼠于出生后15和30天龄分别检测,每天测量两次,求平均值。
前肢悬挂:将14及16天龄的仔鼠后肢捆住,前肢悬挂于高45 cm的铁丝上,记录持续时间,连续无间隔地测定3次。
连续通道活动:仔鼠置于5 m长、有11个直角转弯的通道中,记录仔鼠在3 min内转弯次数,比较氚照射组与对照组仔鼠活动能力。
2.7.4行为测试试验
行为测试试验包括旷场试验和孔板探究试验。
旷场试验:圆形铁盒改装而成的旷场直径45 cm,分为面积近似的25个小格,壁高50 cm。距旷场中央60 cm高处放置一盏40 W灯泡进行照明。把22天龄的仔鼠置于旷场中央的格中,记录其走出中央格的潜伏期及2 min内双后肢走过的格子数。在暗环境下进行测试。
孔板探究试验:将直径23.5 cm圆形木板置于经改制的塑料桶中部,板距桶底15 cm,距桶上缘40 cm,板上钻有9个间距1.5 cm的小孔。把100天龄的仔鼠置于孔板上,记录其从被放入至将头第一次探入孔中所用的时间,即首次探孔时间及其在2 min内探孔的次数。探孔的定义为仔鼠将头主动探入孔中。
2.7.5学习和记忆能力的测试试验
测试试验包括电击回避学习、电击回避记忆测试、食物迷宫测试、水迷宫测试、Y迷宫刺激单向回避反射实验和条件反射试验。
电击回避学习:20 cm×20 cm×30 cm的方型有机玻璃箱,底部铺设不绣钢栅,箱底的一角固定一个3 cm×3 cm×2 cm的木块。仔鼠第53、54和55天龄,每只仔鼠每天训练10次。仔鼠每次被放在箱底部与固定木块对应的角处,鼠头向木块,5 s后钢栅通以38 V电击鼠脚5 s,动物慌忙逃窜,在奔跑中偶然跳上安全台,让它停留10 s,拿出休息30 s后再重复,每只动物在每天训练结束后再进行10次测试,测试时不用电击,以在10 s内跳上木块为反应正确,并将10次测试中正确反应次数为7、8和9次定为达标,且在最后一天测试达标鼠作为已产生记忆鼠。
电击回避记忆测试:仔鼠第62、69、76和113天龄,每只仔鼠每天进行3次测试,装置及方法同“电击回避学习”。在3次测试中均反应正确者认为保持记忆;对未保持记忆者在下一次的检测时仍记为未保持记忆者,予以淘汰,但记入累积数中。
食物迷宫测试:食物箱内有葵花籽和动物饲料,将禁食36 h的50天龄仔鼠放入食物箱内并开始记时,至其进食时止,所用时间为首次进食时间。仔鼠进食10 s后,打开活动门1,将仔鼠赶出食物箱,关闭活动门1,打开活动门2并记时至其经活动门2进入食物箱时止,所用时间为首次获食时间。在小鼠寻获食物并进食10 s后,关闭活动门2,打开活动门1并重复上述程序,以小鼠由1门至2门最短行走路线为正确路径,记录仔鼠从1门被赶出至由2门进入食物箱所用时间及所走的错误路径次数,如此连测3次,每只小鼠以均值作为统计值,每个剂量组平均获食时间为其组中各小鼠统计值的平均值。平均错误路径次数(以下称平均错误)的计算与平均获食的计算相仿。
水迷宫测试:设计一个50 cm×35 cm×20 cm的有机玻璃池,水深16 cm,水温在22±1 ℃。仔鼠第60天龄测试。仔鼠从中间小池的起始点(跳台)入水。首次登岸(安全台)时间、平均登岸时间和平均错误等指标的计算同“食物迷宫测试”小鼠首次登岸后休息30 s后再进行下一次测试。
Y迷宫刺激单向回避反射实验:将仔鼠置于Y迷宫中适应2 min,在迷宫危险区置有两道带洞屏障,给予38 V电刺激,引导仔鼠由带电的危险区到达安全区,每只仔鼠训练15次,再连续测试10次,记录每次跑至安全区所用时间(超过5 s视为错误)。以10次中连续6次正确为阳性,计算每组阳性率并计算每组所有受试动物的无误率(正确次数/总次数)。
条件反射试验:取Y迷宫两臂,一臂为危险区,一臂为安全区,在危险区加置两道带洞屏障。仔鼠从出生后58天龄开始训练(第1实验日)由危险区跑至安全区。每只仔鼠第1天训练15次,从第2实验日起在铃声后给予38 V电刺激,连续训练7天,每天10次,以10次中连续6次仔鼠能在铃声后进入安全区视为条件反射建立,记录各组仔鼠每训练日的达标率。
2.7.6脑发育及脑细胞学
内容包括:(1)脑发育(脑体比);(2)脑皮质厚度、脑细胞计数及大脑锥体细胞发育;(3)脑海马细胞学研究。
脑发育(脑体比):小鼠仔鼠在出生后21、49和66天龄,大鼠仔鼠在第52天龄,称重后,断头杀死,开颅取全脑(嗅球、大脑、小脑和延髓)称重,计算脑体比。
脑皮质厚度、脑细胞计数及大脑锥体细胞发育:在仔鼠第45或150天龄时,断头处死开颅取脑。对150天龄的仔鼠脑组织按Cox-钨酸盐法的改进法固定、染色、切片。①脑皮质厚度:每张切片测量3 次取均值,测量部位:大脑为中央前回上、中及下部的中段;小脑为蚓部相邻的三个脑回的最高处。每张切片测量3次,每个标本皮质厚度取其9次测量的均值。②大脑皮质第五层锥体细胞计数:每张切片计数4 个视野, 每个视野面积1.470×3.675 mm2, 共计数12个视野;由12个视野计算出每mm2大脑皮质的细胞数。每个标本单位面积的细胞数为其3张切片计算值的均数。③小脑浦氏细胞:每张切片沿小脑沟回共计数7.4 mm皮质长度,细胞数计算与大脑的相仿,单位为每mm长度皮质内的细胞数。④大脑锥体细胞初级、次级树突及树突分枝比:将锥体细胞调到一个0.147×0.147 mm2的视野中央,计数该细胞在此范围内的初级和次级树突数及树突分枝比,即:树突分枝比=初级树突数/次级树突数。次级树突数为初级树突数与其发出的一级分枝的和。每个标本计数80~100个锥体细胞。
脑海马锥体细胞[29,31]:取全脑,固定,修块,脱水透明,浸蜡包埋,切片,染色,脱色透明,透明和封片。读片,10(目镜)×40(物镜)倍视野下观察海马锥体细胞。连续切片中选择锥体细胞面积大,密度高的部位进行细胞计数(以CA1区为基准);每只动物取3片计数(每张载玻片上有4张脑切片,任选两张,计数后取均数);两侧海马各区锥体细胞分别计数,计数面积为116 μm×58 μm。每个剂量组实际计数的数目为5(动物数)×3(切片数)×2(两侧海马)。
2.7.7仔鼠脑神经肽含量的测定[32]
仔雄鼠第54天龄断头处死,鼠头置于煮沸的生理盐水中3 min。开颅取出脑组织,分离脑区并称重。将已分离出的脑组织加入匀浆器中匀浆,加入NaOH溶液,3 000转/min离心30 min,取上清液测定。
2.7.8神经元培养和电生理记录仔鼠海马神经元及Ca2+电流[29,31,33]
海马神经元培养后6、8、10和12 d,分别记录各剂量组海马神经元Ca2+电流,每天2皿细胞,每皿测2~3个细胞。
2.7.9脑分子水平的研究[16-17,29,33]
内容包括:(1)细胞凋亡的鉴定和定量;(2)培养细胞p53蛋白的检测;(3)细胞周期的检测。
细胞凋亡的鉴定和定量:利用形态学和常规的荧光染色和DNA电泳方法对培养的MBC细胞进行凋亡的鉴定。在不同的时间点,培养物用胰岛素-EDTA处理的单细胞悬液用戊二醛固定在PBS缓冲液中,接着用Hoechst 33342(HO)染色。凋亡的细胞具有浓缩的染色质,同时记录凋亡细胞的百分数。根据Ramachandra等提供的方法稍作修改,凝胶电泳检测DNA片段。DNA片段(free DNA)用枸橼酸盐磷酸缓冲液进行抽提,接着用RNase和蛋白酶K消化。得到的样品进行琼脂凝胶电泳、DNA显影,并在UV灯下拍片。胎儿和新生小鼠的脑用10%福尔马林溶液固定,石蜡包埋。常规HE染色,鉴定凋亡细胞,放大400倍进行定量。同一样品检测200~250个细胞,每组检测3个样品。
培养细胞p53蛋白的检测:培养物用SDS-PAGE和Western Blotting的方法检测p53。在不同的时间点收集MBC细胞,并用SDS-PAGE样品分解缓冲液处理。每个样品的等量全蛋白细胞溶解产物加入12.5%SDS-多聚acrylamide凝胶电泳池中电泳,然后电转移到PVDF膜上(BioRad)。多余的结合位点用含5%干牛奶和0.05%Tween20的PBS(PBST)、4 ℃下过夜培养滤膜来阻断。滤膜与羊的多克隆抗-p53抗体一起培养(M-19)1.5 h。用PBST洗两次,与碱性磷酸酶结合的兔抗羊IgG抗体培养。抗体复合物用NBT/BCIP显色反应来检测。
细胞周期的检测:培养物中细胞周期的分布用FACS Calibur流式细胞仪测定。在不同的时间点,培养物用胰岛素-EDTA处理后,单细胞悬液在4 ℃下用70%乙醇固定至少4 h,或者保存在-20 ℃下过夜。接着,细胞与RNase一起培养并在室温暗室下、PBS中用PI染色至少30 min。在流式细胞仪测定前,细胞用30 um的尼龙网过滤。
2.8 阈剂量
阈剂量是指与对照组相比某项生物学指标出现显著性差异的最低剂量。
小鼠的生物学指标包括生长发育、神经行为、出生后不同时期脑发育、出生后不同时期脑病理、脑生化测定以及细胞凋亡的研究。大鼠的生物学指标包括生长发育、神经行为、脑发育、脑病理、海马神经元体外培养形态观察和计数以及海马神经元Ca2+电流测定。共计56项生物学指标。
2.9 统计分析
用STATA和SAS软件对数据进行统计检验。
t检验或方差分析:体重、张耳、出牙、开眼、睾丸下降和阴道张开的平均达标天龄;断崖回避、平面翻正、负趋地性、空中翻正、抓握反射、视觉定位、听觉惊愕和趋母性试验的平均达标天龄,痛觉反应潜伏期;转体的平均达标天龄、足展开的距离、前肢悬挂的时间、连续通道活动转弯数;旷场试验平均潜伏期和走格数、孔板探究试验首次探孔时间和平均探孔数;食物迷宫试验的首次进食时间、首次获食时间、平均获食时间、平均错误次数,水迷宫首次登岸时间、平均登岸时间、平均错误次数,Y迷宫刺激回避反射试验的逃避时间;脑体比、脑皮质厚度、脑细胞数、树突数和树突比、海马各区锥体细胞计数;生长抑素、精氨酸加压素浓度;体外培养海马神经元计数,Ca2+电流幅度;细胞凋亡数,p53蛋白含量。
方差分析及χ2检验:电击回避的学习和记忆保持,Y迷宫刺激回避反射试验的阳性率和无误率,条件反射的达标率;海马神经元Ca2+电流。
3 结果
3.1 出生前氚照射对仔鼠生理标志出现天龄的影响[5-6,19,25]
出生前氚照射对小鼠和大鼠仔鼠生理标志出现天龄的影响结果分别列于表1和表2。
由表1和表2可见,与对照组相比,小鼠3个实验组仔鼠张耳和出牙时间显著延迟,中剂量组和高剂量组开眼发育显著延迟;大鼠中剂量组和高剂量组出牙显著延迟,高剂量组张耳及开眼显著延迟。
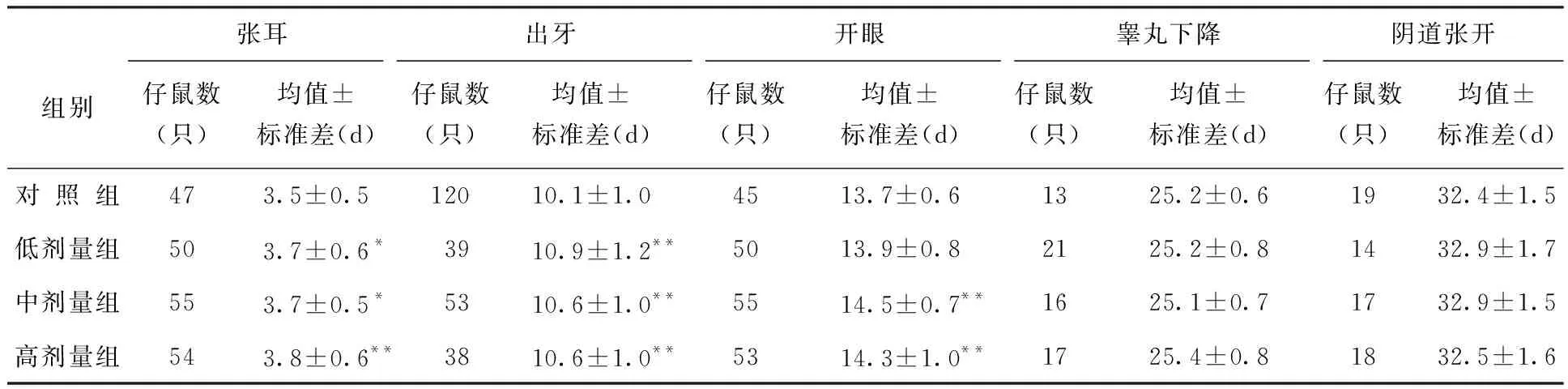
表1 出生前氚照射对小鼠仔鼠生理标志出现天龄的影响结果
注:*与对照组相比,p<0.05;**与对照组相比,p<0.01。 余表同。

表2 出生前氚照射对大鼠仔鼠生理标志出现天龄的影响结果
3.2 出生前氚照射对仔鼠新生反射出现天龄的影响[19]
出生前氚照射对小鼠和大鼠仔鼠新生反射出现天龄的影响结果分别列于表3和表4。由表3可见,与对照组相比,小鼠中剂量组和高剂量组仔鼠断崖回避、空中翻正、平面翻正反射出现时间显著延迟。由表4可见,大鼠中剂量组和高剂量组仔鼠平面翻正和负趋地性出现时间显著延迟。

表3 出生前氚照射对小鼠仔鼠新生反射出现天龄的影响结果

表4 出生前氚照射对大鼠仔鼠新生反射出现天龄的影响结果
3.3 出生前氚照射对感觉功能出现天龄的影响[19]
出生前氚水照射后小鼠和大鼠子代感觉功能出现天龄的影响结果分别列于表5和表6。
由表5可见,与对照组相比,小鼠3个实验组仔鼠的听觉惊愕出现天龄均延缓,46和47天龄痛觉反应潜伏期延长,趋母性试验出现发育受阻,中剂量组和高剂量组视觉定位受到影响。

表5 出生前氚照射对小鼠仔鼠感觉功能出现天龄的影响结果
注:1)46 天龄仔鼠;2)47 天龄仔鼠。
由表6可见,大鼠中剂量组和高剂量组仔鼠的听觉惊愕出现的平均天龄显著延缓。

表6 出生前氚照射对大鼠仔鼠听觉惊愕出现天龄的影响结果
3.4 出生前氚照射对仔鼠运动协调功能和活动度的影响[26]
出生前氚照射对小鼠和大鼠仔鼠运动协调功能和活动度的影响结果分别列于表7和表8。
由表7可见,与对照组相比,小鼠中剂量组和高剂量组28天龄仔鼠的连续通道活动转弯数减少显著; 高剂量组63天龄仔鼠的连续通道活动转弯次数减少显著。
由表8可见,与对照组相比,大鼠高剂量组仔鼠14和16天龄前肢悬挂时间缩短显著,28天龄仔鼠的连续通道活动转弯数低剂量组减少显著。
3.5 出生前氚照射对仔鼠行为测试试验的影响[19]
出生前氚照射对小鼠仔鼠行为测试试验的影响结果列于表9。由表9可见,与对照组相比,小鼠中剂量组和高剂量组仔鼠离开旷场中央的潜伏期和仔鼠走格数两项指标的差异非常显著,具体表现为潜伏期的缩短和走格数的增加;3个实验组首次探孔时间显著延长,低剂量组平均探孔次数明显减少,中剂量组和高剂量组这种差异更加显著。
3.6 出生前氚照射对仔鼠学习记忆能力的影响[20,22,25-27]
出生前氚照射对小鼠仔鼠电击回避学习情况的影响结果列于表10。对电击回避学习记忆保持情况的影响结果列于表11。食物迷宫实验测试结果列于表12。水迷宫实验测试结果列于表13。对Y迷宫刺激单向回避反射的影响结果列于表14。对条件反射达标率的影响结果列于表15。

表7 出生前氚照射对小鼠不同天龄仔鼠运动协调功能和活动度的影响结果
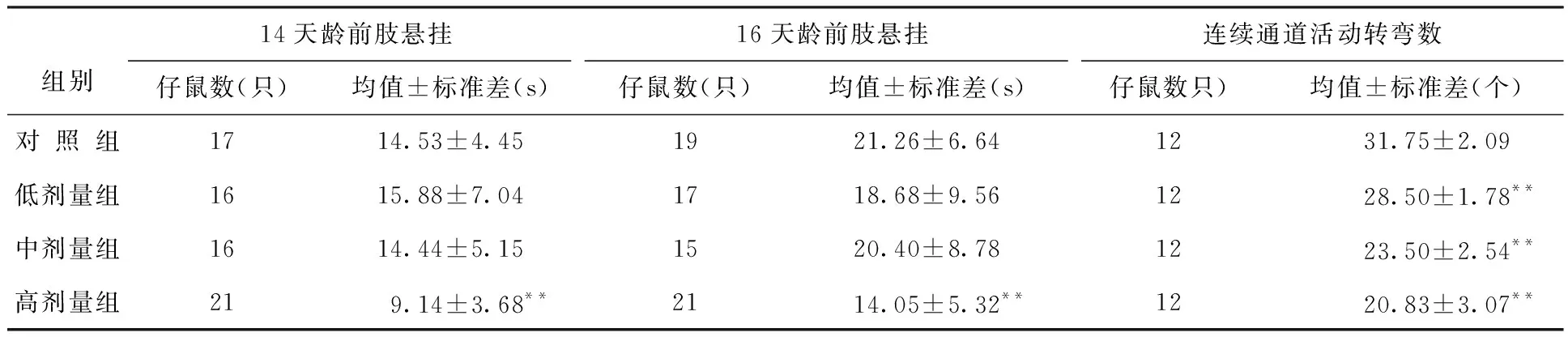
表8 出生前氚照射对大鼠不同天龄仔鼠运动和协调功能及活动度的影响结果

表9 出生前氚照射后小鼠仔鼠行为测试试验的影响结果
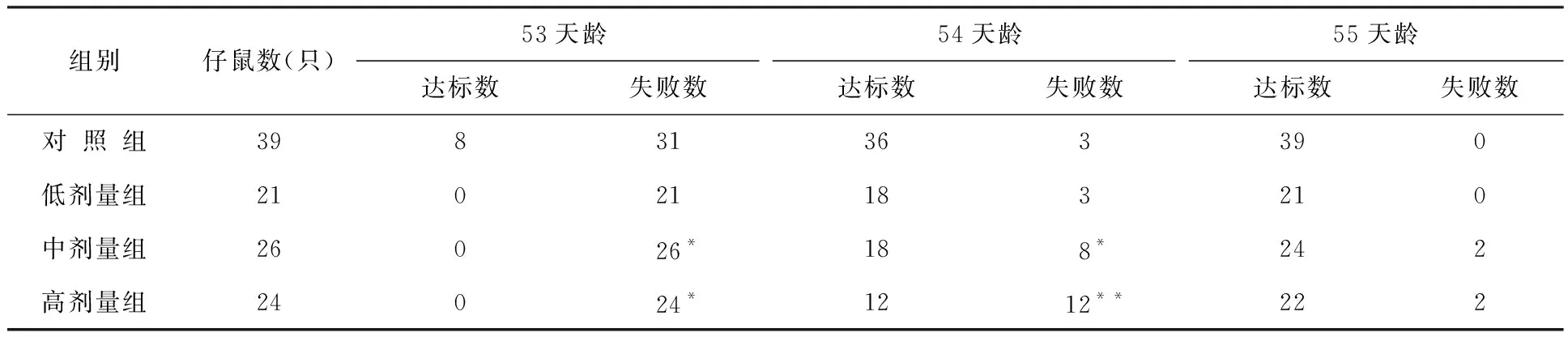
表10 出生前氚照射对小鼠不同天龄仔鼠电击回避学习情况的影响结果
注:达标数和失败数(未达标数)均指累积数。余表同。
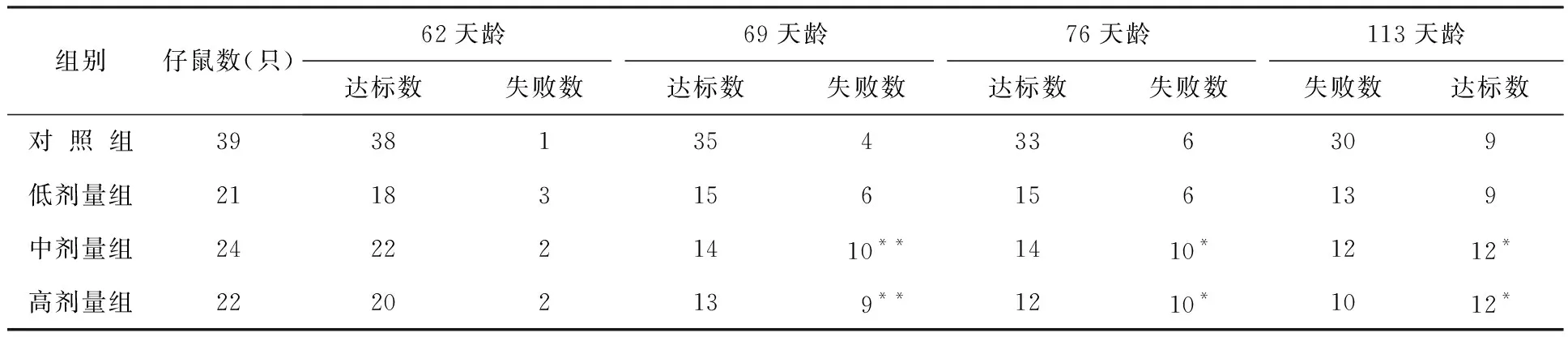
表11 出生前氚照射对小鼠不同天龄仔鼠电击回避学习记忆保持情况的影响结果

表12 出生前氚照射对小鼠仔鼠食物迷宫实验测试的影响结果

表13 出生前氚照射CF 小鼠仔鼠水迷宫实验测试的影响结果

表14 出生前氚照射对小鼠仔鼠Y迷宫刺激单向回避反射的影响结果
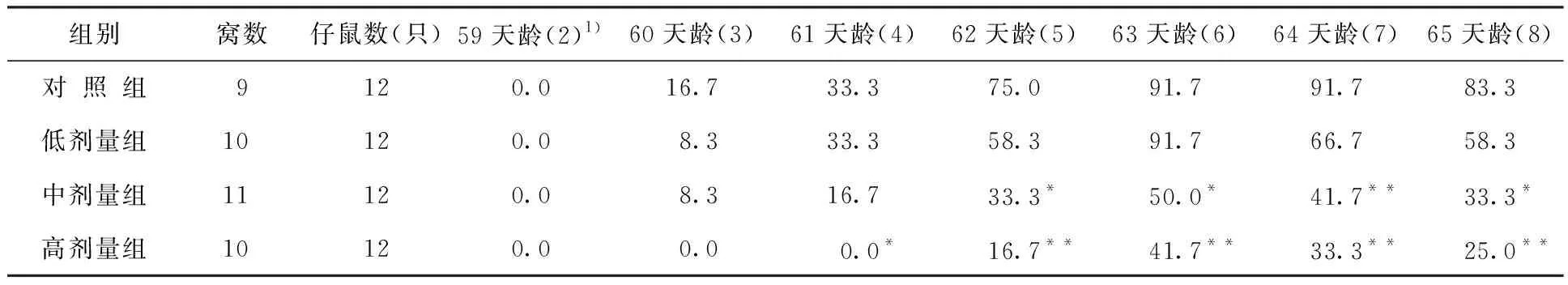
表15 出生前氚照射对小鼠不同天龄仔鼠条件反射达标率的影响结果(%)
注:()内数字表示实验日。余表同。
出生前氚照射对大鼠仔鼠Y迷宫刺激回避反射试验的影响结果列于表16。对条件反射达标率的影响结果列于表17。
实验结果表明,与对照组相比:小鼠中剂量组和高剂量组仔鼠电击回避学习能力差异显著,记忆丧失的比例增加,且这种情况差异具有统计学意义;首次进食时间和平均获食时间显著改变,高剂量组仔鼠平均错误次数的增加差异显著;仔鼠水迷宫实验,实验组平均错误次数比对照组明显增加;中剂量组和高剂量组仔鼠回避反射的无误率及阳性率显著降低;高剂量组仔鼠4、5、6、7和8实验日条件反射达标率显著降低;实验组45天龄逃避时间均明显延长,中剂量组和高剂量组逃避无误率显著降低,逃避时间延长差异非常显著性。
大鼠中剂量组仔鼠51天龄和52天龄(第6和7实验日)的达标率显著降低,高剂量组50、51和52天龄(第5、6和7实验日)仔鼠条件反射达标率显著性降低。
3.7 出生前氚照射对仔鼠脑发育及脑细胞学的研究[29-31,33]
出生前氚照射对小鼠仔鼠体重和脑重的影响结果列于表18。对不同天龄雌性仔鼠脑体比的影响结果列于表19。对不同天龄雄性仔鼠脑体比的影响结果列于表20。对小鼠仔鼠脑皮质厚度和脑细胞数的影响结果列于表21。对150天龄仔鼠大脑锥体细胞树突的影响结果列于表22。21天龄仔鼠海马各区锥体细胞计数结果列于表23。49天龄仔鼠海马各区锥体细胞计数结果列于表24。66天龄仔鼠海马各区锥体细胞计数结果列于表25。
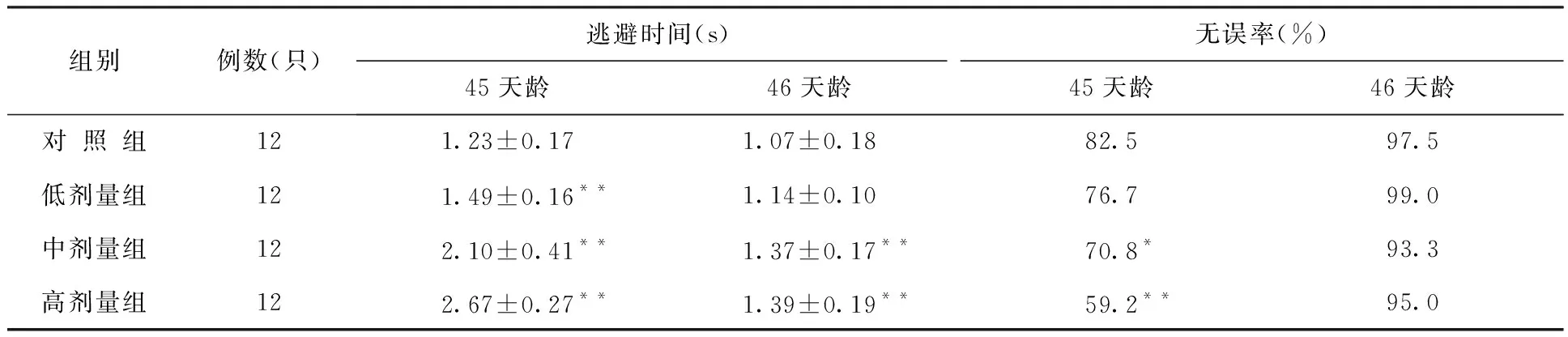
表16 出生前氚照射对大鼠仔鼠Y迷宫刺激回避反射试验的影响结果

表17 出生前氚照射对大鼠不同天龄仔鼠条件反射达标率的影响(%)

表18 出生前氚照射对小鼠不同天龄仔鼠脑重的影响结果(mg)
注: ( )内数字表示仔鼠数。余表同。

表19 出生前氚照射对小鼠不同天龄雌性仔鼠脑体比的影响结果( ×10-2)

表20 出生前氚照射对小鼠不同天龄雄性仔鼠脑体比的影响结果(×10-2)

表21 出生前氚照射对小鼠仔鼠脑皮质厚度和脑细胞数的影响结果

表22 出生前氚照射对小鼠150天龄仔鼠大脑锥体细胞树突的影响结果

表23 出生前氚照射对小鼠21天龄仔鼠海马各区锥体细胞计数的影响结果

表24 出生前氚照射对小鼠49天龄仔鼠海马各区锥体细胞计数的影响结果

表25 出生前氚照射对小鼠66天龄仔鼠海马各区锥体细胞计数的影响结果
52天龄各组大鼠仔鼠体重和脑重的结果列于表26。大鼠仔鼠海马各区锥体细胞计数结果列于表27。
研究结果表明:
脑重,中剂量组和高剂量组雌性仔鼠45天龄显著降低。脑体比,中剂量组21天龄、高剂量组21、49及66天龄明显降低,高剂量组降低显著。
小鼠雄性仔鼠在150天龄时的大脑锥体细胞数和小脑浦氏细胞数均明显减少;而对于脑皮质厚度,各受照组大、小脑皮质厚度依剂量的增加均有变薄趋势,高剂量组差异显著。
实验组150天龄的雄性仔鼠大脑锥体细胞的初级和次级树突均受阻,改变非常显著,树突分枝比值的变化也与此一致。
低剂量组21天龄仔鼠海马CA1及CA3区、49天龄CA1区、66天龄CA1区锥体细胞数均比对照组明显降低。中剂量组21天龄CA1及CA3区、49天龄CA1及CA3区、66天龄CA1及CA3区锥体细胞数均比对照组显著减少。高剂量组21天龄海马各区,49天龄CA1、CA3及CA4区,66天龄CA1和CA3区锥体细胞数都比对照组明显减少。随着出生天龄的延长,CA2及CA4区锥体细胞数逐渐恢复,在66天龄时基本恢复正常,但CA1及CA3区锥体细胞数恢复不明显,相同天龄锥体细胞减少程度随剂量增加而增加。
大鼠实验结果与小鼠相似。
3.8 出生前氚照射对仔鼠脑神经肽含量的影响[32]
出生前氚照射对小鼠仔鼠生长抑素、精氨酸加压素含量的影响结果列于表28。由表28可见,与对照组相比,中剂量组和高剂量组雄性仔鼠脑垂体中生长抑素(SOM)含量升高显著;高剂量组下丘脑中精氨酸加压素(AVP)含量显著降低。
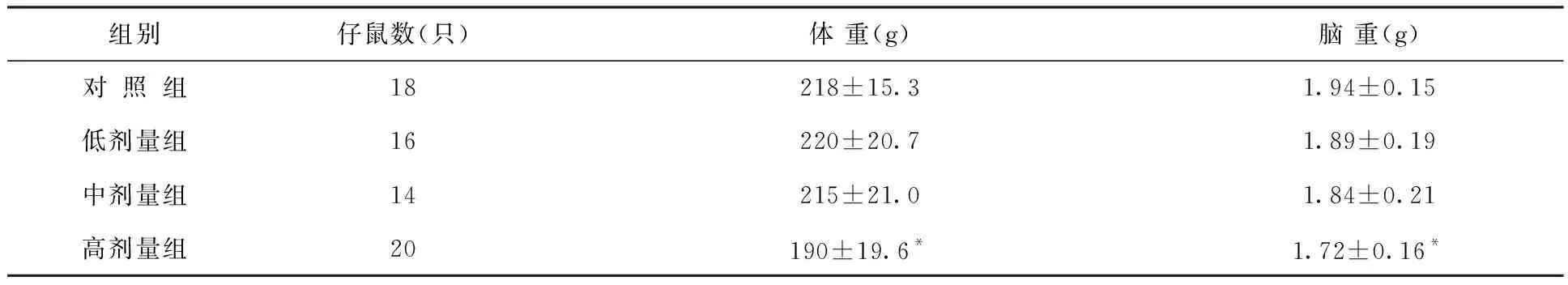
表26 出生前氚照射对大鼠52天龄仔鼠体重和脑重的影响结果

表27 出生前氚照射对大鼠仔鼠海马各区锥体细胞计数的影响结果

表28 出生前氚照射对小鼠仔鼠生长抑素、精氨酸加压素含量的影响结果
3.9 出生前氚照射对大鼠仔鼠海马神经元及Ca2+电流的影响[29,31,33]
出生前氚照射对新生大鼠仔鼠海马神经元细胞数的影响结果列于表29。
中剂量组和高剂量组海马神经元生长缓慢,胞体较小,视野中细胞数较少,2周时开始退化,退化的神经细胞轮廓不清,界限模糊,胞浆颗粒增多,出现空泡,肿胀、断裂、崩解,网络稀疏。中剂量组和高剂量组体外培养6、8、10和12天的海马神经元数显著减少。
比较不同剂量的氚照射对海马神经元Ca2+电流的影响,结果发现,与对照组相比,高剂量组海马神经元Ca2+电流明显下降,Ca2+电流的衰减与照射剂量及培养天数无关,而与记录神经元的状态有关。对照组及照射组均发现快相和慢相Ca2+电流。

表29 出生前氚照射对大鼠不同天龄仔鼠海马神经元细胞数的影响结果(个/视野)
3.10 氚水和OBT照射对仔鼠脑分子水平的影响[16-17]
MBC培养基中,加入3H-TdR或HTO培养后,细胞凋亡百分数逐渐增加。培养12 h后,细胞凋亡百分数明显的高于对照组,培养第4天,3H-TdR组和HTO组分别达到24.5%和28.1%。
3.11 妊娠和哺乳期氚的分布和转移[9]
妊娠第1天的孕鼠单次腹腔注射氚水后,测量妊娠和胚胎小鼠组织样品的氚活度,结果发现氚是均匀分布的。注射第2天,注入氚水量的51%滞留在体内,到第20天体内仅存留1.5%。在同样取样时间,胎盘和胚胎中氚活度与孕鼠组织中氚活度近似。结果没有显示出胎盘对氚转移的屏蔽作用。妊娠0天接受氚水照射后5、10和20天通过胎盘转移到胚胎的系数分别为0.96、0.97和1.06。哺乳当天接受氚水照射后10、15和20天通过乳汁转移到仔鼠的系数分别为1.30、1.89和2.10。母鼠体内的氚通过乳汁向仔鼠转移,及通过胎盘和乳汁联合转移,仔鼠体内氚比母鼠高1.3~2倍。
3.12 阈剂量[3-7]
研究分为3部分:第1部分,C57BL/6J孕鼠63只,获仔鼠399只,22项生物指标;第2部分,C57BL/6J孕鼠49只,获仔鼠234只,18项生物指标;第3部分,Wistar大鼠孕鼠12只,获仔鼠86只,16项生物指标。
出生前氚照射对大鼠和小鼠仔鼠不同生物学指标影响的剂量阈值结果列于表30。大鼠和小鼠不同生物学指标的氚致畸阈剂量阈值分布结果列于表31。结果可见,56项生物学指标中,45项生物学指标致畸阈值在0.03~0.092 Gy范围内,11项在0.093~0.30 Gy范围内。

表30 出生前氚照射对大鼠和小鼠仔鼠不同生物学指标影响的致畸剂量阈值结果
注:第一、二部分实验用动物为C57BL/6J小鼠;第三部分实验用Wistar大鼠。
4 讨论
(1)剂量估算
胚胎或胎儿在宫内接受内照射只有进行合理的剂量估算才能确定剂量-效应关系和制定标准。
以往的研究中,用成年鼠的估算模式估计仔鼠的剂量是不合理的,因为孕鼠及胎鼠的代谢模式与成年鼠不同,其半排期较成年鼠短,因此用成年鼠的估算模式来估计出生前受照的仔鼠累积吸收剂量必将导致结果的偏高。氚水能畅通无阻地通过血脑屏障,均匀地分布在包括神经系统在内的各种组织和脏器中。出生前接受氚照射的大鼠仔鼠的剂量估算已有较为适宜的模式。

表31 仔鼠中枢神经系统生物学指标致在氚畸阈剂量数的分布数
本次实验参考国内外学者对大鼠的剂量估算模式及某些参数对大鼠仔鼠进行估算,并在此基础上,结合本实验室以往研究的相关成年小鼠及孕小鼠的代谢、分布参数等对小鼠仔鼠进行剂量估算。结果发现,随着仔鼠出生后天龄的增加氚累积吸收剂量也稍有增加,但到出生后一定天龄时(小鼠仔鼠出生后6 d,大鼠仔鼠出生后12 d)氚累积吸收剂量保持恒定。虽然出生后不同时间仔鼠氚累积吸收剂量有所不同但变化甚微。比较大鼠和小鼠的剂量估算结果发现,宫内接受氚照射后相同时间,大鼠氚累积吸收剂量比小鼠氚累积吸收剂量高。分析认为,妊娠大鼠及仔鼠的半排期比小鼠长,氚水在大鼠体内滞留多、代谢慢,所以尽管以相同的氚水活度注入腹腔,而剂量上仍然有一定的差异[3,7,9,15]。
(2)生长发育及神经行为
低剂量组仔鼠连续通道活动转弯数减少,并随着剂量增加效应更加明显。中剂量组仔鼠出牙出现的延迟、平面翻正及听觉惊愕达标天龄的延迟,随着剂量增加更明显。高剂量组仔鼠张耳及开眼出现的延迟,14及16天龄仔鼠前肢悬挂时间缩短。结果说明,出生前氚水照射对中枢神经系统有抑制作用,不同指标的敏感性不同。
选择与小鼠同样的两项学习记忆行为指标测定大鼠的智力发育状况(Y迷宫刺激回避反射试验和条件反射试验)。结果表明,低剂量组仔鼠初级学习记忆能力受损。中剂量组50~52天龄的仔鼠产生条件反射建立达标率的降低。大、小鼠初级和高级学习记忆功能受损的结果的说明出生前氚照射可导致仔鼠智力迟钝。与人类资料一致[19-20,25-26]。
电击回避和迷宫实验结果表明,中剂量组和高剂量组仔鼠对短期学习发生障碍,获得记忆鼠所占比例显著低于对照;而经过连续3天的30次训练后,这种差异已不再有统计学意义。在对电击回避记忆保持上,上述两个剂量组仔鼠在学习结束二周后,记忆保持者所占比例不足60%,而此时对照组仍有89%以上保持记忆,说明中剂量组仔鼠在长期记忆上已发生障碍,这是否由于辐射损害了仔鼠记忆巩固过程有待于进一步研究。对仔鼠短期记忆损害的脑生化基础研究结果表明,高剂量组仔鼠下丘脑精氨酸加压素的含量降低。记忆过程是一个极为复杂的心理过程,结合生化和组织学的进一步研究对我们探讨辐射损伤的生物学机理十分必要[20,22,27]。
(3)脑病理学改变
宫内氚辐射对仔鼠体重的影响,在从出生时至出生后成年相对较长的时间内均有持续作用。仔鼠45天龄时,中剂量组和高剂量组雌雄鼠全脑重均分别低于对照组,虽然雌鼠体重在各剂量组并无显著性改变,但脑重的变化说明脑发育受阻的程度大于体重发育所受的阻碍。
照射使脑神经元缺失,从而致神经机能减退,相应的运动机能和智力活动将发生失调和迟钝。皮层的躯体运动调节功能是通过锥体系和锥体外系下传完成的,锥体细胞的缺失直接影响到锥体束纤维的组成;大小脑之间联系密切,小脑与躯体运动的反射调节有着密切的关系,而浦氏细胞的轴突是小脑皮层唯一的传出纤维,它的缺失将使小脑皮层与其深部核团细胞的突触联系直接受到影响,加之锥体细胞的树突减少,它与其它神经元的化学信息传递必然减弱。这些很可能是导致宫内受照后仔鼠反射发育迟缓的解剖学和生理学基础。结合对仔鼠脑神经肽及行为、学习和记忆能力的检测结果,从病因学方面支持 ICRP 对原子弹爆炸幸存者所做的关于受照时间和智力迟钝发生的流行病学调查结果[1]。
(4)神经元的形态观察及电生理功能的测定
辐射对细胞、整体的损伤必然基于分子水平物质的变化,如DNA、酶和激素等含量改变。近年来,氚的生化、分子神经毒理学研究多限于递质、激素和DNA/RNA含量等。对电生理的研究尚未见报道。有关外照射的电生理研究也只限于大剂量。本研究体外培养新生大鼠海马神经元的形态观察及电生理功能的测定结果发现,中剂量组和高剂量组海马神经元生长缓慢,胞体较小,较早退化。并且视野中海马神经元数目明显减少。结果说明一定剂量的氚照射,可明显抑制海马神经元的生长发育和增殖能力,并且随剂量增加效应明显增加。
离子通道是神经、肌肉和其它组织细胞膜兴奋性的基础,是生物电活动的基础。离子通道是生物膜上的特殊蛋白大分子。1976年西德Neher和Sakmann直接从生物膜上记录了离子单通道电流。80年代初期发展起来的膜片钳技术,为从分子水平了解生物膜离子通道的开启和关闭、动力学、选择性和通透性等膜信息提供了直接手段。由于Ca2+对细胞有极重要的生理功能,如递质释放、肌肉收缩和第二信使等作用,没有钙通道,神经系统将无输出。电压依赖的Ca2+通道广泛存在于各种组织细胞中,是细胞兴奋时钙内流的主要途径,其为许多神经毒素和药物的作用靶,因此研究辐射对电压依赖性钙通道的影响极为重要,可为阐明辐射对海马神经元影响的分子机制提供资料。本实验结果表明,随着体外培养海马神经元时间的延长,细胞Ca2+电流逐渐增加,随氚照射剂量的增加,Ca2+电流有下降趋势,高剂量组下降显著,分析认为钙电流降低,与辐射导致海马神经元功能受损密切相关。
另外,由于一定的细胞数可维持细胞间相互营养和支持作用,其可能与氚内照射导致细胞活存数较少,细胞存活状况不好也有关系。由于突触形成过程对Ca2+很敏感,相对低的突触前高水平Ca2+可增加神经递质的释放和突触电位的增强。本实验条件下,实验组Ca2+电流比对照组低,可能对海马神经元突触活动产生影响,如突触电位的改变、神经递质释放减少,并且需要Ca2+参与的细胞核和蛋白合成系统也可能受损,导致神经信息传导的不良,而导致神经行为尤其是学习记忆功能的严重损伤[29,31,33]。
(5)阈剂量
实验结果发现,出生前氚照射对仔鼠中枢神经系统影响的致畸阈值大部分在0.03~0.092 Gy范围内,少数在0.093~0.30 Gy范围内,提示低至0.092 Gy的氚照射妊娠的大鼠或小鼠即可导致大鼠或小鼠仔鼠表现出体内或体外的异常改变,并且这种改变往往具有不可逆性。鉴于中枢神经系统调控机体的特殊性、其本身结构的复杂性及不同测试指标灵敏性的差异,研究选用了多项指标以期全面、系统的探讨氚辐射对中枢神经系统可能造成的生物效应。结果显示,不同指标对氚辐射敏感性的差异是显著的,但是在实验中各指标均随剂量增加而加重,这不仅为我们今后工作的开展确立了敏感的指标,也提示我们应进一步增加实验剂量点,将有可能实现选择适当的数学模型来分析剂量-效应关系及致畸阈值的确定[3-4,6-7]。
5 结语
脑是分子、细胞和组织活动相互关联、相互制约的高度综合体。机体是一复杂的有机体,体内其它因素如体液效应可能影响神经元的活性,血流的改变和血脑屏障的改变将影响脑功能,神经胶质细胞的改变也会改变神经元的环境。
利用多种实验动物并完善实验模型,加强对氚内照射致细胞核剂量的估算,采用综合指标在分子、基因水平上深入地探讨氚对发育中脑的生物效应并将动物实验所得的剂量-效应关系适当地外推于人,这些研究工作均有待于进一步开展。诸多相关因素相互作用彻底弄清后,我们才能充分认识辐射对诸多神经行为的损伤作用。

