外源H2O2对镉胁迫下裸燕麦叶绿素荧光参数和镉积累特性的影响
刘建新,欧晓彬,王金成
(甘肃省高校陇东生物资源保护与利用省级重点实验室/陇东学院生命科学与技术学院,甘肃 庆阳 745000)
随着工业发展和农业中化肥、农药大量使用,土壤重金属污染日益严重。镉(cadmium, Cd)是最具植物毒性的重金属元素之一,主要以离子型化合物形态存在,容易被植物根系吸收并转移到籽粒中积累,进而通过食物链危及人类健康[1]。植物遭受Cd胁迫时会诱导细胞代谢酶活性下降[2]、根系营养元素吸收转运受阻[3]、叶片光系统电子传递活性[4]和光合速率[5]降低、地上部Cd吸收积累增加、叶绿素含量和植物生长量降低[6]。因此,探索提高植物Cd胁迫耐性的措施或技术途径,是缓解植物Cd胁迫伤害亟需解决的问题。
过氧化氢(Hydrogen peroxide, H2O2)是参与植物生长发育和胁迫应答调节的一种重要信号分子。研究证明,内源性H2O2代谢的调控有助于转基因水稻光合能力的提高[7]和诱导大豆根尖及边缘细胞的耐铝反应[8]。外源H2O2能够增强葡萄对低温[9]和玉米对盐胁迫[10]的耐性,缓解干旱对黄瓜叶绿体膜的伤害[11],增强受旱欧薄荷的光合性能[12]。关于H2O2增强植物对金属胁迫耐性方面的研究表明:外源H2O2能够提高黑豆对铝胁迫的耐性[13],抑制水稻根系Cd向地上部的转移[14],提高Cd胁迫蚕豆的抗氧化能力[15],通过调节光系统Ⅱ活性和气孔运动,维持镍胁迫下芥菜较高的光合潜力[16]。
裸燕麦(AvenanudaL.) 是我国西北、西南和华北等地广泛种植的禾本科燕麦属杂粮作物,其籽粒的蛋白质和脂肪含量远高于小麦、水稻等主要粮食作物,尤其是其富含的β-葡聚糖和燕麦黄酮对控制血脂、血压和血糖升高及改善胃肠功能具有保健功效[17]。裸燕麦具有较强的耐盐抗旱和耐贫瘠特性,常种植在盐碱地或受重金属污染等质地较差的土壤上,土壤重金属成为制约其生长发育的重要因素。有研究表明,根施H2O2可缓解Cd胁迫对裸燕麦生长的抑制[18]。然而,外源H2O2减轻Cd胁迫伤害的生理机制仍尚不清楚。为此,本研究以西北地区广泛种植的高产抗旱抗病裸燕麦品种‘定莜6号’为材料,通过砂培试验,研究喷施H2O2对Cd胁迫下植株生长及叶绿素荧光参数、光系统吸收光能分配和Cd积累的影响,探讨H2O2对Cd胁迫下裸燕麦生理响应的调控机制,以期为应用H2O2增强作物耐镉性提供理论依据。
1 材料与方法
1.1 试验材料
供试裸燕麦品种‘定莜6号’种子购自甘肃省定西市农业科学研究院。30% H2O2为Sigma公司产品,分析纯氯化镉(CdCl2·2.5H2O)作为Cd供体。
挑选均匀、饱满的裸燕麦种子用5%次氯酸钠将其表面消毒、洗净后晾干,播种在口径20 cm、高14 cm的塑料盆中,以清水充分洗净的膨胀珍珠岩(未检出Cd)作基质,每盆播种量约80粒,浇500 mL水后置日光温室中培养,常规管理。温室内昼/夜温度为(24~37)℃/(16~22)℃,光照强度为400~560 μmol·m-2·s-1,湿度70%±10%。当幼苗长至2片叶子时进行间苗,每盆保留一致壮苗约50株,并浇灌1/2 Hoagland营养液250 mL补充养分,当幼苗第3片叶完全展开时进行试验处理。
1.2 试验设计
前期预实验发现50 mg·L-1Cd2+溶液浇灌3叶期裸燕麦幼苗14 d后光合速率和植株干重显著低于浇灌蒸馏水的对照。因此,Cd胁迫浓度设定为50 mg·L-1Cd2+。H2O2喷施的有效生理浓度为1.5~10 mmol·L-1 [11,19-20]。据此,Cd胁迫和H2O2喷施交叉试验设置如下4个处理:(1) CK,用蒸馏水喷施幼苗叶面,用Hoagland营养液根部浇灌幼苗;(2)H2O2处理,用5 mmol·L-1H2O2喷施幼苗叶面,用Hoagland溶液根部浇灌幼苗;(3) Cd处理,用蒸馏水喷施幼苗叶面,用含50 mg·L-1Cd2+的Hoagland溶液根部浇灌幼苗;(4) H2O2+ Cd处理,用5 mmol·L-1H2O2喷施幼苗叶面,用含50 mg·L-1Cd2+的Hoagland溶液根部浇灌幼苗。叶面喷施与根部浇灌于2017年5月14日20∶00时同时进行,喷施液中加0.5% Tween-20以增加与叶面的粘附程度,喷施量每盆15 mL左右,浇灌量每盆约300 mL。叶面喷施和根部浇灌每隔2 d进行1次,处理14 d后进行各项指标测定。试验重复3次。
1.3 测定项目和方法
1.3.1 植株生长量 取30株幼苗,洗净后从根结处分成根系和地上部,置烘箱105℃杀青30 min,70℃烘干至恒重,称干重,重复3次。
1.3.2 叶黄素循环色素物质 取0.50 g幼苗第2~3片叶冻样于预冷研钵中,加入85%丙酮5 mL研磨匀浆后转移至离心管以4 000 r·min-1离心5 min,上清液用0.45 μm微孔滤膜过滤,按Cheng[21]的方法用LC-3000型高效液相色谱仪测定叶黄素循环色素紫黄质(V)、环氧玉米黄质(A)和玉米黄质(Z)的含量,以(A+Z)/(V+A+Z)表示脱环氧化状态。

1.3.4 Cd含量 将植株从盆中取出后充分洗净,根部浸入0.2 mol·L-1EDTA-Na2溶液30 min以除去表面吸附的Cd,再用蒸馏水冲净后吸干表面水分,将根系和地上部分开,置烘箱105℃杀青0.5 h,70℃烘干至恒重,分别称干重。然后粉碎、磨细、过1 mm尼龙筛,参照Zhang等[26]的方法分别称取0.500 g根系和地上部样品,用20 mL混合酸(HNO3∶HClO4=4∶1,V/V)消煮后定容至50 mL,用0.45 μm微孔滤膜过滤后用日立ZA3000原子吸收分光光度计测定Cd含量,并计算Cd积累量=植株根系或地上部Cd含量×根系或地上部生物量,转运率(%)=植株地上部Cd含量/根系Cd含量×100。
1.4 数据分析
采用SPSS 20.0方差分析和Duncan法多重比较(P<0.05),结果以平均值±标准差表示。
2 结果与分析
2.1 外源H2O2对Cd胁迫下裸燕麦幼苗生长量的影响
从图1可见,与CK相比,单施H2O2处理对裸燕麦幼苗根系干重无显著影响,但显著提高了裸燕麦幼苗地上部干重。Cd处理显著降低了裸燕麦幼苗根系和地上部干重,分别比CK下降了33.2%和32.0%。H2O2+Cd处理的幼苗根系和地上部干重分别比Cd处理提高了18.5%和26.9%,差异显著。

注:图中不同字母表明同一组织不同处理间差异显著(P<0.05)。Note: Different letters indicate the significant differences among treatments at 0.05 levels for the same tissue.图1 外源H2O2对Cd胁迫裸燕麦幼苗干重的影响Fig.1 Effect of exougeous H2O2 on dry weight of naked oat seedlings under Cd stress
2.2 外源H2O2对Cd胁迫下裸燕麦幼苗叶片叶黄素循环组分和脱环氧化状态的影响
从表1可知,与CK相比,单独H2O2处理显著降低了裸燕麦幼苗叶片中紫黄质(V)的含量,而环氧玉米黄质(A)和总叶黄素(V+A+Z)含量差异不显著,玉米黄质(Z)含量和脱环氧化状态(A+Z)/(V+A+Z)显著提高。Cd胁迫下的V和(V+A+Z)含量显著低于CK,分别降低了49.4%和9.9%,而A、Z含量和(A+Z)/(V+A+Z)显著高于CK,分别提高24.3%、21.6%和35.8%。与Cd胁迫处理相比,外源H2O2+Cd处理显著提高了V含量,增幅为23.8%,却显著降低了A、Z、(V+A+Z)含量和(A+Z)/(V+A+Z),降幅分别为37.8%、7.5%、5.1%和11.2%。
2.3 外源H2O2对Cd胁迫下裸燕麦幼苗叶片叶绿素荧光参数的影响
从表2可见,单独H2O2处理的裸燕麦幼苗叶片PSⅡ最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)、调节性能量耗散Y(NPQ)和非调节性能量耗散Y(NO)均与CK无显著差异。与CK相比,Cd胁迫显著降低了Fv/Fm、ΦPSⅡ和qP,降幅分别为21.1%、70.8%和54.7%,NPQ、Y(NPQ)和Y(NO)分别显著提高了72.3%、70.6%和24.7%。与Cd处理相比,H2O2+Cd处理显著提高了Fv/Fm、ΦPSⅡ、qP,增幅分别为15.7%、98.6%和61.6%,而NPQ、Y(NPQ)、Y(NO)明显降低,降幅分别为7.9%、13.9%和12.2%。
2.4 外源H2O2对Cd胁迫下裸燕麦幼苗叶片两光系统间激发能分配的影响
如表3所示,单独H2O2处理的裸燕麦幼苗叶片PSⅠ激发能分配系数(α)、PSⅡ激发能分配系数(β)和两光系统间激发能分配的不平衡系数(β/α-1) 均与CK无显著差异。与CK相比,Cd胁迫显著降低了α,提高了β和β/α-1。H2O2+Cd处理的α比单独Cd处理提高了40.9%,而β和(β/α-1)分别下降了12.7%和55.2%。
2.5 外源H2O2对Cd胁迫下裸燕麦幼苗叶片PSⅡ吸收光能分配的影响
从表4可见,单独H2O2处理的裸燕麦幼苗叶片光化学反应份额(P)、天线热耗散份额(D)和非光化学反应耗散的份额(Ex)与CK无显著差异。Cd胁迫下P较CK显著降低了70.8%,D和Ex分别显著升高了83.0%和40.7%。与Cd处理相比,H2O2+Cd处理的P显著提高了98.6%,而D和Ex分别显著降低了19.1%和10.6%。
2.6 外源H2O2对Cd胁迫下裸燕麦幼苗Cd吸收积累和转运率的影响
由表5可知,与CK相比,单独H2O2处理对裸燕麦幼苗根系和地上部Cd含量、Cd积累量和Cd转运率均没有显著影响。Cd胁迫显著提高了根系和地上部Cd含量、Cd积累量及转运率,其中根系Cd含量和Cd积累量均大于地上部。与Cd处理比较,H2O2+Cd处理显著提高了根系Cd含量,而对地上部Cd含量无显著影响;根系和地上部Cd积累量显著提高,而Cd转运率则显著下降。
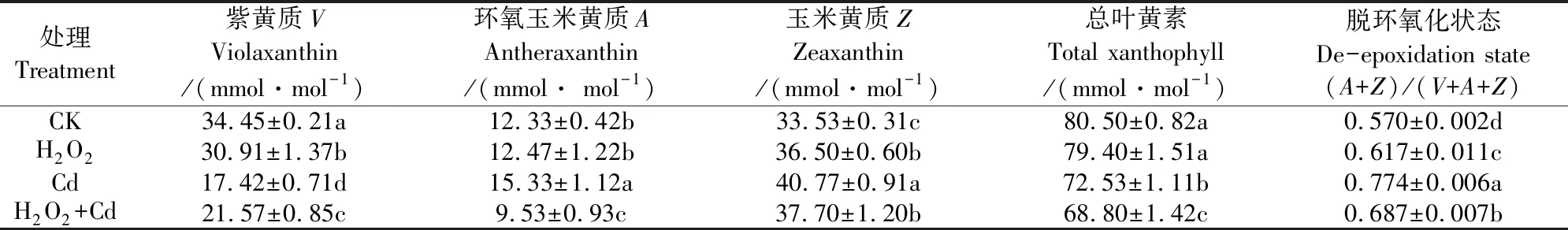
表1 外源H2O2对Cd胁迫下裸燕麦幼苗叶片叶黄素循环组分和脱环氧化状态的影响

表2 外源H2O2对Cd胁迫下裸燕麦幼苗叶片叶绿素荧光参数的影响

表3 外源H2O2对Cd胁迫下裸燕麦幼苗叶片两光系统间激发能分配的影响

表4 外源H2O2对Cd胁迫下裸燕麦幼苗叶片PSⅡ吸收光能分配的影响

表5 外源H2O2对Cd胁迫下裸燕麦幼苗Cd吸收积累和转运率的影响
3 讨 论
生长量是植物对Cd胁迫耐性的直接反映[3]。本试验表明,用5 mmol·L-1H2O2喷施可缓解50 mg·L-1Cd2+胁迫对裸燕麦幼苗生长的抑制(图1)。这与Hu等[14]以水稻为材料的研究结果一致。说明外源H2O2能够增强裸燕麦对Cd胁迫的耐性。
光合作用是植物生长发育所需物质和能量的重要来源,也是对Cd胁迫最为敏感的生理过程[4-5]。叶绿素荧光参数反映植物对光能吸收、传递、耗散和分配的特性。其中Fv/Fm代表PSⅡ原初光化学效率;ΦPSⅡ反映PSⅡ实际光化学效率,其值大小与光系统反应中心激发能捕获效率和开放程度有关[25]。张玲等[18]研究表明,100 μmol·L-1Cd胁迫下根施5 mmol·L-1H2O2对裸燕麦幼苗的Fv/Fm和ΦPSⅡ没有影响。本研究表明,喷施5 mmol·L-1H2O2对正常条件下的裸燕麦幼苗叶片Fv/Fm和ΦPSⅡ影响不大,但缓解了50 mg·L-1Cd2+胁迫诱导的Fv/Fm和ΦPSⅡ的下降幅度(表3)。表明喷施H2O2能够减轻Cd胁迫对裸燕麦叶片PSⅡ反应中心的光抑制程度,从而提高PSⅡ电子传递速率和光能转换效率。这与外源H2O2可提高干旱胁迫下欧薄荷[12]和镍胁迫下芥菜[16]光合活性的研究结果一致。
qP是天线色素吸收的光能用于光化学反应的份额[23],而NPQ是天线色素吸收的光能以热能耗散的部分[25]。NPQ主要包括调节性能量耗散Y(NPQ)和非调节性能量耗散Y(NO),Y(NPQ)与高能态猝灭有关,而Y(NO)与光抑制有关[27]。本试验中,Cd胁迫下裸燕麦幼苗qP下降的同时,NPQ和Y(NPQ)提高(表2)。说明Cd胁迫降低PSⅡ光化学效率的同时,启动了过剩激发能耗散机制以免光合机构遭受进一步破坏。但是Cd胁迫下光化学活性下降引起的过剩光能最终还是造成了光合机构的光抑制破坏,表现为Y(NO)的上升(表2)。叶黄素循环是植物叶绿体中类囊体膜上的叶黄素组分V、A和Z相互转化的现象,而NPQ的诱导与依赖跨类囊体膜质子梯度的叶黄素循环密切相关[21]。Cd胁迫下裸燕麦幼苗NPQ增加(表2)的同时,叶黄素循环组分V下降,而A、Z和脱环氧化状态(A+Z)/(V+A+Z)提高(表1)。表明Cd胁迫下依赖叶黄素循环中V向A和Z转化的热耗散机制可能是裸燕麦耗散过剩光能的重要途径。田武英等[28]研究发现,外源H2O2处理能够提高菜豆(Phaseolusvulgaris)叶片的qP及ΦPSⅡ,而降低NPQ和Y(NPQ)。本研究结果表明,喷施5 mmol·L-1H2O2降低了正常条件下裸燕麦幼苗叶片的V含量,提高了Z含量和(A+Z)/(V+A+Z)(表1),而对A含量及qP、NPQ、Y(NPQ)和Y(NO) (表2)没有影响,但缓解了50 mg·L-1Cd2+胁迫诱导的V和qP的下降程度,降低了Cd胁迫下的A、Z、(A+Z)/(V+A+Z)、NPQ、Y(NPQ)和Y(NO)(表1、2)。说明外源H2O2主要是通过提高PSⅡ的光化学效率而非增强依赖叶黄素循环的热耗散来降低Cd胁迫对光合机构的光抑制破坏。其原因之一可能与H2O2能够提高抗氧化防御能力,从而减轻Cd引发的氧化伤害[15,18]和叶绿体超微结构得到保护[11]等有关。
Cd胁迫既阻碍光合电子传递,又使PSⅡ供体侧、受体侧和反应中心遭受伤害[5];保持PSⅠ和PSⅡ激发能的均衡分配是光合电子高效运转和协调传递的保证[29]。本试验中,Cd胁迫导致裸燕麦幼苗分配给PSⅠ的激发能α减少,而分配给PSⅡ的激发能β增加,致使表征两光系统间激发能分配不平衡的偏离系数β/α-1增大(表3)。说明Cd胁迫使激发能在两个光系统间的分配失衡。PSⅡ激发能的增加会诱导反应中心的失活和结构的破坏,从而阻止光合电子的传递,导致光合作用的下降[30]。本试验中,用5 mmol·L-1H2O2喷施处理降低了50 mg·L-1Cd2+胁迫诱导的裸燕麦幼苗叶片β和β/α-1的增幅,提高了α(表3)。表明外源H2O2能够通过调节双光系统间激发能的均衡分配促进光合电子的协调传递。而外源H2O2对双光系统间激发能均衡分配的调节又是其提高Cd胁迫裸燕麦幼苗吸收光能用于光化学反应份额P(表4)的重要因素,P值的升高将有利于PSⅡ过剩光能的减少,进而降低天线热耗散的激发能份额D。在Cd胁迫导致PSⅡ反应中心失活甚至完全关闭的情况下,已传递到反应中心的激发能因不能用于光化学反应只能通过增加反应中心耗散份额Ex,从而诱导活性氧的大量产生并损伤叶绿素结构蛋白,造成ΦPSⅡ的下降[5]。喷施H2O2对Cd胁迫诱导的Ex升高显著的缓解作用(表4)表明,外源H2O2可以通过降低PSⅡ非光化学反应耗散来缓解Cd胁迫对裸燕麦叶片反应中心的损伤。这与外源H2O2可缓解干旱对黄瓜叶绿体超微结构破坏的研究结果类似[11]。
植物根部吸收的Cd随蒸腾作用向地上部发生转运,为降低Cd转运对生长发育和细胞代谢产生的不利影响,植物具有一系列抵御Cd毒害的机制。如通过腺体或质膜将Cd排出体外,或将Cd区室于液泡中钝化[31];或通过抑制Cd转运体合成来限制Cd的转运[3];或与金属硫蛋白(MTs)和植物螯合肽(PCs)等螯合将有毒Cd2+转变为无毒Cd形态[32]。Arasimowicz-Jelonek等[33]研究表明,NO信号能够缓解Cd胁迫对植物的毒害,但促进植物体Cd的积累。本研究结果表明,H2O2对Cd胁迫下裸燕麦幼苗地上部Cd含量没有影响,却提高了根系Cd含量及根系和地上部Cd积累量,降低了Cd由根系向地上部的转运率(表5)。说明外源H2O2能够增强植物根系对Cd的滞留和转运限制作用,这可能也是其能够降低Cd胁迫对裸燕麦生长和光化学活性抑制的重要因素。其原因可能与H2O2能够促进根系细胞壁果胶、半纤维素、纤维素和木质素合成,从而使Cd在根系细胞壁沉积有关[34];也可能是H2O2能够提高根系非蛋白巯基(NPT)、PCs和谷胱甘肽转硫酶(GST)活性[14],使游离态Cd2+形成络合物钝化而解毒所致。植物对Cd胁迫的防御机制是包括一系列复杂信号转导的生理生化过程,H2O2增强植物Cd耐性的诸多机制尚需进一步深入探究。
4 结 论
喷施5 mmol·L-1H2O2可缓解50 mg·L-1Cd2+胁迫对裸燕麦幼苗生长的抑制,提高Cd胁迫下裸燕麦叶片PSⅡ的Fv/Fm、ΦPSⅡ、qP及光系统Ⅰ激发能分配系数(α)和吸收光能光化学反应份额(P),降低叶黄素循环脱环氧化状态(A+Z)/(V+A+Z)及NPQ、Y(NPQ)、Y(NO)、PSⅡ激发能分配系数(β)、双光系统间激发能分配不平衡偏离系数(β/α-1)、吸收光能天线热耗散份额(D)和PSⅡ反应中心非光化学耗散份额(Ex)。同时,喷施H2O2还提高了Cd胁迫下裸燕麦根系Cd含量及根系和地上部Cd积累量,降低了根系向地上部Cd的转运率。表明外源H2O2可通过提高PSⅡ光化学效率及增强根系Cd滞留和限制Cd由根系向地上部转运,增强裸燕麦耐镉性。

