过氧化物还原酶3在胚胎停育患者绒毛及蜕膜组织中的表达变化
孙艳芬 张星莹 李甜甜 李连芹
在我国,由于婚育年龄推迟、生活方式改变、环境污染加剧等因素,早期自然流产(发生于妊娠12周之前的流产)发生率呈上升趋势。发生早期自然流产的原因很多,包括胚胎因素、母体因素、父方因素、环境因素(包括局部环境如子宫)[1]等。无论是母体因素、父方因素,还是环境因素所导致的自然流产,其中有一个环节与氧化应激状态有关。研究表明自然流产患者的绒毛或血清均呈氧化应激状态[2-3]。而生物体内存在多种抗氧化系统,以应对氧化应激状态。其中过氧化物还原酶(peroxiredoxin,PRX)利用其自身的半胱氨酸残基,将过氧化氢还原成水。PRX3作为该家族的成员之一,主要存在于线粒体中[4],与硫氧还蛋白2、硫氧还蛋白还原酶2构成线粒体内的第一道抗氧化防线[5]。笔者团队前期研究发现,早孕妇女绒毛组织和血清中PRX3表达水平均随着孕周的增加而不断升高,说明PRX3在孕早期即开始发挥抗氧化作用[6]。但是,目前尚不清楚PRX3与妊娠早期自然流产发生的关系。本研究通过比较胚胎停育患者与非胚胎停育患者绒毛及蜕膜组织中PRX3的表达变化,进一步探索PRX3在妊娠中的抗氧化功能,并从新的角度探讨胚胎停育的发病机制。
1 对象和方法
1.1 对象 选取2017年12月至2018年5月因胚胎停育实施人工流产的患者60例作为胚胎停育组,同期因意外怀孕要求终止妊娠的非胚胎停育患者60例作为对照组。人工流产术后,均无菌操作留取两组患者的绒毛及蜕膜组织。两组患者年龄、BMI、孕周、胎芽大小比较差异均无统计学意义(均P>0.05),见表1。本研究经滨州医学院医学伦理委员会批准和患者知情同意。
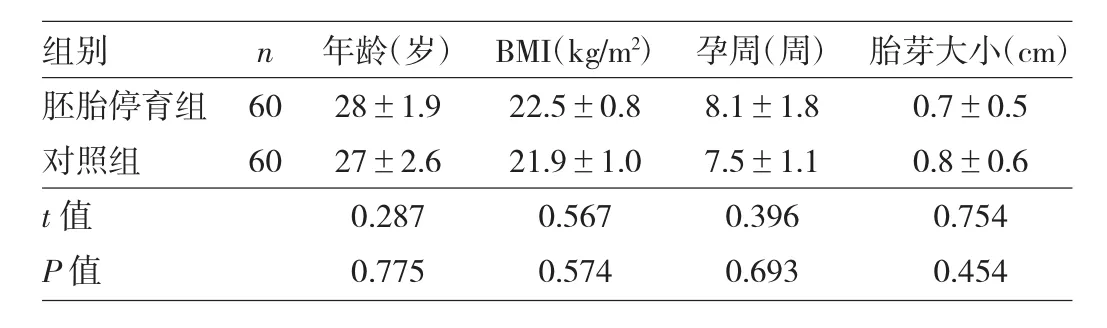
表1 两组患者一般资料比较
1.2 主要试剂和仪器 实时定量PCR SYB Green试剂盒购自日本TaKaRa公司,第一抗体兔抗PRX3多克隆抗体、兔抗β-actin多克隆抗体、第二抗体生物素标记的羊抗兔IgG购自英国Abcam公司,硝酸纤维素膜购自美国Millipore Corporation公司,ECL化学发光试剂盒购自英国Amersham公司。Gel-Pro Analyzer购自美国Media Cybernetics公司,提取RNA用Trizol试剂购自美国Invitrogen公司,蛋白测定试剂盒、PCR扩增仪(Bio-Rad iCycler)购自美国 Bio-Rad公司,TIANScript cDNA第一链合成试剂盒购自北京天根生化科技有限公司。
1.3 方法
1.3.1 绒毛及蜕膜组织中PRX3 mRNA表达水平检测采用实时定量PCR法。将绒毛及蜕膜组织洗净后剪碎,采用Trizol法提取绒毛及蜕膜组织总RNA,将RNA反转录为cDNA。实时定量PCR反应条件:95℃ 3min,(95℃ 15s,60℃ 60s)×40 个循环;反应体积为 50μl。以β-actin为内参。PRX3上游引物:5′-CAGCCGTTGTCAATGGAGAG-3′, 下 游 引 物 :5′-TCACATCGTGAAATTCGTTAGC-3′;β -actin 上 游 引 物 :5′-CGGCCAGGTCATCACCATTG-3′,下游引物:5′-CCGCCAGACAGCACTGTGTTG-3′。相对表达量以公式 2-ΔCt×106计算,其中 Ct=(CtPRX3-Ctβ-actin)。
1.3.2 绒毛及蜕膜组织中PRX3蛋白表达水平检测采用Western blot法。将绒毛及蜕膜组织剪碎,匀浆器匀浆后加入适量裂解液裂解约30min,在4℃条件下以12 000rpm离心5min,吸取上清液分装于0.5ml离心管中。利用蛋白测定试剂盒检测蛋白质浓度后,取等量的上清液样品用15%聚丙烯酰胺凝胶电泳分离,然后转到硝酸纤维素膜上。第一抗体稀释浓度为1∶2 000,第二抗体稀释浓度为1∶1 000,用ECL化学发光试剂盒显色。将胶片放入机器进行扫描,利用Gel-Pro Analyzer分析判读目标带的分子量和积分光密度值(integrated optical density,IOD),通过比较目标蛋白PRX3与内参蛋白β-actin的IOD值,获知PRX3的相对表达量。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者绒毛及蜕膜组织中PRX3 mRNA表达水平比较 胚胎停育组患者绒毛及蜕膜组织中PRX3 mRNA表达水平均高于对照组,差异均有统计学意义(均P<0.05),见表 2。

表2 两组患者绒毛及蜕膜组织中PRX3 mRNA表达水平比较
2.2 两组患者绒毛及蜕膜组织中PRX3蛋白表达水平比较 胚胎停育组患者绒毛及蜕膜组织中PRX3蛋白表达水平均高于对照组,差异均有统计学意义(均P<0.05),见表 3。
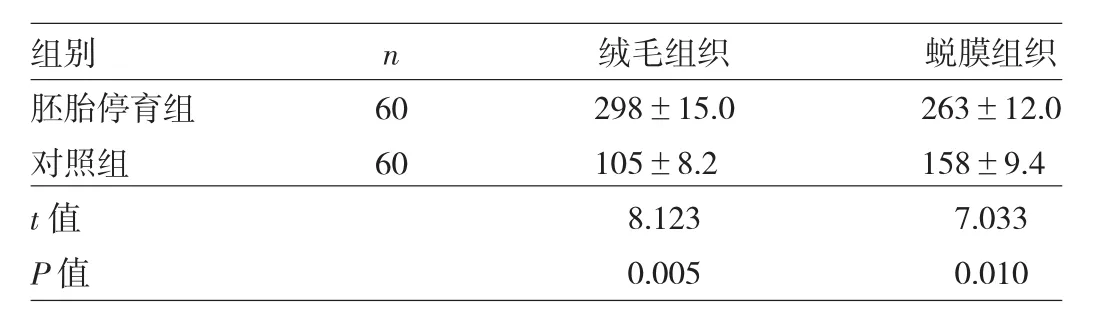
表3 两组患者绒毛及蜕膜组织中PRX3蛋白表达水平比较
3 讨论
本研究结果表明,胚胎停育患者绒毛及蜕膜组织中PRX3 mRNA和蛋白表达水平均升高,说明在胚胎停育患者绒毛及蜕膜组织中存在氧化应激状态,同时也说明PRX3在应对胚胎停育患者的氧化应激状态方面,发挥积极作用。
PRX3作为线粒体内的抗氧化蛋白,可以清除线粒体内90%的过氧化氢,在维持线粒体的功能稳定方面发挥重要作用[5]。本研究发现胚胎停育患者绒毛组织中PRX3 mRNA和蛋白表达水平均高于同期正常妊娠的绒毛组织。推测胚胎停育患者绒毛组织所产生的活性氧自由基过多,超出了机体清除氧化物的能力,因而PRX3的表达反应性上调,以缓解氧化应激状态。这一结果表明在应对胚胎停育患者的氧化应激状态方面,PRX3的作用同样重要。如前所述,引起自然流产的因素包括胚胎因素、母体因素、父方因素、环境因素等。在发病机制方面,其中的作用环节与氧化应激状态有关[7-8]。氧化应激状态通过影响孕囊着床、胚胎和胎盘发育、胎盘血管生成与血流分布等,成为自然流产的发病机制之一[9-10]。关于氧化应激发生的原因,日本学者Ishii等[11]利用转基因小鼠所做的动物实验研究发现,当线粒体的呼吸链发生异常时,会出现一种慢性的氧化应激状态,进而影响小鼠的生殖功能和妊娠结局,包括不孕不育、自然流产、复发性流产、甚至母体死亡。进一步研究发现,这种转基因小鼠的胎盘血管发育不良,导致胎盘的炎症反应和胚胎的血管生成异常。伊朗学者Gharesi-Fard等[12-13]报道,在患有自身免疫性疾病的复发性流产患者中,其胎盘和血清中均检测到抗PRX3自身抗体,说明PRX3参与胚胎着床和胎盘形成。本研究中,胚胎停育患者蜕膜组织中PRX3的表达同样升高,说明该类患者的宫腔内也存在氧化应激状态。伊朗学者Rahiminejad等[14]对100例接受体外受精-胚胎移植的患者进行了研究,在胚胎移植前吸取子宫内膜分泌物(宫腔液)1~2ml,检测其中的氧化应激状态,包括超氧化物歧化酶和过氧化氢酶活性、脂质过氧化物水平、硫醇基化合物水平以及总的抗氧化能力。结果发现28例临床妊娠患者宫腔液中抗氧化酶水平或者总的抗氧化能力明显高于移植失败或早期流产患者,说明子宫内膜的抗氧化酶活性对于维持妊娠非常重要。Liu等[15]研究发现,在早期自然流产的蜕膜细胞中,存在内质网应急和氧化应激状态,并出现细胞凋亡征象,表现为内质网膨胀,Caspase-4和Caspase-12激活等,说明宫腔内的氧化应激状态与自然流产的发生密切相关。
综上所述,胚胎停育患者存在氧化应激状态,PRX3作为线粒体内重要的抗氧化蛋白,在绒毛及蜕膜组织中的表达反应性升高,对于维持妊娠具有重要作用。换而言之,PRX3可能不是自然流产的致病因素,而是抑制自然流产进展的利好因素。对先兆流产患者补充抗氧化剂,可能有利于改善妊娠结局。关于PRX3在自然流产中的作用机制,尚需要进一步研究。

