急性肝衰竭模型猪微环境对脂肪间充质干细胞生物学特性的影响
郭瑞红 潘小平 侯晓丽张 悦 江夏薇 汪恬甜刘寿荣
间充质干细胞(mesenchymal stem cells,MSC)移植治疗终末期肝病获得较多的关注,其来源众多,主要包括骨髓、脂肪组织、羊膜、胎盘、脐带血等[1-5]。动物实验和临床研究显示,MSC移植治疗终末期肝病,可明显提高患者的生存率,改善患者肝功能。与骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)相比[6],脂肪间充质干细胞(adipose derived mesenchymal stem cells,ADMSCs)分化为肝细胞的潜能更大,并且从慢性乙肝患者身上分离出的ADMSCs在培养时不易感染乙型肝炎病毒,因此,ADMSCs更适合作为慢性乙型肝炎患者的细胞替代治疗。Mohsin等人[7]在体外模型中用损伤的肝组织预处理MSC,结果显示提高了MSC中肝细胞特异性基因的表达。从肝损伤大鼠中分离的血清提高了BMSCs的肝向分化功能,并且证明比肝细胞生长因子更为有效,这表明某些病理环境可能影响MSC的特征[8]。然而,尚不清楚肝衰竭患者的ADMSCs是否因肝功能障碍而改变,以及从终末期肝病患者中分离的ADMSCs是否是自体移植的潜在候选者。小型模型猪在解剖、生理和生物化学等方面与人类相似,可作为人类医学研究的最理想的模型动物[9],因此,本研究获取猪ADMSCs进行比较。通过对比急性肝衰竭猪脂肪来源的间充质干细胞(adipose derived mesenchymalstem cellsfrom acute liverfailure porcine,ALF-ADMSCs)和正常猪来源的 ADMSCs(adipose derived mesenchymal stem cells from normal porcine,Nor-ADMSCs)的细胞形态,细胞表型,增殖能力,分化潜能等来鉴定急性肝衰竭对猪ADMSCs生物学特性的影响。
1 材料与方法
1.1 实验动物 选用雄性微型巴马猪2只,体质量10~12kg,购自上海甲干生物科技有限公司,实验动物许可证号:SCXK(沪)2015-0005,由浙江中医药大学实验动物中心[合格证号:SYXK(浙)2013-0184]饲养。饲养期间给予标准饲料及自由饮水,12h黑白循环灯光,恒定温度及湿度。本研究经过浙江中医药大学实验动物管理与伦理委员会审核通过(批准编号:1ACUC-20180326-10)。
1.2 主要仪器和试剂 仪器:PCR仪(美国Applied Biosystems公司)、倒置相差显微镜(德国ZEISS公司)、CO2培养箱(美国 Thermo公司)。试剂:D-半乳糖胺、油红 O 染色液、胰岛素(insulin)、3,3',5-三碘L-甲状腺原氨酸(T3)、吲哚美辛、地塞米松、3-异丁基-1-甲基黄嘌呤、罗格列酮(rosiglitazone)均购自美国sigma公司;丙泊酚(西安力邦制药有限公司11712011);RT-PCR 试剂盒(康为世纪公司 10209);逆转录试剂盒 (TaKaRa #AK4802);RNAiso Plus(TaKaRa 108-95-2);成骨分化培养基(Gibco 1872976),成软骨分化培养基(Gibco 1867431);肝细胞生长因子(Peprotech 0510S201),成纤维细胞生长因子(Peprotech 041408-2),胰岛素铁硒传递蛋白(Sigma SLBN1805V);CCK8试剂盒(上海碧云天生物技术有限公司032718180410);茜素红染色液(赛业生物科技有限公司T170113G001);阿利新蓝染色液(上海源叶生物科技有限公司L06D8G49787);糖原染色试剂盒(sigma-alorich 061M4347);小鼠单克隆抗体CD14-PE、CD105-PE以及同型对照PE-IgG2a均购自英国Abcam公司;引物由上海生工生物工程技术有限公司合成。
1.3 急性肝衰竭猪模型建立 两只微型巴马猪实验前按照实验动物标准饲养1周。1只用于制备Nor-ADMSCs。另1只通过颈静脉注射D-半乳糖胺以建立急性肝衰竭模型猪。颈静脉置管前肌肉注射氯胺酮4mg/kg,手术期间通过耳缘静脉施用丙泊酚以2.5mg·kg-1·h-1提供持续麻醉。颈静脉置管和麻醉在30min内完成操作。D-半乳糖胺溶于5%葡萄糖溶液中,用氢氧化钠调节PH至6.8,再以0.22μm过滤器过滤后以1.5g/kg通过颈静脉插管注入[10]。D-半乳糖胺诱导24h后,采用麻醉后放血法处死微型猪。收集血清和肝脏病理组织以检测造模是否成功。
1.4 猪ADMSCs分离、培养 获取微型猪腹部和颈部脂肪组织,分离好的脂肪组织在严格无菌条件下,用4℃含2%青链霉素的磷酸缓冲溶液(PBS)充分洗涤。在含有0.1%胶原酶溶液中充分切碎组织,37℃下消化90min。每隔15min用移液管吹打混匀,以免过度消化。加入低糖培养基终止消化,在室温下离心(700g,10min),弃去上清液。再加入低糖培养基重悬细胞,100目筛网过滤,在室温下离心(700g,10min)后,重新悬浮在含有10%胎牛血清(FBS)和1%青霉素和链霉素的低糖培养基中。随后将细胞接种到T25培养瓶中,并置于37℃,5%CO2的培养箱中。当细胞达到70%~80%融合时,选择形态均一、生长良好者按1:2或1:3传代,每隔3d换液一次,第3代以后即可用于细胞表型鉴定及分化实验。
1.5 细胞表型鉴定 取第3代猪ALF-ADMSCs和Nor-ADMSCs,用含体积分数为3%胎牛血清的PBS洗涤3次,制成单细胞悬液,调整细胞浓度至5×106/mL,加入荧光标记小鼠单克隆抗体CD14-PE、CD105-PE、CD44-FITC、CD90-FITC、CD29-FITC,PE-IgG2a、FITC-IgG2a、FITC-IgG1 作为同型对照。室温避光孵育30min,PBS洗涤数次后用流式细胞仪检测表面分子标记。
1.6 增殖能力测定 收集第5代对数生长期ALFADMSCs和Nor-ADMSCs,制备单细胞悬液,以每孔2000个细胞接种于96孔板(100μL/孔),并置于37℃,5%CO2的培养箱中培养。培养24h后取出一块96孔板,每孔加入10μL CCK8溶液,随后在CO2培养箱中孵育3h,酶标仪450nm处测定各孔吸光度值(OD值)。每天同一时间取出一块96孔板重复以上操作,连续监测7d,每个时间点重复4次,计算每组细胞OD值。
1.7 多向分化潜能鉴定 取生长状况良好的第4代ALF-ADMSCs和Nor-ADMSCs,接种于6孔板内,每孔1×105个细胞,待细胞达到100%融合后更换为成骨、成脂、成软骨诱导培养基。其中,成骨分化加入成骨诱导培养基,每隔3d换液,连续培养21d后行茜素红S染色。成脂分化诱导培养基配制如下:诱导培养第0d,即第一次加入诱导培养基,在含10%FBS的低糖培养基中加入insulin 5μg/mL,T3 1nM,吲哚美辛 0.125μM,地塞米松 2μg/mL,3-异丁基-1-甲基黄嘌呤 0.5mM,rosiglitazone 0.5μM。诱导培养第 2d,在含10%FBS的低糖培养基中加入insulin 5μg/mL,T3 1nM,rosiglitazone 0.5μM。诱导培养第 4d,在含 10%FBS的低糖培养基中加入insulin 5μg/mL,T3 1nM,rosiglitazone 1μM。第6d诱导培养基同第4d,共诱导8d,可见脂滴形成,并进行油红O染色。成软骨分化加入软骨诱导培养基,每隔3d换液,连续培养21d后行阿利新蓝染色。
诱导结束后用Trizol法提取细胞总RNA,RT-qPCR检测成骨、成脂、成软骨特异性标记物的表达。按照TaKaRa逆转录试剂盒说明书将RNA逆转录成cDNA(引物序列见表 1)。qPCR采用 UltraSYBR Mixture(Low ROX)说明书进行操作,反应条件如下:预变性:95℃ 10min,变性:95℃ 15s,退火延伸:60℃1min,40个循环。以 GAPDH为内参基因,Nor-ADMSCs和ALF-ADMSCs未分化细胞为对照组,计算两组细胞成骨、成脂、成软骨待测基因2-ΔΔCt值并进行数据处理,每组实验至少重复3次。
1.8 成肝诱导分化及鉴定 参照参考文献[11]的诱导方法,取生长状况良好的第4代ALF-ADMSCs和Nor-ADMSCs,加入肝细胞生长因子20ng/mL,成纤维细胞生长因子20ng/mL,地塞米松40nmol/mL,1%胰岛素铁硒传递蛋白,含5%FBS的低糖培养基,每隔2d换液1次,观察细胞形态,于诱导第21d进行糖原染色,并收集细胞鉴定类肝细胞特异性标志(引物序列见表1)。
1.9 统计学方法 应用GraphPad Prism 6.0软件进行数据分析,所有计量资料数据以均数±标准差(±s)表示,两组间均数比较采用t检验,多组间均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 正常猪和肝衰竭猪血清生化及病理学检测结果
正常猪血清学指标如下:丙氨酸氨基转移酶52.100IU/L、天门冬氨酸氨基转移酶53.800IU/L、总胆红素 1.740μmol/L、直接胆红素 1.030μmol/L、血清总蛋白37.980g/L、白蛋白70.800g/L。肝衰竭猪血清学指标:丙氨酸氨基转移酶437.300IU/L、天门冬氨酸氨基转移酶13805.000IU/L、总胆红素32.570μmol/L、直接胆红素24.650μmol/L、血清总蛋白37.840g/L、白蛋白61.500g/L。与正常猪相比,肝衰竭猪血清中丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、总胆红素、直接胆红素水平显著升高,血清总蛋白及白蛋白降低。正常猪肝组织切片HE染色显示肝小叶结构完整,无肝细胞肿大和坏死。肝衰竭猪肝组织切片可见肝细胞界限不清,呈大片状坏死,坏死区可见炎症细胞浸润,肝窦淤血扩张(见插页图1)。血清学指标及病理组织学表明成功建立猪肝衰竭模型。

表1 引物序列
2.2 细胞形态比较 ALF-ADMSCs和Nor-ADMSCs在接种24h后均可见以散在的方式贴壁生长,以长梭形为主,散在一些多角形、长圆形细胞,细胞增殖较缓慢,原代培养第4d细胞达90%融合(图2A、B)。按1:2传代至第5代时,两组细胞均增殖加速,细胞质丰富,细胞变大而扁平,同时以集落方式生长,呈漩涡状分布(见插页图2C、D)。
2.3 流式细胞表型鉴定比较 流式细胞仪检测结果显示,第 3代 ALF-ADMSCs CD105、CD90、CD14表达阳性率分别为(79.47±6.78)%、(56.83±4.23)%、(0.17±0.05)%。第 3代 Nor-ADMSCs CD105、CD90、CD14 表达阳性率分别为(77.7±4.60)%、(59.47±7.49)%、(0.03±0.05)%。结果表明,ALF-ADMSCs和Nor-ADMSCs均高表达间充质干细胞表面标记CD105、CD90,不表达或低表达干细胞表面标记CD14(见插页图 3)。
2.4 细胞增殖比较 通过CCK8法对第5代ALFADMSCs和Nor-ADMSCs的生长趋势进行了对比分析(表2)。通过比较两组细胞450nm处OD值可以看出,两组细胞的增殖速率十分相似,在第1~2d非常缓慢,处于细胞生长潜伏期,在培养第4d后进入对数生长期,第7d后细胞生长放慢。两组细胞之间差异无统计学意义(P>0.05)。见表 2。
2.5 多向分化潜能比较 在成骨诱导培养第21d,两组细胞茜素红S染色显示,细胞胞浆内均可见被染为红色的矿化结节(图4A、B)。成脂诱导第8d,两组细胞油红O染色显示,细胞胞浆可见小而圆的红色脂肪滴(图4C、D)。成软骨诱导培养第21d,两组细胞阿利新兰染色可见单个分布的软骨细胞,细胞呈不规则形,胞核呈圆形或椭圆形(见插页图4E、F)。RT-qPCR结果显示,成骨分化21d后ALF-ADMSCs和Nor-ADMSCs中成骨标记物[碱性磷酸酶(alkaline phosphatase)、骨桥蛋白(osteopontin)]显著增加,脂肪分化8d后ALF-ADMSCs和Nor-ADMSCs中脂肪源性标记物[脂蛋白(LPA)和过氧化物酶体增殖物激活受体(PPARy2)]均显著增加,软骨分化21d后ALFADMSCs和Nor-ADMSCs中软骨标记物[聚蛋白多糖(Aggrecan)和Ⅱ型胶原蛋白(ColⅡ)]均显著增加(表3)。
表2ALF-ADMSCs和Nor-ADMSCs细胞增殖能力比较(OD 值,±s)
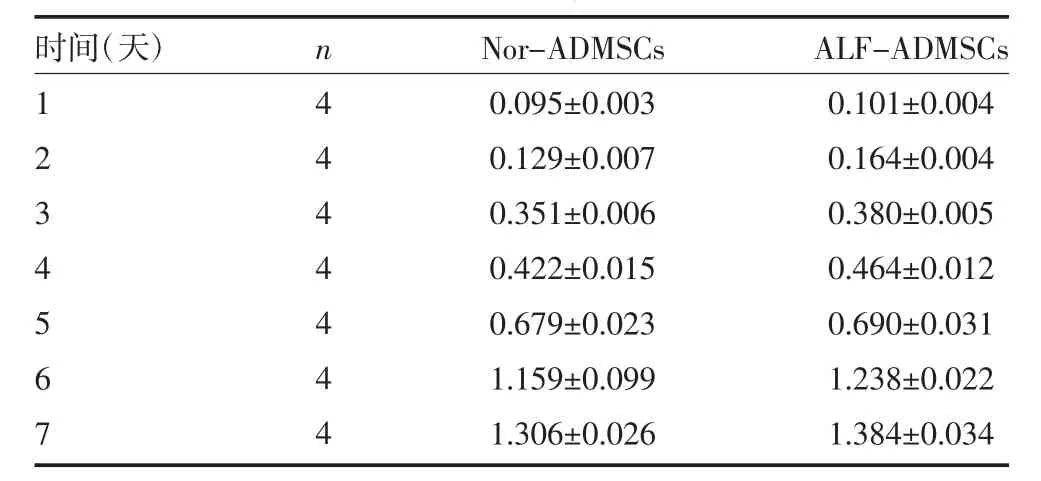
表2ALF-ADMSCs和Nor-ADMSCs细胞增殖能力比较(OD 值,±s)
注:每个时间点重复4次,计算两组细胞OD值;ALF-ADMSCs:急性肝衰竭猪脂肪间充质干细胞;Nor-ADMSCs:正常猪脂肪间充质干细胞
时间(天)1 2 3 4 5 6 7 n 4 4 4 4 4 4 4 Nor-ADMSCs 0.095±0.003 0.129±0.007 0.351±0.006 0.422±0.015 0.679±0.023 1.159±0.099 1.306±0.026 ALF-ADMSCs 0.101±0.004 0.164±0.004 0.380±0.005 0.464±0.012 0.690±0.031 1.238±0.022 1.384±0.034
2.6 成肝分化潜力比较 ALF-ADMSCs和Nor-ADMSCs诱导21d后,均可见不规则多边形的类肝细胞形成,糖原染色可见细胞胞浆内紫色沉淀(见插页图 5)。
RT-qPCR检测ALF-ADMSCs和Nor-ADMSCs成肝分化后两组细胞白蛋白(ALB)、肝细胞生长因子(HGF)、葡萄糖-6-磷酸脱氢酶(G6PD)、肝细胞核因子-1A(HNF1A)和肝细胞核因子-1B(HNF1B)等肝细胞特异性标记物的表达,结果显示,ALFADMSCs和Nor-ADMSCs均高表达肝细胞表面标记物,但两组细胞间表达差异无统计学意义(P>0.05)。
表3 两组细胞成骨、成脂、成软骨及成肝分化后特异性基因相对表达量(2-ΔΔCt值,±s)

表3 两组细胞成骨、成脂、成软骨及成肝分化后特异性基因相对表达量(2-ΔΔCt值,±s)
注:每个基因重复检测 3 次,计算 2-ΔΔCt值。alkaline phosphatase:碱性磷酸酶;osteopontin:骨桥蛋白;Aggrecan:聚蛋白多糖;ColⅡ:Ⅱ型胶原蛋白;LPA:脂蛋白;PPARy2:过氧化物酶体增殖物激活受体;ALB:白蛋白;G6PD:葡糖糖-6-磷酸脱氢酶;HGF:肝细胞生长因子;HNF1A:肝细胞核因子-1A;HNF1B:肝细胞核因子-1B;ALFADMSCs:急性肝衰竭猪脂肪间充质干细胞;Nor-ADMSCs:正常猪脂肪间充质干细胞
基因alkaline phosphatase osteopontin Aggrecan colⅡLPA PPARy2 ALB G6PD HGF HNF1A HNF1B n 3 3 3 3 3 3 3 3 3 3 3 Nor-ADMSCs 3.241±0.062 2.903±0.584 2.702±0.601 5.411±1.301 74.242±8.383 5.802±0.222 2.603±0.321 2.831±0.382 2.432±0.532 2.014±0.303 2.512±0.164 ALF-ADMSCs 3.592±0.250 4.262±0.560 1.761±0.322 4.633±0.651 56.234±8.461 4.072±0.160 2.801±0.622 2.733±0.111 2.021±0.212 2.170±0.011 2.291±0.164
RT-qPCR检测未分化ALF-ADMSCs和Nor-ADMSCs中肝细胞特异性基因的表达,结果显示,与Nor-ADMSCs相比,ALF-ADMSCs中HGF的表达高于 Nor-ADMSCs (12.48±0.59)倍(P<0.01)。ALB、HNF1A、HNF1B、G6PD的表达两组细胞差异无统计学意义(P>0.05)。见表 4。
3 讨论
间充质干细胞可通过免疫调节、抗炎作用、旁分泌作用以及体内直接分化为肝细胞样细胞,从而促进肝再生,发挥治疗终末期肝病的作用[12]。研究表明,67(±0.8)mL大腿外侧脂肪抽吸物中可得到12.31(±1.2)×106间充质干细胞,ADMSCs获取方便,细胞产量相当可观,在MSC治疗肝脏疾病中引起了极大的关注[13]。多项急性肝衰竭动物模型表明,脂肪来源的MSCs可显著改善模型动物的肝脏血清学指标,病理组织形态及生存率等[14-15]。
本研究主要比较两种来源的ADMSCs的体外特征。结果显示,两组细胞形态并无差异,增殖能力相似,多向分化潜能相当,且均高表达间充质干细胞表面分子标记物,低表达造血干细胞标记物。ALFADMSCs可在体外诱导分化为类肝细胞,与Nor-ADMSCs相比,两者成肝分化潜能相当。本研究结果显示,ALF-ADMSCs高表达HGF。HGF具有抗细胞凋亡、抗纤维化和促细胞再生的功能,在肝细胞的发育和再生中起着不可替代的作用,其为各种组织来源的干细胞体外分化为肝细胞提供微环境,并且是分化为类肝细胞的关键因素。提示我们,ADMSCs在肝衰竭微环境的影响下高表达HGF,这将为细胞自体移植治疗终末期肝病提供依据。
表4ALF-ADMSCs和Nor-ADMSCs中肝脏特异性基因的表达量(2-ΔΔCt值,±s)
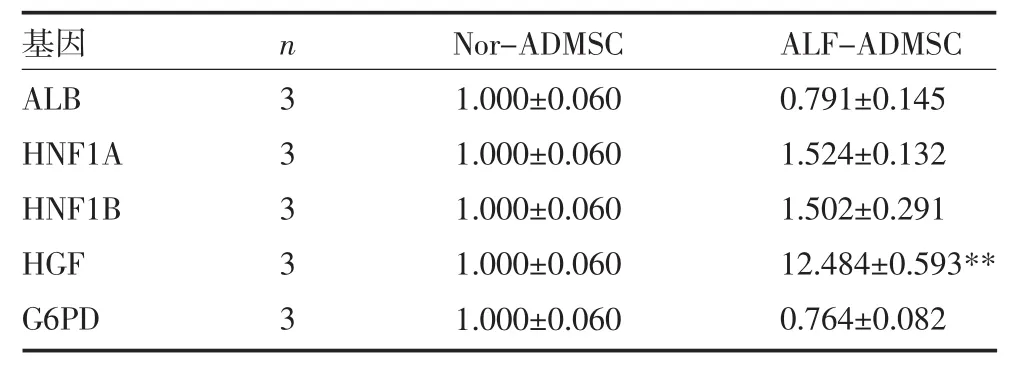
表4ALF-ADMSCs和Nor-ADMSCs中肝脏特异性基因的表达量(2-ΔΔCt值,±s)
注:与 Nor-ADMSCs比较,**P<0.01。每个时间点重复 4 次,计算 2-ΔΔCt;ALF-ADMSCs:急性肝衰竭猪脂肪间充质干细胞;Nor-ADMSCs:正常猪脂肪间充质干细胞;ALB:白蛋白;HNF1A:肝细胞核因子-1A;HNF1B:肝细胞核因子-1B;HGF:肝细胞生长因子;G6PD:葡糖糖-6-磷酸脱氢酶
基因ALB HNF1A HNF1B HGF G6PD n 3 3 3 3 3 Nor-ADMSC 1.000±0.060 1.000±0.060 1.000±0.060 1.000±0.060 1.000±0.060 ALF-ADMSC 0.791±0.145 1.524±0.132 1.502±0.291 12.484±0.593**0.764±0.082
综上所述,肝衰竭不影响ADMSCs的细胞形态学,增殖能力,MSC特异性标记物的表达以及多向分化潜能。但ALF-ADMSCs可在体外高表达HGF,与Nor-ADMSCs体外成肝分化潜能相比,二者却并无差异。有文献报道[16],过表达HGF的ADMSCs可显著改善辐射诱导的大鼠肝损伤模型,增强ADMSCs的治疗潜力,因此,还需在体内继续验证急性肝衰竭来源的ADMSCs是否优于正常供者来源的ADMSCs,进一步明确来自肝损伤患者的ADMSCs是否以某种方式改变进而影响其治疗潜能。

