后腹腔镜肾部分切除术与开放肾部分切除术治疗局限性肾癌的疗效分析
拓志勇, 魏秀丽, 夏 勇, 邵林海, 兰海河, 汪 洋
(陕西省汉中市中心医院 泌尿外科, 陕西 汉中, 723000)
肾脏肿瘤是目前临床上最常见的泌尿系统肿瘤之一,以肾细胞癌最为常见,局限性肾癌泛指局限于肾内的肾细胞癌,是发病率最高的肾细胞癌[1-3]。研究[4-5]指出,早期手术可显著提高生存率,降低癌转移率,因此手术是针对该病的治疗金标准。本研究探讨后腹腔镜肾部分切除术与开放肾部分切除治疗局限性肾癌的疗效,将结果报告如下。
1 资料与方法
1.1 一般资料
收集2015年6月—2017年6月入院的80例局限性肾癌患者随机分为2组,每组40例。所有患者经CT平扫+增强与静脉肾盂造影等影像学检查确诊,纳入标准为[6]: ① 未发现下腔静脉、深静脉、肾上腺、肾蒂淋巴结等处癌转移或癌栓形成患者; ② 单侧局限肾癌,对侧肾脏无器质性病变患者; ③无既往腹膜后手术或感染史患者等。同时排除[7- 8]: ① 影像学分期不符合局限性癌症患者; ② 有手术禁忌证或存在远期失访风险患者; ③ 解剖或功能性孤立肾肾癌患者等。后腹腔镜组男24例,女16例; 年龄41~63岁,平均(50.2±7.4)岁; 肿瘤直径1.8~6.2 cm, 平均(3.7±1.5) cm; 透明细胞癌34例,乳头状肾细胞癌5例,嫌色细胞癌1例。开放组男25例,女15例; 年龄40~65岁,平均(50.7±7.8)岁; 肿瘤直径1.6~6.5 cm, 平均(3.9±1.8) cm; 透明细胞癌35例,乳头状肾细胞癌4例,嫌色细胞癌1例。2组患者性别、年龄、肿瘤直径与病理分型等一般情况差异无统计学意义(P>0.05), 具有可比性。
1.2 方 法
后腹腔镜组患者行后腹腔镜肾部分切除术,具体步骤如下。导尿排空后患者取仰卧位并于气管内插管麻醉; 更改体位为健侧卧位并抬高腰桥,上顶腰部,撑开肋腰间隙; 准备双手重叠无菌手套并于袖口留置8号简易导尿管,形成简易扩张气囊; 以腋后线12肋下3 cm平行肋骨切口(A切口),逐层分离组织直至腰背筋膜,进入后膜间隙钝性扩大后膜间隙; 放置自制扩张气囊并注入500 mL生理盐水,放置5 min后取出并观察; 再分别鱼腋中线髂棘上2 cm(B切口)与腋前线肋缘下(C切口)做1 cm切口,分别留置12 mm与5 mm Troca; A处留置10 mm Troca并建立人工气腹, B处置入观察镜, A、C分别置入分离钳与超声刀; 腰大肌前切开椎筋膜并游离,可见束状隆起、肾动脉与肾盂,以吸引器梳理淋巴管与血管鞘; 游离肾门并近端夹闭离断肾动脉与深静脉,拉低夹闭离断输尿管,避开腺体血管; 切开肾周筋膜,充分暴漏肿瘤实质,阻断肾动脉前,静脉滴注肌酐,沿切除界限切除肿瘤与周围0.5 cm组织,创面电凝止血并缝合关闭,结扎缝合肾实质后恢复肾脏血流,常规关闭切开并放置引流管。开放组患者则予以开放肾部分切除术,即全身麻醉后取健侧卧位,于11或12肋间作切口并分离至肾脏,分离肾蒂血管并在阻断前滴注肌酐,根据肿瘤边缘行肾部分切除,以3.0可吸收线缝合出血点,生物蛋白胶填涂肾实质缺损处并行Vicryl线褥式缝合,常规关闭切口并放置引流。
1.3 检测方法
本研究随访周期为1年,剔除死亡病例后,以癌症特异性生存质量量表(QLQ-C30)评价生存质量,包括总健康领域与症状子量表2个部分,总健康领域评分越高与症状子量表评分越低代表生存质量越高。
1.4 统计学分析

2 结 果
2.1 2组患者围手术期指标比较
后腹腔镜组患者下床时间、肾窝引流总量与术后住院时间均显著优于开放组,差异有统计学意义(P<0.05)。见表1。
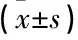
表1 2组患者围手术期指标比较
与开放组比较, *P<0.05。
2.2 2组患者治疗前后血红蛋白与肌酐水平比较
后腹腔镜组患者术后Hb水平显著高于开放组, Cr水平显著低于开放组,差异有统计学意义(P<0.05)。见表2。
2.3 2组患者生存曲线比较
后腹腔镜组患者平均生存期为(11.78±0.13)月,存活36例, 1年生存率为90.00%; 开放组患者平均生存期为(11.28±0.21)月,存活29例, 1年生存率为72.50%。经Log-rank比较,后腹腔镜组1年总生存率显著高于开放组,差异有统计学意义(P<0.05)。见图1。
表2 2组患者治疗前后血红蛋白与肌酐水平比较
Hb: 血红蛋白; Cr: 肌酐。与术前比较, *P<0.05; 与开放组比较, #P<0.05。
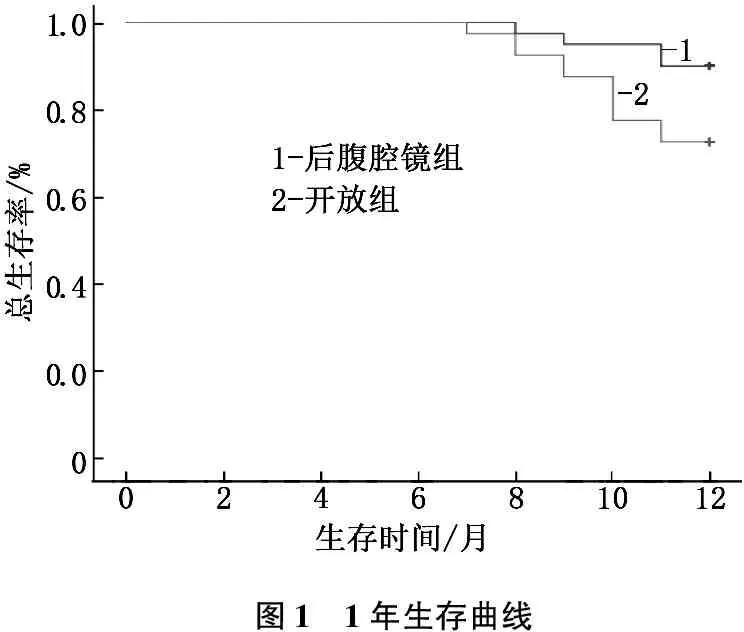
图1 1年生存曲线
2.4 2组存活患者远期生存质量比较
随访1年后,剔除死亡病例后后腹腔镜组共36例,开放组29例。后腹腔镜组患者术后1年躯体领域与角色领域评分均显著高于开放组,疲倦、疼痛与失眠评分均显著低于开放组,差异有统计学意义(P<0.05)。见表3。
3 讨 论
据最新流行病学资料显示,肾脏肿瘤占全部肿瘤的2%~3%, 其中局限性肾细胞癌占80%以上,发病率达(4.1~11.1)/100 000万,是起源于肾实质泌尿小管上皮系统的恶性肿瘤,具有一定转移率,严重威胁患者生命健康与生存质量[9-11]。局限性肾癌治疗原则为早期手术,其中根治性肾切除术一直作为局限性肾癌的治疗金标准,其根治范围包括肾周筋膜、肾周脂肪、患侧肾、肾上腺、血管组织、淋巴管与髂血管分差上输尿管等,术后仅能通过血液透析维持生命,因此术后患者的生存质量极低[12-13]。有研究[14-15]提出,在保留周围正常肾组织的前提下,成功切除局限性肾癌病灶亦可达到良好的治疗效果,并能最大限度保留残肾的肾脏功能。后腹腔镜肾部分切除术与开放肾部分切除术是现阶段临床上应用最多的2种肾局限性癌症部分切除术式,其中开放性手术自11或12肋间进入肾脏,并根据肿瘤边缘行肾部分切除,可达到临床目标,但创伤较大,机体应激强烈,患者术后恢复效率低,易产生严重并发症,因此术后预后存在问题[16-18]。腹腔镜技术属于新型微创术式,具有术后痛苦小、恢复快等优点,并尽可能避免开放性手术特有的并发症,减少全身麻醉后遗症,但对于术者操作技术要求较高,因此在临床上亦存在争议[19-20]。
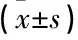
表3 2组存活患者远期生存质量 分
与术前比较, *P<0.05; 与开放组比较, #P<0.05。
为探讨后腹腔镜肾部分切除术与开放肾部分切除治疗局限性肾癌的疗效,将本院80例对象进行手术对比并随访。结果显示,后腹腔镜组患者下床时间、肾窝引流总量与术后住院时间均显著性低于开放组; 术后Hb水平组间比较显著性高于开放组,Cr水平显著性低于开放组; 1年总生存率显著高于开放组; 术后1年躯体领域与角色领域评分组间比较均显著性高于开放组,疲倦、疼痛与失眠评分均显著性低于开放组。
综上所述,与传统术式比较,后腹腔镜肾部分切除术可显著提高术后恢复效率,降低引流量,稳定肾脏功能,提升远期生存率与生存质量。综上所述,相比较开放肾部分切除术,后腹腔镜肾部分切除术治疗局限性肾癌的恢复效率更高,远期生存率与生存质量效果更为优异。

