绿色荧光碳点的快速宏量制备及其在细胞成像中的应用
张俊莉,赵雪微,贾晶,双少敏
(山西大学 化学化工学院,山西 太原 030006)
0 引言
碳点作为一种新型的超小碳纳米颗粒,与传统的量子点[1]相比,具有制备简单、碳源丰富、耐光漂白、荧光可调、亲水性强、表面易功能化以及生物相容性好等优点[2-3],因此在生物传感、生物成像及药物载体等领域显现出重要的应用价值[4-5]。
碳点的制备方法现主要分为两大类:自上而下法,包括激光消融法[6]、电弧放电法[7]以及电化学法[8]等,和自下而上法,包括热解法[9]、水热法[10]和微波法[11]等。前者系将碳源以切割或氧化的手段由大尺寸变为纳米级尺寸,得到的碳点粒径均匀,但制备过程冗长复杂、合成条件严苛、碳源较单一、成本高、产率低。而后者系以小分子为前体,通过一系列化学反应得到目标碳点,其过程较简单、易于控制、碳源丰富易得、成本较低。不仅有机小分子[11-12]可作其碳前驱体,生物碳源[13-16]由于绿色环保、物种多样且储量大的优势也受到广泛关注,比较而言,更适合碳点的宏量制备。目前,生物碳源用于制备碳点多采用简单易行的水/溶剂热法和热解法,已有文献报道以生物碳源进行碳点的宏量制备。Sahu等[17]将40 mL橙汁与30 mL乙醇混合,通过水热法(120℃、2.5 h)制备出0.4 g碳点。相比于液态的橙汁,Hsu等[18]采用固态的咖啡粉作碳源,对其进行高温热解(300℃、2 h),从1 g咖啡粉中制得0.12 g碳点,产率达12%。最近,Zhang等[19]以花粉为碳源,水热(180℃、48 h)合成碳点,可从10 g花粉中至少得到3 g碳点,其合成产率明显得到提高,最高达到了38%。以上方法利用生物碳源宏量合成碳点操作简单、可一步制备,无须使用昂贵仪器。但是,其反应过程需要耗费数小时甚至数十小时,而且碳点的合成产率也仍比较低,不利于宏量制备,使碳点的应用受到一定限制。所以,急需寻求其他廉价生物碳源以及简单可行且短耗时的方法合成高产率碳点,从而有效地实现碳点的宏量制备。
酵母是一种微小的单细胞微生物,富含蛋白质、氨基酸以及维生素等多种成分[20],被广泛用于食品工业和畜牧业。易于获取、绿色无毒且含碳物质丰富的优点使酵母可作为比较理想的碳前驱体来制备碳点。在自下而上法中,微波法相比于水/溶剂热法和热解法,不仅操作容易、可一步合成、设备要求低,而且反应迅速,能在短时间内破坏碳源,促使其转变为碳点,有望于实现成本低且耗时短的高产率宏量制备。本文选用活性干酵母为生物碳源、磷酸为氧化剂,通过一步微波法快速地合成了产率高、性能好的绿色荧光碳点,对其宏量制备的可行性进行了考察,并对所得碳点进行了表征和细胞毒性评价,最后成功用于细胞成像。
1 实验部分
1.1 主要试剂与仪器
主要试剂:磷酸(质量分数约40%)、不同pH磷酸盐缓冲液(PBS)、氢氧化钠、氯化钠、硫酸奎宁、活性干酵母。所用试剂均为分析纯,实验用水为超纯水。
主要仪器:U-2910紫外-可见分光光度计(日本日立公司),F-4500荧光光谱仪(日本日立公司),Perkin Elmer 1000红外光谱仪(美国珀金埃尔默公司),Tecnai G2F20 S-Twin场发射透射电子显微镜(美国FEI公司),透析袋(美国联合碳化公司),Millipore Simplicity超纯水系统(上海默克化工公司),冷冻干燥机(宁波新芝生物科技公司),FE20酸度计(上海梅特勒-托利多仪器公司)以及M1-L213B微波炉(中国美的集团)。
1.2 碳点的制备
在50 mL玻璃烧杯中分别加入0.5 g活性干酵母颗粒和2 mL磷酸溶液,充分搅拌,将所得酵母酸溶液放置于微波炉中,低火档(119 W)加热8 min,待自然冷却至室温,得到棕黑色液体。加碱中和后,依次用定性滤纸(10~15 μm)和微滤膜(0.22 μm)进行过滤以去除大分子颗粒,然后再转入透析袋(分子截留量500 Da)内于超纯水中连续透析48 h以去除盐类及其他小分子物质,取袋内溶液,即得纯化的碳点溶液。将该溶液进行冷冻干燥,得到0.254 g的棕黄色碳点粉末。重复本实验4次,并按活性干酵母投料量依次为0.5、1、2、5、10 g进行扩大合成(磷酸溶液加入量随其比例增加)。
1.3 碳点的表征
将一滴碳点溶液滴在铜网上,待自然晾干后,置于透射电镜下,观测其形貌和尺寸。将碳点粉末与溴化钾粉末以一定比例均匀混合后,压制成透明薄片,于红外光谱仪中分析其特征官能团。将盛有碳点溶液的比色皿(光路长10 mm)分别置于紫外-可见分光光度计、荧光分光光度计中测定其光学性质。将相同质量的碳点粉末溶于一系列不同pH磷酸盐缓冲液和不同浓度NaCl溶液中,分别测定其荧光强度。配制两份碳点溶液,一份于365 nm紫外灯下连续照射6 h,另一份于可见光下放置10 d,每隔一定时间测定二者的荧光强度。
1.4 碳点的荧光量子产率
荧光量子产率的测定以硫酸奎宁作为参比(量子产率为54%),参考文献所报道的方法[16],记录测定结果并根据如下公式计算得到。
式中φ表示荧光量子产率,K表示发射光谱的面积积分对吸光度值作图所得曲线的斜率,η表示溶剂的折射率,x和st分别表示样品和标准溶液。
1.5 细胞毒性及成像实验
实验采用MTT法检测碳点对细胞的毒性。取HepG2细胞悬液于96孔板中,每孔100 μL。放置于培养箱中,在37℃、体积分数5% CO2条件下培养24 h后,弃去上层液,给药孔中加入含不同浓度CDs(0、10、20、50、100、250和500 mg·mL-1)的新鲜培养基。再孵育24 h后,用含MTT新鲜培养基(5 mg·mL-1)替换所有药孔中培养基,继续培养2 h。最后,吸掉上层液,加入DMSO轻摇几分钟后,用酶标仪在500 nm处测量吸光度,记录并处理实验结果。
为了观察碳点在细胞中的成像效果,将适量HepG2细胞悬液加入到共聚焦培养皿中,放置于培养箱,在37℃、体积分数5% CO2条件下进行贴壁培养。然后,弃上层液,用PBS缓冲液润洗1次,加入含CDs(500 mg·mL-1)的新鲜培养基,再继续培养6 h。最后,取出培养皿,移除培养液,用PBS润洗细胞3次,镜油封片,进行成像。
2 结果与讨论
2.1 微波加热时间对碳点合成的影响
采用微波法碳化酵母碳源合成荧光碳点。由于碳源的碳化程度影响碳点产率,而加热时间对碳化程度有一定影响,为获得高产率的碳点,考察了微波加热时间对碳源碳化程度的影响。如图1A所示,随微波加热时间逐渐增加,酵母酸溶液的颜色从乳白色到黄色,到棕黄色,直至变为棕黑色。这表明加热时间增加,碳源碳化程度随之加深,有利于碳点的合成[21]。图1B所示分别为本实验所用的活性干酵母颗粒以及所制备的碳点溶液和粉末。

Fig.1 Effect of microwave heating time to carbonization degree of carbon source (A);ADY granules and the as-prepared CDs solution and powder (B)图1 微波加热时间对碳源碳化程度影响(A);所用干酵母颗粒及所得碳点溶液和粉末(B)
2.2 宏量制备的可行性考察
平行实验和扩大合成用以考察碳点宏量制备的可行性。如表1所示,所制得碳点的最佳发射波长保持在522 nm左右,量子产率保持在13%左右,合成产率保持在50%左右,均无明显浮动。此外,平行试验和扩大合成所得碳点的平均产率分别为50.59%和50.76%,对应标准偏差值很小,分别为0.98%和1.29%。以上研究结果说明,放大制备对所得碳点的光学性质没有产生明显影响,碳点的合成产率不仅高,并且有很好的重复性与重现性,可有效实现宏量制备。
2.3 碳点的形貌与结构表征及分析
如图2所示,透射电镜图与粒径分布图表明,碳点为单分散的类球形颗粒,无团聚现象,粒径分布较窄(2~6 nm),平均粒径约为3.4 nm。从粒径大小和均匀度来讲,通过微波法获得的碳点是较为理想的。

表1 制备碳点的平行实验和其扩大合成
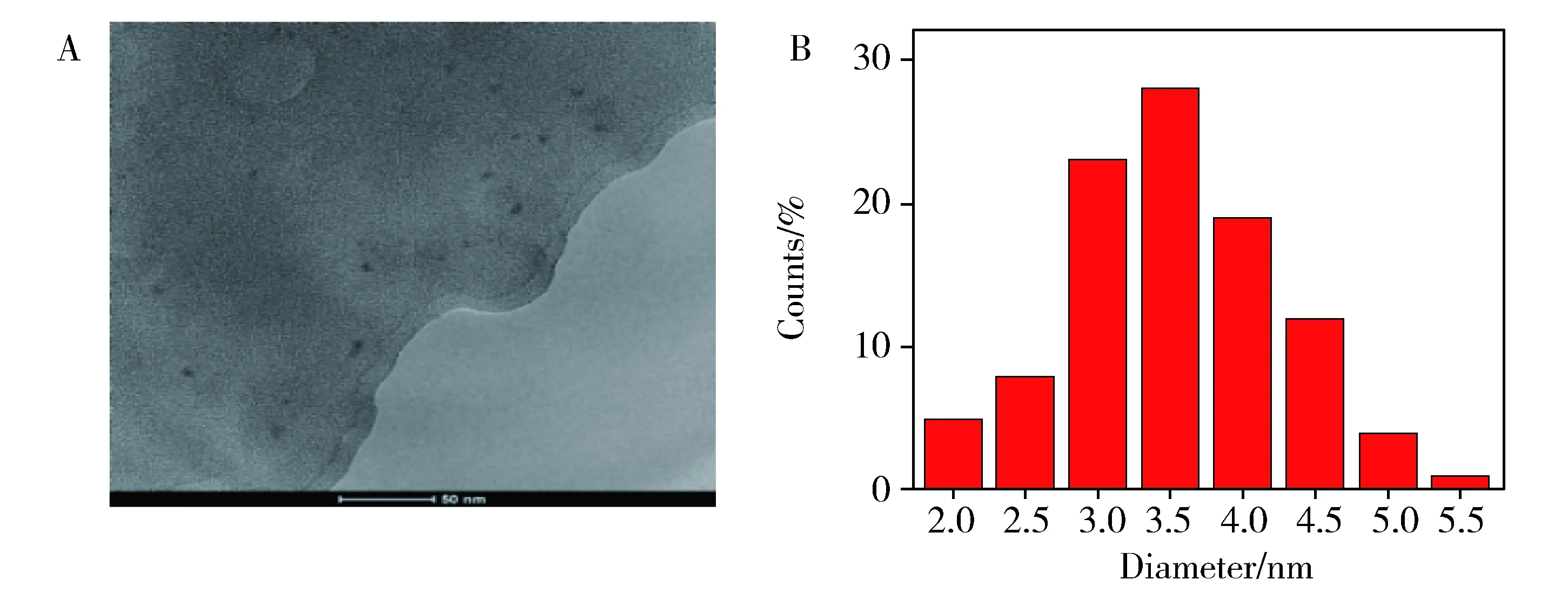
Fig.2 TEM image (A) and size distribution diagram (B) of CDs.图2 碳点的透射电镜图(A)与粒径分布图(B)
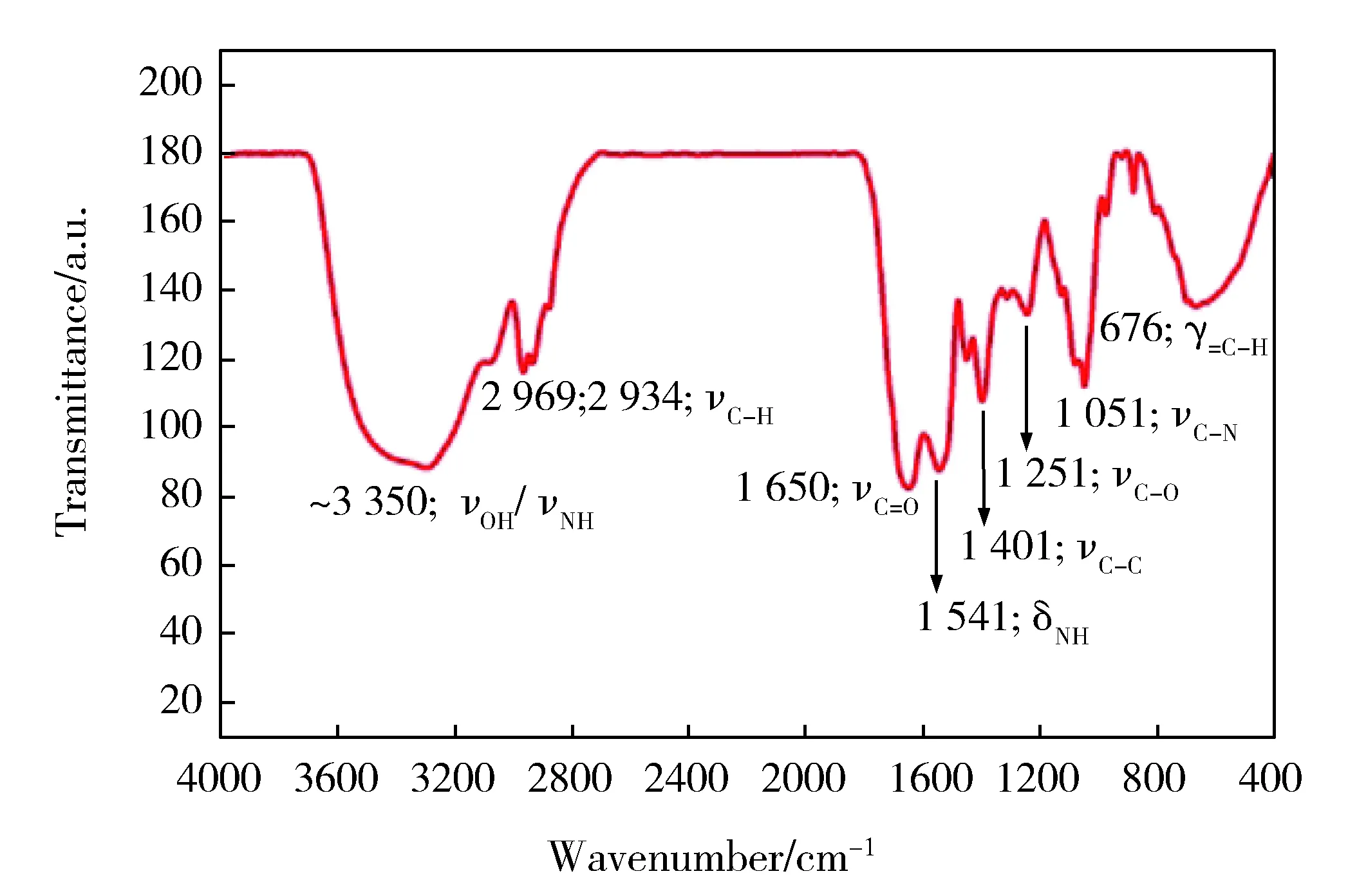
Fig.3 FTIR spectrum of CDs图3 碳点的红外吸收光谱图
图3为碳点的红外吸收光谱。其中,以3 350 cm-1为中心的吸收峰属于O-H和N-H的伸缩振动[22],在1 650、1 401、1 251和1 051 cm-1的吸收峰分别为C=O、C=C、C-O、和C-N的伸缩振动[15,23],而在1 541 cm-1处的吸收峰则与N-H的面内弯曲振动有关[22]。以上分析表明,碳点表面存在-OH、-COOH和-NH2,这说明以活性干酵母为碳源可为制备的碳点提供丰富的表面官能团。这些表面官能团可有效加强碳点的亲水性,这一点与实验过程中发现其具有很好的亲水性相印证。
2.4 碳点的光学性质表征及分析
对碳点进行紫外-可见吸收光谱、激发光谱及发射光谱表征。如图4A所示,碳点水溶液在281 nm处有强吸收峰,这是由C=C的π-π*跃迁产生的吸收所致[24];此外,其最大激发波长和发射波长分别位于400 nm和522 nm。如图4a和b所示,碳点溶液在日光下为淡黄色透明溶液,在365 nm紫外灯下则发出明亮的绿色荧光。
为了进一步探究其发光特性,不同激发波长下的发射光谱被测定。从图4B可看出,当激发波长从300 nm增长到460 nm时,碳点的荧光先增强后减弱,其发射峰发生了红移,这表明碳点的荧光光谱具有激发依赖趋向,这种激发依赖的发射性质可能与碳点的表面状态或粒径分布有关[25]。从荧光光谱的归一化图(图4c)可明显看出,随激发波长的增加,发射峰红移的程度较小,由此可推断碳点的粒径分布较均匀,这与先前所得结论一致。

(A);Emission spectra of CDs with different excitation wavelengths from 300 to 460 nm (1→9) with a 20 nm increment (B).Inset:photographs of CDs solution under sun light (a) and 365 nm UV light (b); and normalized emission spectra of CDs (c)Fig.4 UV-Vis absorption,maximum excitation and emission spectra of CDs(A);碳点在不同激发波长下的发射光谱(1→9:300→460nm,以20 nm为增幅)(B); 内嵌图:碳点在可见光(a)和365 nm紫外灯(b)下照片及对应荧光光谱的归一化图(c)图4 碳点的紫外-可见吸收光谱、激发光谱和发射光谱图
2.5 碳点的光稳定性考察
以酸碱度、盐离子浓度、紫外照射时间和存放时间为影响因素,考察碳点的光稳定性。如图5A所示,碳点在pH为7.4时表现出最大荧光强度;在pH 3~11范围内,其荧光强度随pH的增加无明显变化;而在pH=1或13的极酸极碱条件下发生了明显的降低。如图5B所示,碳点在0.25 mol·L-1NaCl溶液中荧光最强,而从整体趋势看,NaCl溶液浓度对荧光的强度影响不大。如图5C和D所示,碳点的荧光强度随着紫外照射时间和存放时间的加长而降低的程度均比较弱。以上结果表明,碳点的光稳定性强、耐光漂白性好,可经受长时间的激发照射和储存。
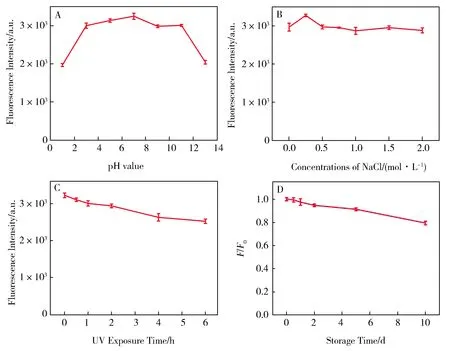
Fig.5 Influences of pH (A),ionic strength (B),UV exposure (C) andstorage time (D) on fluorescence intensity of CDs.图5 (A)pH(B)盐离子浓度(C)紫外辐射时间和(D)存放时间对碳点荧光强度影响
2.6 碳点的生物相容性及其细胞成像研究

Fig.6 HepG2 cellular viability incubated with CDs at different concentrations for 24 h.图6 HepG2细胞与不同浓度CDs孵育24 h后的存活率
碳点的MTT实验结果如图6所示,HepG2细胞生存率随其浓度增大呈微弱下降趋势,当浓度高达500 mg·mL-1时,其存活率仍达90%,说明碳点对细胞的毒性很小,这表明活性干酵母作为碳源合成的荧光碳点具有很好的生物相容性。
图7为碳点标记HepG2细胞的荧光成像图。从图中可以看出,碳点标记的细胞状态良好,未观察到形态上的损伤,这进一步表明碳点良好的生物相容性。碳点进入细胞后,主要分布于细胞膜和细胞质中,很少见于细胞核中,这与之前报道的结果是相符的[26]。细胞在488 nm激发波长下发出明亮的绿色荧光,成像后的细胞轮廓清楚,且荧光强度稳定,说明碳点对细胞有很好的光学成像效果。

Fig.7 Fluorescence images of HepG2 cells incubated with CDs (500 mg·mL-1 ) at 37℃ for 6 h. Dark filed (A),bright filed (B) and merge (C) images.A、B、C分别表示暗场、暗场和合场图像图7 HepG2细胞与碳点溶液(500 mg·mL-1)在37℃下孵育6 h后的荧光成像图
3 结论
以微波法碳化酵母酸溶液得到绿色荧光的碳点,不但具有碳源廉价易得、操作简单、耗时短、产率高、可宏量制备的优势,而且良好的可分散性、亲水性、光稳定性以及生物相容性使得碳点表现出很好的细胞成像效果,因此,有望作为荧光探针在生物成像领域得到应用。

