氯盐和硫酸盐对钢筋在模拟混凝土孔隙液中腐蚀行为的影响
,,,,
(1. 武汉工程大学 化学与环境工程学院,武汉 430073; 2. 绿色化工过程教育部重点实验室,武汉 430073;3. 武汉工程大学 交通研究中心,武汉 430073)
钢筋混凝土在建筑和工程领域应用广泛,对我国国民经济建设发挥着重要作用。混凝土孔隙液的高碱性(pH>12.6)使得钢筋表面处于钝化状态,形成具有保护性的钝化膜。此钝化膜常具有热力学稳定性,因而使得钢筋免受进一步的腐蚀破坏[1-6]。混凝土中钢筋腐蚀的本质就是钝化膜破坏,而混凝土常处于含侵蚀性介质的环境中,如Cl-、SO42-和CO2等,其中Cl-对钝化膜破坏的影响最为严重[7-8]。另外,在混凝土搅拌过程中也会引入Cl-,当Cl-达到一定量时就会引起钢筋锈蚀,此时Cl-的含量被称为临界值。临界值常随环境条件而改变,不同环境条件的影响也不尽相同,其中混凝土孔隙液的pH对临界值的影响最大。一般而言,钢筋受腐蚀的风险随着cCl-∶cOH-的升高而增加。SO42-对于钝化膜的破坏也是不可忽略的,当孔隙液中SO42-含量足够高时,同样会导致钝化膜的破裂;此外,SO42-会与水泥中的铝酸三钙反应,降低混凝土的强度,缩短其服役寿命[9]。目前针对Cl-导致混凝土中钢筋锈蚀已有许多研究,但针对SO42-对混凝土中钢筋锈蚀影响的报道还比较少,有待进一步深入研究。
基于此,本工作采用电化学技术以及微观分析方法,研究了不同阳离子氯盐(NaCl和NH4Cl)和硫酸盐[Na2SO4和(NH4)2SO4]对模拟混凝土孔隙液中钢筋腐蚀行为的影响,并考察了温度的影响。
1 试验
1.1 试样与介质
试验材料为Q345B(16Mn)碳钢,其化学组成为wC0.26%,wMn1.26%,wP0.009%,wSi0.063%,wS0.031%,余量为Fe。试样尺寸为φ4 cm×1 cm,试验前用环氧树脂密封四周,只留下0.5 cm2表面作为工作区。每次电化学测试开始之前,工作电极表面用SiC砂纸(800号~1 500号)逐级打磨,丙酮除油,蒸馏水冲洗,冷风吹干,备用。
以采用去离子水配制的饱和Ca(OH)2溶液作为基础溶液,加入不同量的NaCl和NH4Cl以探究Cl-对混凝土中钢筋锈蚀的影响;加入不同量Na2SO4和(NH4)2SO4以探究SO42-对混凝土中钢筋锈蚀的影响。所有药品均为分析纯试剂,试验溶液未经除氧处理。
1.2 试验方法
电化学试验采用三电极体系。饱和甘汞电极(SCE)为参比电极,铂电极为辅助电极,试样为工作电极。试验前把试样放入新鲜制备的饱和Ca(OH)2溶液中钝化72 h,以形成致密保护膜[6]。然后把试样放入待测体系中,开路电位稳定一段时间后,进行电化学测试,所有测试均在恒温水浴锅中进行。点蚀击穿曲线的电位区间为相对开路电位-15 mV~1.0 V,采用动电位慢扫描方式进行极化曲线测试,速率为10 mV/min。当检测到击穿电流超过阀值0.1 mA时,立即停止极化以保护电极。电化学阻抗测试(EIS)的测试频率为10-2~105Hz,设置扰动电压振幅为5 mV。为了保证试验数据的准确性,所有测试均重复3次以上。
浸泡试验在含不同盐的饱和Ca(OH)2溶液中进行,浸泡时间为24 h,浸泡结束后,采用光学显微镜观察腐蚀形貌。
2 结果与讨论
2.1 电化学试验结果
2.1.1 氯盐和硫酸盐对腐蚀行为的影响
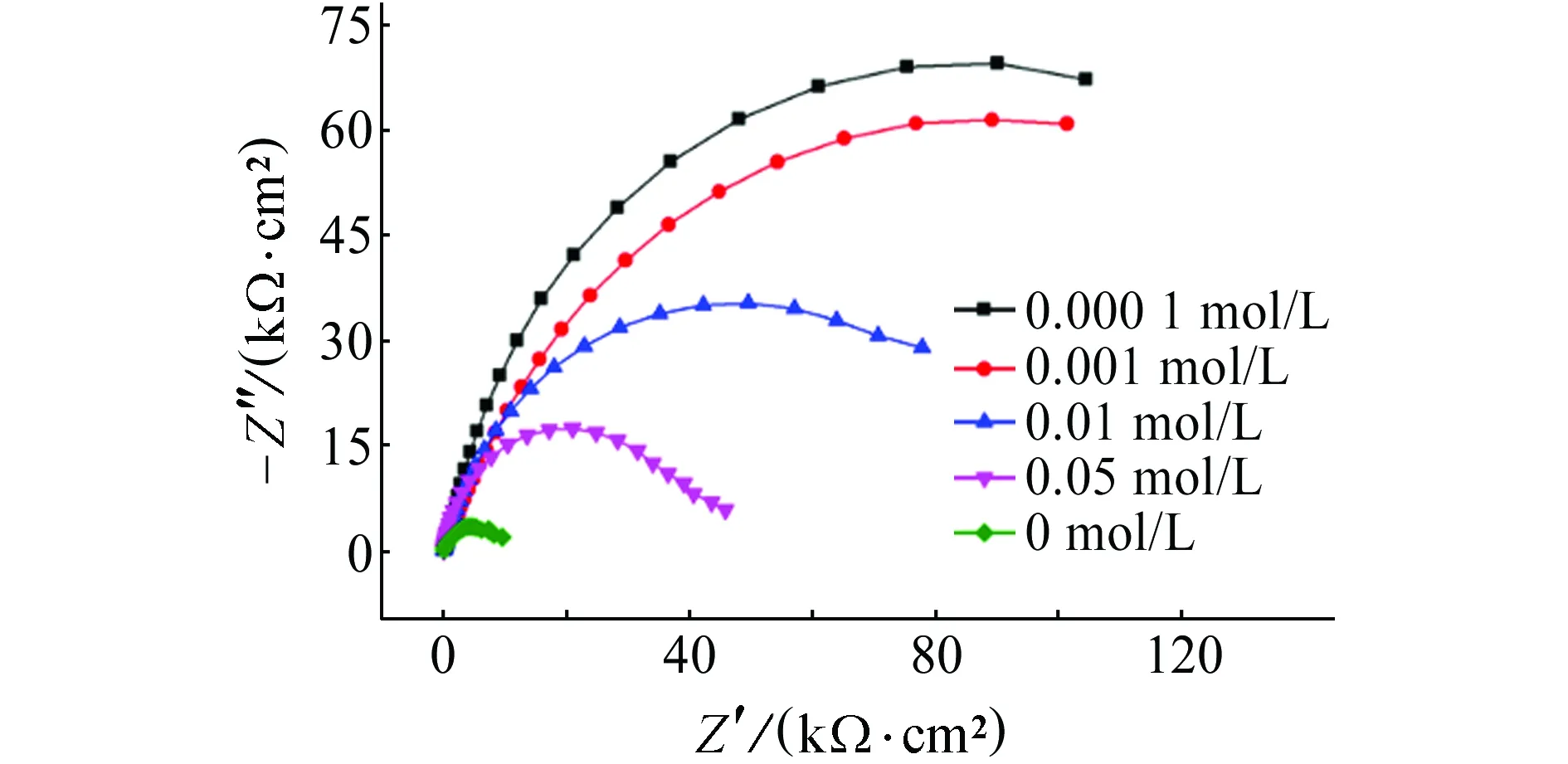
由图1可见: NaCl浓度为0.000 1~0.01 mol/L时,Cl-侵蚀性弱,此时电极表面形成的钝化膜较稳定、未发生破裂。且此时试样的阻抗弧半径较大,表明此时试样的腐蚀速率较小。试样的阻抗随着溶液中NaCl浓度的增加而减小,这表明增加Cl-浓度会加剧试样的的腐蚀。当Cl-浓度大于0.05 mol/L后,Cl-较易破坏电极表面钝化膜,故点蚀曲线上出现了明显的击穿电位,且随Cl-含量的增加而负移。由表1可见:Cl-浓度为0.1 mol/L时,试样的击穿电位最低,说明Cl-浓度越高,对钢筋的破坏程度越大。阻抗图谱上也显示了相同规律,随着Cl-浓度增加至0.05 mol/L后,阻抗弧半径显著变小,含高浓度Cl-的溶液具有较强的侵蚀作用。一般而言,开路电位越正,表明钝化膜在热力学上越稳定。表1显示试样的开路电位随着Cl-浓度的增加而负移,当Cl-浓度高于0.05 mol/L时,开路电位负移程度较大,这说明Cl-浓度大于0.05 mol/L后,钢筋表面形成的钝化膜不稳定,易引发点蚀,致使钝化膜破裂。
(a) 点蚀击穿曲线

(b) 电化学阻抗谱图1 试样在含不同浓度NaCl的饱和Ca(OH)2溶液中的电化学试验结果Fig. 1 Electrochemical test results of samples in saturated Ca(OH)2 solution containing different content of NaCl: (a) pitting breakdown curves; (b) electrochemical impedance spectra
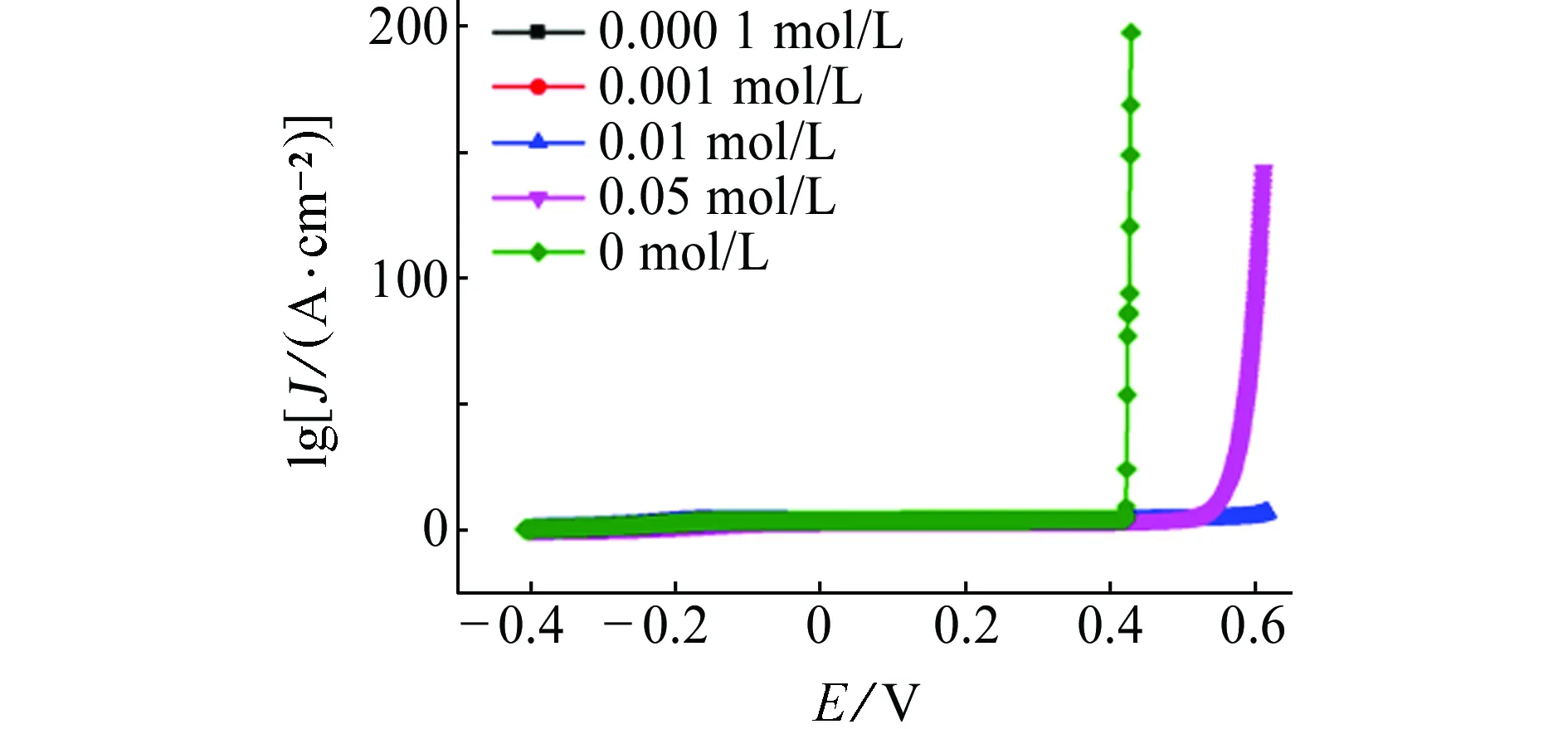
由图2可见:在含不同量Na2SO4的试验溶液中,点蚀击穿曲线均未出现钝化膜破裂电位,这可能是因为Na2SO4对钢筋的破坏能力较小,对钝化膜的破坏需要更长的诱导期。由表2可见:随着Na2SO4浓度的增加,试样的开路电位负移,即溶液中Na2SO4浓度的增大会增加碳钢的腐蚀速率。此外,试样的阻抗值随着Na2SO4浓度的增加而持续变小,即Na2SO4能加剧碳钢的腐蚀。在同一浓度条件下,试样在含Na2SO4溶液中的开路电位正于在含Cl-溶液中的,且阻抗值更大,这表明Na2SO4不易诱发点蚀,对碳钢的破坏能力小于Cl-的。

表1 试样在含不同浓度NaCl的饱和Ca(OH)2溶液中的相关电化学参数拟合结果Tab. 1 Correlation results of related electrochemical parameters of samples in saturated Ca(OH)2 solution containing different content of NaCl
(a) 点蚀击穿曲线

(b) 电化学阻抗谱图2 试样在含不同浓度Na2SO4的饱和Ca(OH)2溶液中的电化学试验结果Fig. 2Electrochemical test results of samples in saturated Ca(OH)2 solution containing different content of Na2SO4: (a) pitting breakdown curves; (b) electrochemical impedance spcctra
由图3和表3可见:当NH4Cl浓度为0.01 mol/L时,曲线上就出现了破裂电位,且破裂电位值远负于试样在含NaCl溶液中的。继续增加NH4Cl浓度,破裂电位急剧降低,说明NH4+的存在,能破坏碳钢表面钝化膜,大大增加碳钢的腐蚀速率。电化学阻抗谱和开路电位测量结果也证实了这点:当NH4+浓度为0.01mol/L时,阻抗值和开路电位猛然骤降,且随着NH4+浓度增加,钝化膜破坏越为严重,其对碳钢的腐蚀作用远大于NaCl的。
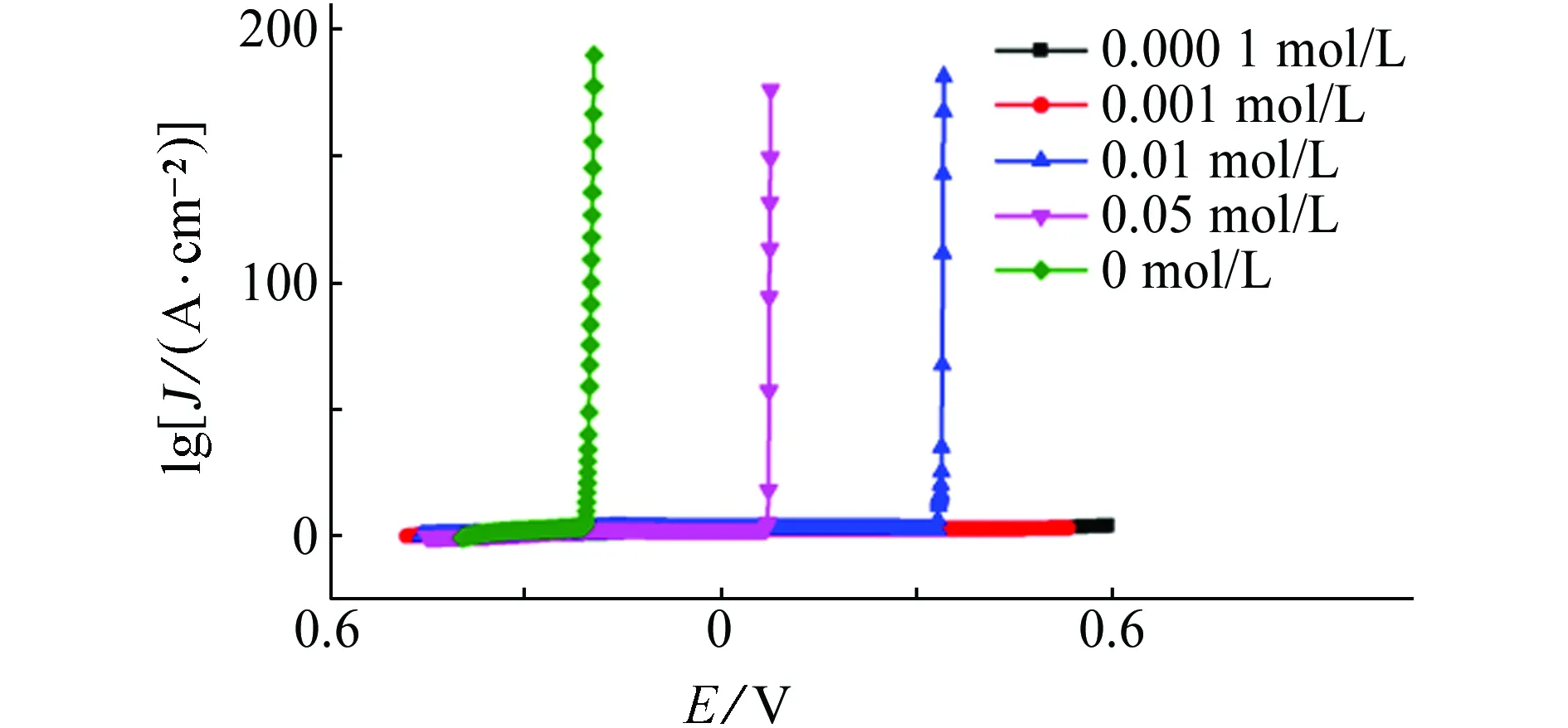
(a) 点蚀击穿曲线
(b) 电化学阻抗谱图3 试样在含不同浓度NH4Cl的饱和Ca(OH)2溶液中的电化学试验结果Fig. 3Electrochemical test results of samples in saturated Ca(OH)2 solution containing different content of NH4Cl: (a) pitting breakdown curves; (b) electrochemical impedance spectra
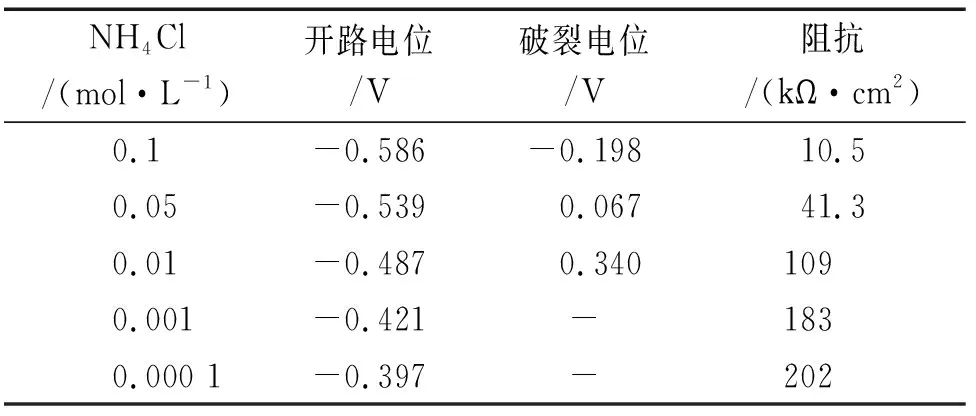
NH4Cl/(mol·L-1)开路电位/V破裂电位/V阻抗/(kΩ·cm2)0.1-0.586-0.19810.50.05-0.5390.06741.30.01-0.4870.3401090.001-0.421-1830.000 1-0.397-202
由图4和表4可见:在含(NH4)2SO4的试验溶液中,试样的开路电位、破裂电位均随着(NH4)2SO4浓度的增加而负移,同时阻抗值降低,且阻抗值和开路电位都远低于在含NH4Cl溶液中的。当溶液中(NH4)2SO4浓度为0.01 mol/L时, 阻抗弧出现骤降,这与试样在含NH4Cl溶液中的规律一致;但在相同浓度条件下,试样在含(NH4)2SO4溶液中的击穿电位远小于在含NH4Cl溶液中的,说明(NH4)2SO4对碳钢的破坏能力远大于NH4Cl的。与Na2SO4对比可得,NH4+的引入显著增加了金属的腐蚀速率,加剧腐蚀。

(a) 点蚀击穿曲线
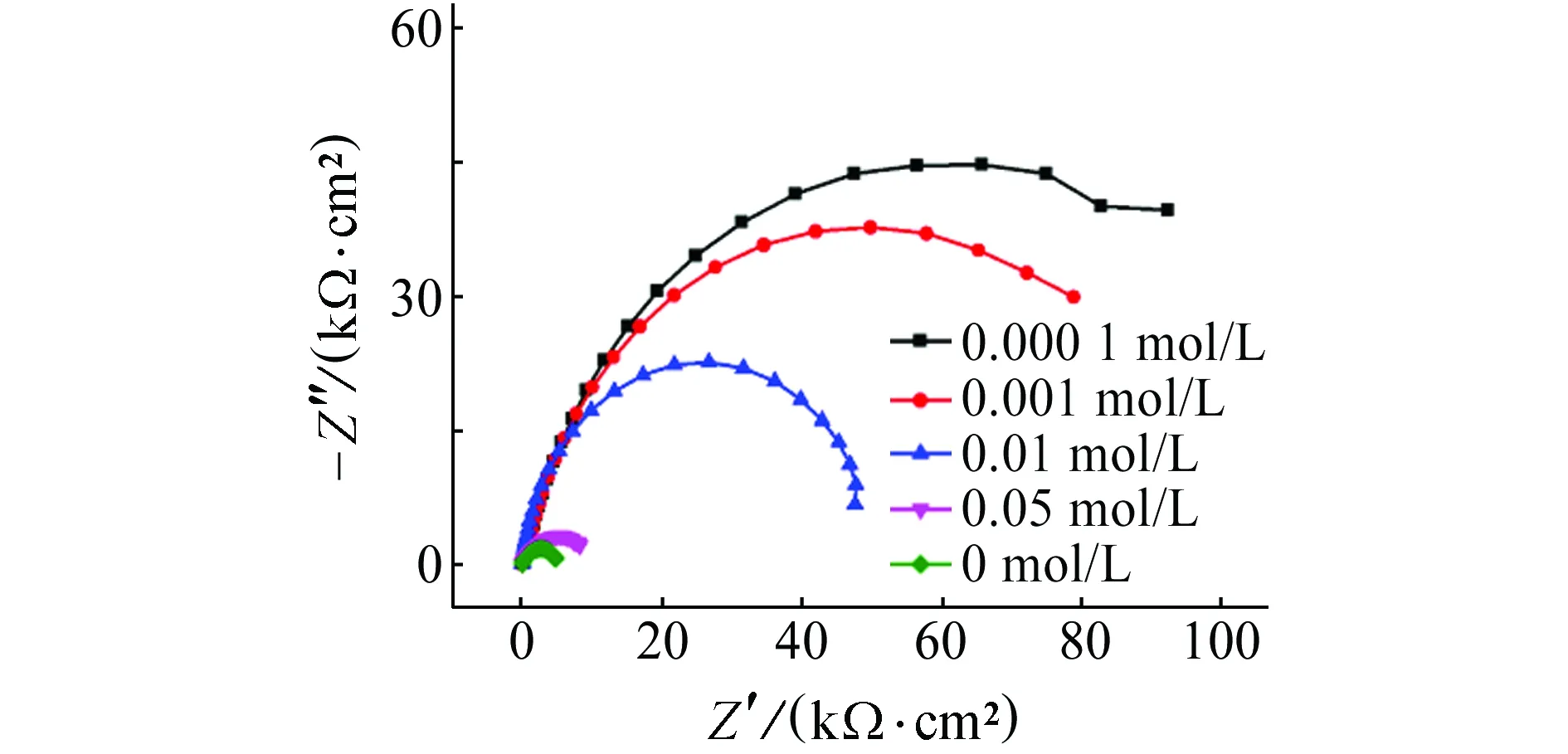
(b) 电化学阻抗谱图4 试样在含不同浓度(NH4)2SO4的饱和Ca(OH)2溶液中的电化学试验结果Fig. 4Electrochemical test results of samples in saturated Ca(OH)2 solution containing different content of (NH4)2SO4: (a) pitting breakdown curves; (b) electrochemical impedance spectra
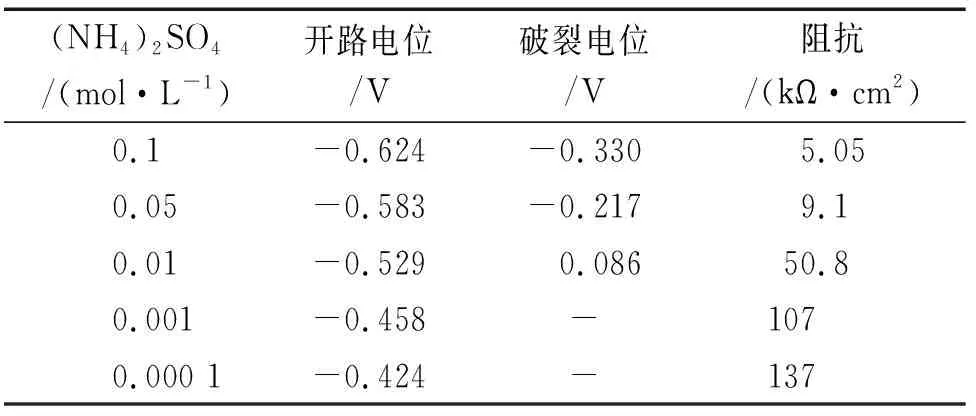
(NH4)2SO4/(mol·L-1)开路电位/V破裂电位/V阻抗/(kΩ·cm2)0.1-0.624-0.3305.050.05-0.583-0.2179.10.01-0.5290.08650.80.001-0.458-1070.000 1-0.424-137
总而言之,Na2SO4对混凝土中钢筋的腐蚀影响较小,Cl-更易引起钢筋表面的点蚀发生;当环境中引入NH4+后,能够大大加快金属的腐蚀,(NH4)2SO4容易溶解并破坏钝化膜,会对钢筋造成更为严重的腐蚀。几种盐对钢筋的腐蚀影响由强到弱依次为:(NH4)2SO4>NH4Cl>NaCl>Na2SO4。
2.1.2 环境温度对腐蚀的影响
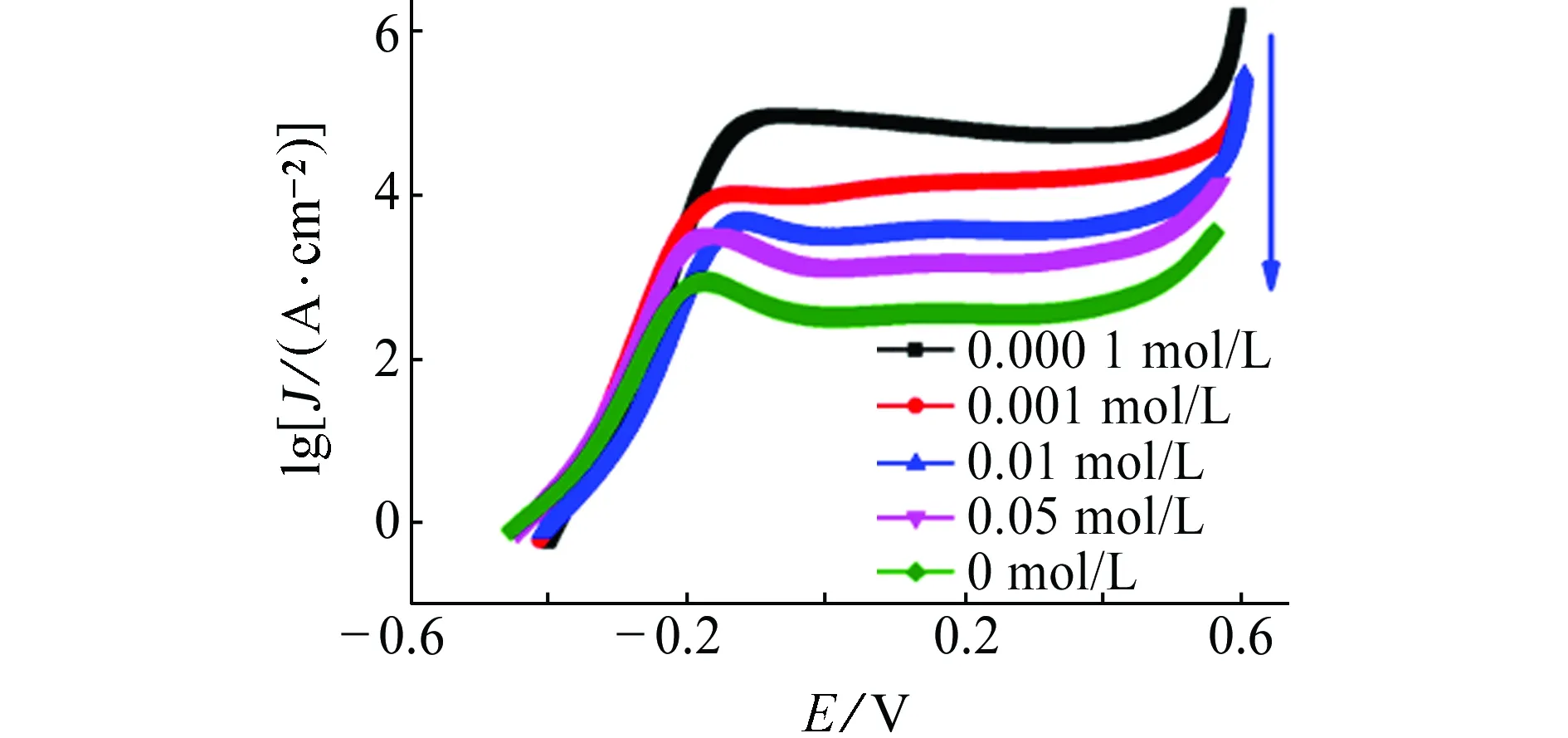
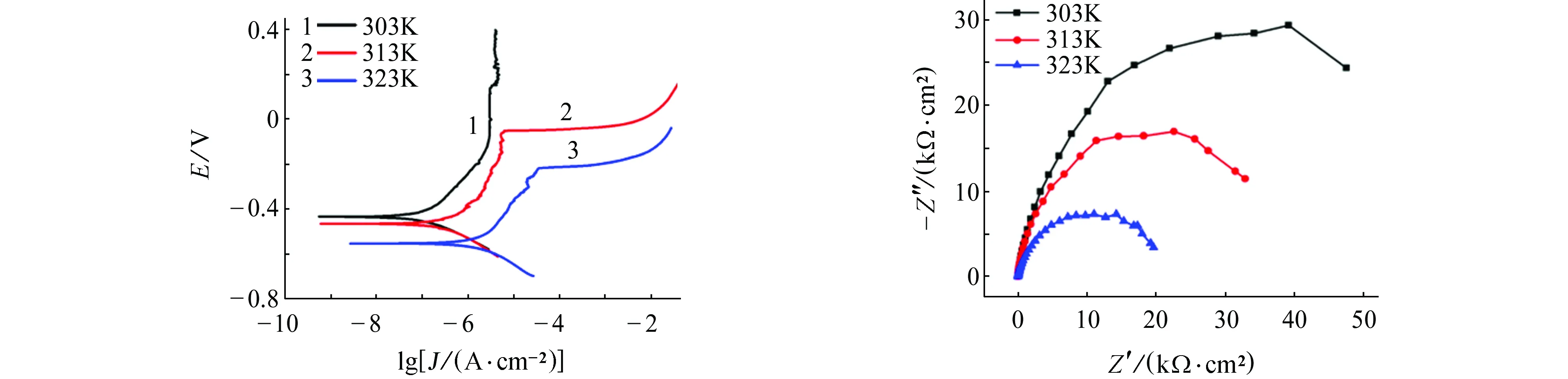
由图5~8可见:在含有NaCl的模拟孔隙液体系中,试样的腐蚀电流密度均随温度的升高而增加,即升高温度更易破坏钝化膜,从而加剧碳钢的腐蚀。阻抗图谱中阻抗弧半径随温度升高而收缩也验证了这一结论。当腐蚀介质变为Na2SO4、NH4Cl和(NH4)2SO4时,不难发现,极化曲线和阻抗图谱都保持同样的规律,即腐蚀电流密度随温度的升高而增加,阻抗弧半径均随温度的升高而减小。在任何一种侵蚀性离子环境中,升高温度均加速钝化膜的破坏,加剧腐蚀。另外对比这四种离子在同一温度下的腐蚀电流密度和电化学阻抗,可发现这四种离子对碳钢的破坏作用由大到小依次为:(NH4)2SO4>NH4Cl>NaCl>Na2SO4,与常温下的结果一致。
活化能是评价腐蚀快慢的一个重要指标,因此采用Arrhenius方程来计算碳钢在不同离子环境中的腐蚀活化能,见式(1):
(1)
式中:J代表腐蚀电流密度(μA·cm-2),T为绝对温度,R为气体常数(8.314 5 J·mol-1·K-1),A为Arrhenius常数。活化能计算结果同样列于表5,从表5中可知,试样在NaCl环境中的腐蚀活化能远小于在Na2SO4环境中的,即Cl-比SO42-更易引起碳钢的点蚀,在NH4Cl环境中的活化能也远小于前两者的,且(NH4)2SO4条件下的活化能最低,证明NH4-的引入大大降低了碳钢腐蚀所需的能量,加剧了金属的腐蚀,致使基体发生强烈腐蚀。对比活化能的大小,(NH4)2SO4对碳钢腐蚀影响最大,NH4Cl的次之,NaCl的更次之,Na2SO4的最小,这与极化曲线和电化学阻抗测试的结果一致。
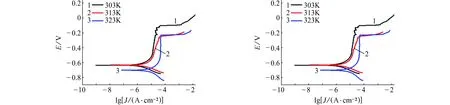
(a) 动电位扫描(b) 电化学阻抗图5 不同温度下,试样在含0.1 mol/L NaCl的饱和Ca(OH)2溶液中的电化学试验结果Fig. 5 Electrochemical test results of samples in saturated Ca(OH)2 solution containing 0.1 mol/L NaCl at different temperatures: (a) potentiodynamic scanning curves; (b) electrochemical impedance spectra
(a) 动电位扫描(b) 电化学阻抗图6 不同温度下,试样在含0.1 mol/L Na2SO4的饱和Ca(OH)2溶液中的电化学试验结果Fig. 6Electrochemical test results of samples in saturated Ca(OH)2 solution containing 0.1 mol/L Na2SO4 at different temperatures: (a) potentiodynamic scanning curves; (b) electrochemical impedance spectra
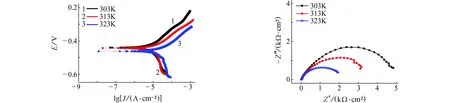
(a) 动电位扫描(b) 电化学阻抗图7 不同温度下,试样在含0.1 mol/L NH4Cl的饱和Ca(OH)2溶液中的电化学试验结果Fig. 7Electrochemical test results of samples in saturated Ca(OH)2 solution containing 0.1 mol/L NH4Cl at different temperatures: (a) potentiodynamic scanning curves; (b) electrochemical impedance spectra
2.2 腐蚀形貌
由图9可见:在含Na2SO4的试验溶液中腐蚀后,试样表面十分平整,无明显点蚀坑出现,表明此时腐蚀较轻。肉眼观察电极表面还有一层不连续的白色覆盖物,这可能是由表面形成的不溶物CaSO4所致。而在含NaCl的试验溶液中腐蚀后,试样表面存在许多点蚀坑,表明Cl-容易引起碳钢基体的点蚀。在含NH4Cl的试验溶液中腐蚀后,试样表面出现连续且致密的点蚀坑,数量非常多,说明NH4+的引入加速了钢筋的腐蚀,造成更严重的点蚀。碳钢在含(NH4)2SO4的试验溶液中腐蚀后,试样表面形成尺寸较大、坑洞较深的腐蚀坑,甚至出现了许多铁锈,表明(NH4)2SO4对碳钢的腐蚀影响最大。

(a) 动电位扫描(b) 电化学阻抗图8 不同温度下,试样在含0.05 mol/L (NH4)2SO4的饱和Ca(OH)2溶液中的电化学试验结果Fig. 8Electrochemical test results of samples in saturated Ca(OH)2 solution containing 0.5 mol/L (NH4)2SO4 at different temperatures: (a) potentiodynamic scanning curves; (b) electrochemical impedance spectra

介质腐蚀电流密度/(μA·cm-2)303K313K323KΔEa/(kJ·mol-1)R20.1 mol/L NaCl2.134.458.8157.730.9990.1 mol/L Na2SO40.1250.3621.81109.90.9680.1 mol/L NH4Cl9.3715.228.745.450.9810.05 mol/L (NH4)2SO418.327.139.331.460.999
3 结论
不同阳离子氯盐和硫酸盐对碳钢腐蚀行为有着不同的影响。相比于Na2SO4,NaCl容易引起碳钢表面点蚀的发生。环境中引入NH4+能够大大加速钢筋钝化膜的破坏,造成更严重的腐蚀。这些侵蚀性离子对碳钢表面的破坏能力由大到小依次为:(NH4)2SO4>NH4Cl>NaCl>Na2SO4,它们对碳钢腐蚀速率的影响均随着温度的升高而增加。

(a) Na2SO4(b) NaCl(c) NH4Cl(d) (NH4)2SO4图9 试样在含0.1 mol/L盐的饱和Ca(OH)2溶液中腐蚀24 h后的表面形貌Fig. 9 Surface morphology of samples after corrosion for 24 h in saturated Ca(OH)2 solution containing 0.1 mol/L salt

