经腹腔镜肾动脉分支阻断肾部分切除术治疗早期肾肿瘤的临床应用
张平新, 李前进, 马 涛, 拜合提亚·阿扎提, 王玉杰, 王文光
(新疆医科大学第一附属医院泌尿外科, 乌鲁木齐 830054)
肾癌是泌尿系统的常见肿瘤之一,发病率每年以2%的速度递增[1]。随着医疗水平的不断发展,小肾癌的检出率明显增加。肾部分切除术已被推荐为治疗T1期肾肿瘤的金标准[2],经腹腔镜肾动脉分支阻断肾部分切除术是结合微创和精准于一体的新技术,对早期肾肿瘤的治疗疗效更佳,安全可靠。新疆医科大学第一附属医院2016年12月-2018年1月对15例T1期肾肿瘤患者行经腹腔镜肾动脉分支阻断肾部分切除术,取得了较好的临床疗效,现报道如下。
1 资料与方法
1.1临床资料本组15例患者,男性12例,女性3例,平均年龄(55.2±8.3)岁,肿瘤直径(3.5±0.8) cm。左肾肿瘤9例,4例位于中部腹侧,5例位于下极;右肾肿瘤6例,3例位于背侧上级,3例位于中部腹侧。术前患者均无明显症状,无腰痛、肉眼血尿及腰部肿块,均为体检超声或CT发现。术前常规行肾脏CTA,评估肾脏肿瘤大小、位置、深度以及肾动脉分支情况。行肾动脉CT血管造影(CTA)三维成像检查明确肾动脉分支,有助于术中寻找肾动脉分支(图1、2)。术前血常规及生化均正常。15例患者术中均采用肾动脉分支阻断肾部分切除术。术前及术后1个月分别行核素扫描(ECT)检测肾小球滤过率(GFR),评价患者的分肾功能变化情况。10例采取经腹腹腔镜入路,5例采用后腹腔入路。
1.2手术方法经腹入路,患者取健侧70°左右卧位,腰部垫高。取脐上2 cm腹直肌外侧缘做1 cm切口,穿刺成功后,置镜观察。根据肾脏及肿瘤的位置,灵活布局其余3个套管。沿Toldt′S线打开结肠旁沟,充分游离结肠,自内侧牵引,暴露术野,打开肾周筋膜充分游离肾脏,尤其是肿瘤区域的肾脏,分离肾门结构,结合术前CTA影像,找到目标分支动脉,血管吊带吊起备用。分支动脉阻断后(图3),可见目标区域缺血的表现,如果没有出现缺血说明阻断动脉有误,需要重新定位寻找。沿肿瘤边缘切开包膜(图4),吸引器钝性分离(图5),吸引器无法分离的条索即为血管或集合系统,用超声刀慢挡切断,如遇集合系统小心保留并防止损伤,如必须切除,用可吸收线严密连续,出血处用80~100瓦电凝止血,可以明显减少出血,保持手术野清晰(图6)。完整切除肿瘤后,用4-0可吸收线连续缝合集合系统,用3-0倒刺线或滑线连续缝合其底(图7),再用2-0倒刺线连续缝合创面(图8)。其底缝合不宜过深,以达到止血为目的,防止过深造成主要血管缺血而丧失较多肾功能。外层缝合深度要达到其底部,边缘厚度不宜超过1 cm,尽量减少因缝合丢失肾功能。最后放置引流管,关闭切口,手术完毕。
经后腹腔入路,取健侧90°卧位,腰部垫高,取经典的“三孔法”进行手术,必要时置入第四个套管,分离肾动脉及目标分支动脉,血管吊带吊起,备阻断。充分游离肾脏及肿瘤,其余同经腹手术。

2 结果
所有手术均顺利完成,无输血及术中中转开放病例。以开始建立气腹到放置完成引流管为手术时间。本组手术时间为(125.8±13.2)min,术中肾动脉分支阻断时间为(22.4±5.6)min,术中出血量为(233.3±30.5)mL,术后住院时间为(6.8±1.7)d。手术前后患肾GFR无明显变化,术前为(45.2±3.1)mL/min,术后1个月为(43.5±2.7)mL/min,差异无统计学意义(P>0.05)。术后随访3~15个月,无出血、漏尿等相关并发症发生。病理结果均为肾透明细胞癌,切缘均为阴性。
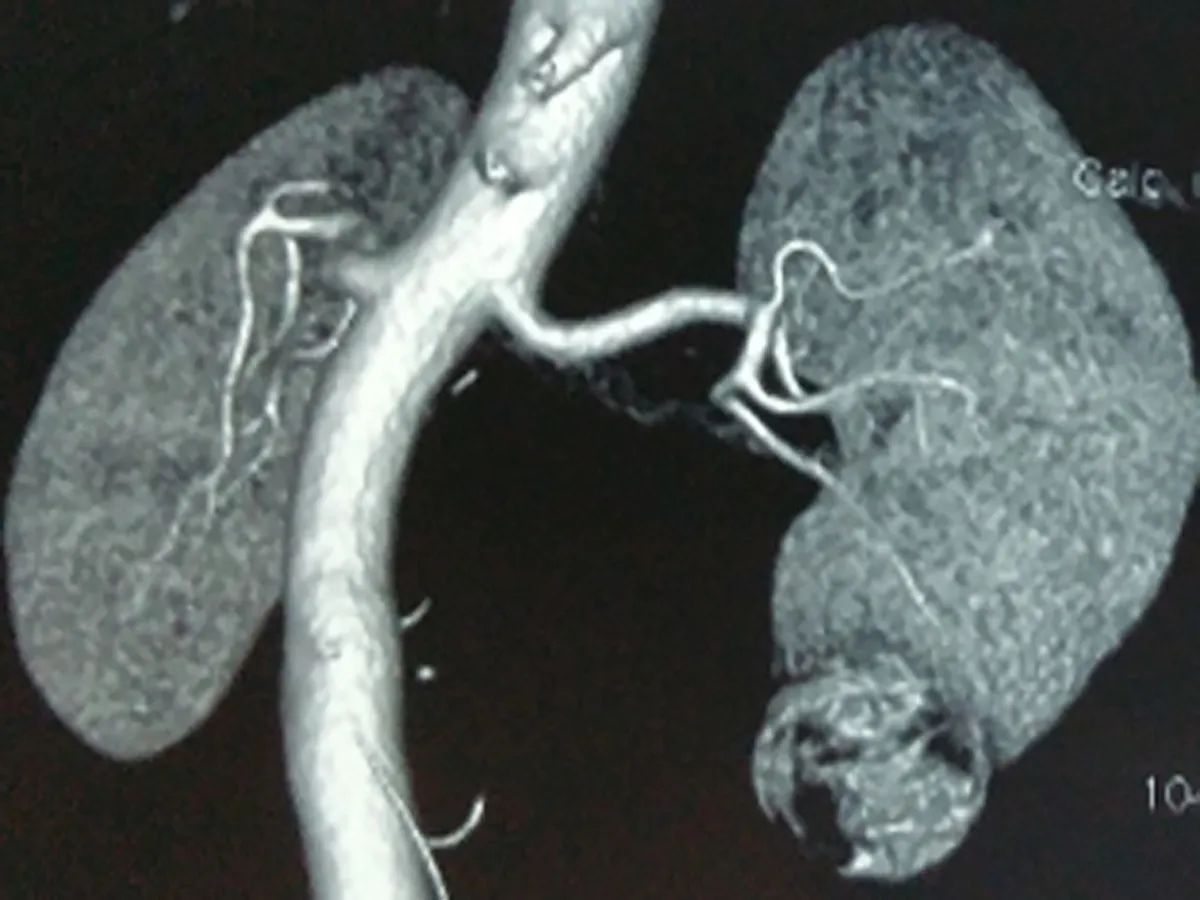
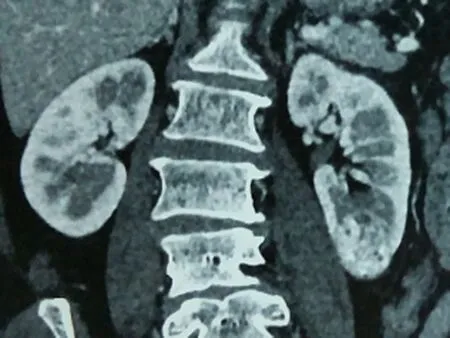
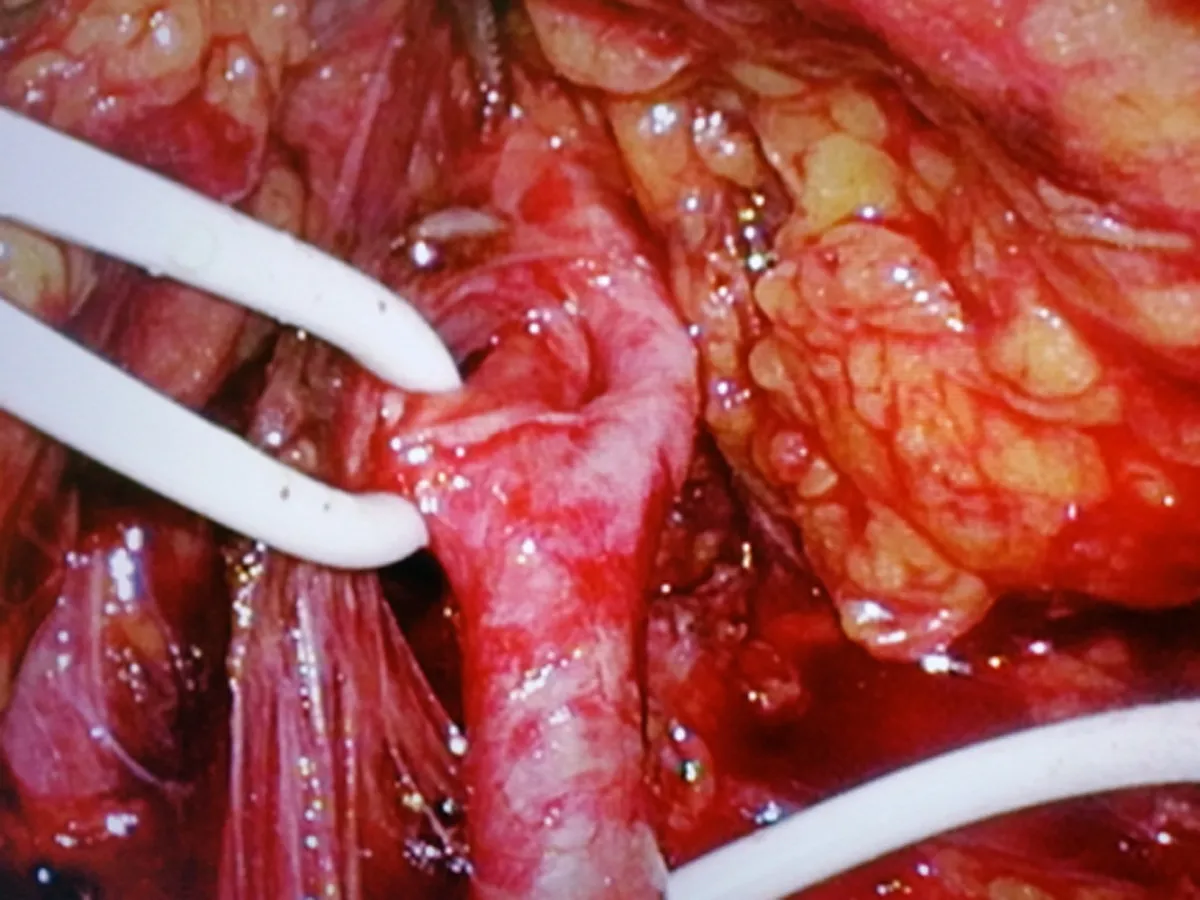
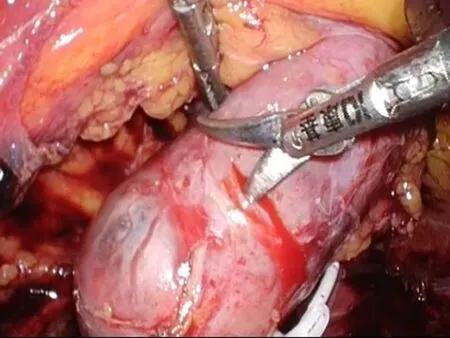
图1 冠状位重建 图2 CTA显示目标动脉 图3 标记目标动脉 图4 沿肿瘤边缘切开包膜
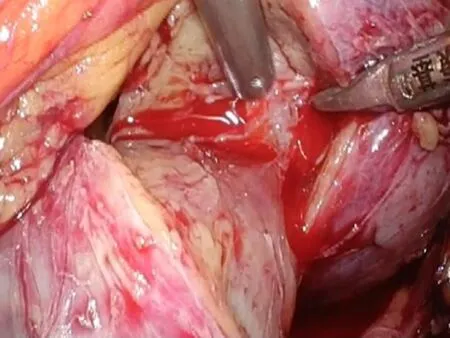


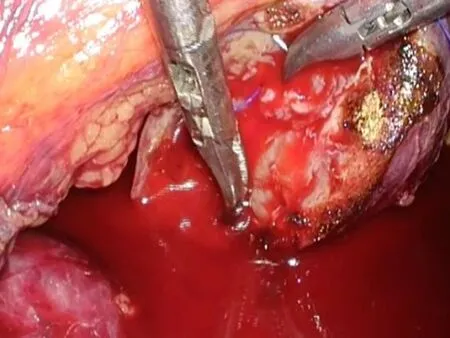
图5 吸引器钝性分离 图6 出血处用80~100瓦电凝止血 图7 3-0倒刺线连续缝合底部 图8 2-0倒刺线连续缝合创面
3 讨论
2011年,Gill等[3]首次报道15例应用“零缺血”技术即为阻断肾脏肿瘤相关肾动脉分支行肾部分切除术,取得了良好的效果。同年,Shao[4]等人正式提出选择性肾动脉分支阻断这一概念,其技术要点在于分离肿瘤所在肾段的供血动脉并进行选择性阻断。这一概念的提出使得肾脏动脉阻断更加精准,肾功能保护更加理想。
随着微创时代的到来,腹腔镜下肾部分切除术逐渐推广使用,并逐渐成为治疗T1a期及部分T1b、T2期肾肿瘤的推荐手术方式[5]。传统的肾部分切除术需要阻断肾动脉,不可避免地造成热缺血损伤。目前,热缺血时间并没有安全范围[6]。肾动脉分支阻断肾部分切除术只阻断供应肿瘤所在区域的动脉分支,其余部分肾脏动脉血供不受影响,从而最大限度的减少了热缺血对肾脏的影响。在Desai等[7]进行的一项121例机器人辅助肾部分切除术患者的回顾性对照研究中,58例患者行肾动脉分支阻断肾部分切除术,63 例行标准肾部分切除术,结果表明在术后肾功能方面,肾动脉分支阻断肾部分切除术组术后肾小球滤过率的下降更低(P=0.03)。在Lanchon等[8]进行的一项30例机器人辅助肾动脉分支阻断肾部分切除术的回顾性研究中,eGFR在术后1个月和术后6个月的变化表明肾动脉分支阻断肾部分切除术对肾功能起到了很好的改善作用(P<0.01)。本研究对手术前后患肾eGFR水平进行测定,术前为(45.2±3.1)mL/min,术后1个月为(43.5±2.7)mL/min,术前和术后eGFR变化不大,表明肾动脉分支阻断肾部分切除术对肾功能有着良好的保护作用。
大量研究证实经腹腔镜肾动脉分支阻断肾部分切除术是安全可行的。Wszolek等[9]和Thompson等[10]均报道了术后漏尿及大出血等并发症的发生率,肾蒂血管全阻断部分切除术漏尿率和出血率比肾动脉分支阻断肾部分切除术高,但差异无统计学意义。Smith等[11]比较了肾动脉分支阻断肾部分切除术与常规血管全阻断的肾部分切除术的出血量,发现肾动脉分支阻断肾部分切除术中估计出血量高于常规肾部分切除术(500 mLvs200 mL,P=0.001),并具有更高的输血率(42%vs21%,P=0.001),但作者认为患者可以减少保留肾单位的肾功能损伤,利大于弊。在Li等[12]进行的一项466例肾部分切除术患者的回顾性对照研究中,314例患者行肾动脉分支阻断肾部分切除术,152例行标准肾部分切除术。结果显示虽然肾动脉分支阻断肾部分切除术组在手术时间、热缺血时间和失血量方面比标准的肾部分切除术略有增加,但其提供了更好的术后早期肾功能(P<0.01)。回顾性分析Gill等[3]、Shao等[4]、Ng等[13]和Abreu等[14]报道的研究,总共约100人进行了肾动脉分支阻断肾部分切除术,术后病理回报显示切缘均为阴性,无肿瘤组织残留。本组行肾动脉分支阻断肾部分切除术的15例患者,未出现出血和漏尿等相关并发症,出血量方面与上述文献报道的类似,病理回报切缘均为阴性。
腹腔镜下肾动脉分支阻断肾部分切除术能够治疗更具有技术挑战性的肿瘤,如位于深部实质,中央或肾门的肿瘤,这些肿瘤通常伴有高级动脉进而可以特异性阻断。但对于位于肾侧位的肿瘤,由于主肾动脉和肿瘤之间的实质增加的距离使得不太可能确定供应肿瘤动脉的分支,另外,如果侧位肿瘤较大,通常有多个供应肿瘤的动脉分支,因而使得这些外周的肿瘤不太适合这种技术。Yu等[15]对一位肾盂癌的患者应用腹腔镜下肾动脉分支阻断肾部分切除术,在术后超过42个月的随访期间没有证据表明复发,为限制于肾盏的肿瘤提供了一种可行的治疗方法。由于肾动脉分支阻断肾部分切除术对于肾功能具有很好的保护作用,越来越多的学者将其应用于孤立肾肿瘤的患者,并取得了良好的手术效果。在手术技巧改进方面,在肾动脉分支阻断肾部分切除术的基础上,“蛙跳式”的腹腔镜保肾手术方式[16]、腹腔镜下分支肾动脉序贯阻断肾部分切除术治疗多发肾肿瘤[17]、机器人单孔腹腔镜下零缺血肾部分切除术[18]等取得了不错的临床效果。
总之,肾动脉分支阻断肾部分切除术治疗早期肾癌是安全、有效的,在疗效方面有更出色的表现。在传统肾主干动脉阻断的基础上,加用各种降温方法如逆行插管低温技术、冰屑低温技术、经肾动脉灌注低温技术[19]也是一种有效保护肾功能的方法。近些年出现的不阻断或免缝合的肾部分切除术更有前景,更加有优势,但风险和并发症也有增加[20]。术者应当根据自身经验和患者病情合理选择手术方案,在规避风险的同时最大限度地保护肾功能。当然肾动脉分支阻断肾部分切除术也存在着诸多不足之处:首先分支动脉阻断后的区域往往大于肿瘤的区域;其次术中分离到动脉的二级甚至三级分支,手术时间明显延长;最后术中过多的刺激肾动脉可能会造成肾动脉的痉挛及术中过多游离造成的副损伤。伴随着数字化影像学的发展,术中缝合和止血技术的进步,肾动脉分支阻断肾部分切除术将会更加成熟和完善。

