不同深度土壤控水对稻田土壤微生物区系及细菌群落多样性的影响*
张 静, 可文静, 刘 娟, 王留行, 陈 浩, 彭 廷, 赵全志
不同深度土壤控水对稻田土壤微生物区系及细菌群落多样性的影响*
张 静, 可文静, 刘 娟, 王留行, 陈 浩, 彭 廷, 赵全志**
(河南农业大学农学院/河南粮食作物协同创新中心/河南省水稻生物学重点实验室 郑州 450046)
为研究不同深度土壤控水对壤土稻田土壤水势、微生物区系和细菌群落多样性的影响, 通过土培池栽试验, 在水稻生育后期设置土壤深度0~5 cm(S05)、0~10 cm(S10)和0~15 cm(S15)控水处理, 以保持水层为对照, 分析了不同深度控水处理下5 cm、10 cm、15 cm深土壤水势与土壤微生物区系、细菌群落多样性的变化。结果表明: 土壤5 cm、10 cm、15 cm深度的水势随着控水深度增加而降低, S05控水处理主要影响上层(5 cm)土壤水势, S10控水处理影响上、中层(10 cm)土壤水势, S15控水处理土壤水势随土层深度的增加而升高。花后8 d和32 d, S05控水处理上层土壤细菌数量显著高于S10、S15控水处理; 花后16~24 d, S05控水处理中层、下层(15 cm)土壤细菌数量均显著高于S15控水处理; 土壤水势与水稻生育后期中、下层土壤细菌数量呈极显著正相关关系。S05控水处理10 cm、15 cm土层的细菌丰富度Chao指数均显著高于S15控水处理及CK。3个控水处理中, 5 cm土层细菌的多样性Shannon指数以S05控水处理最低。优势细菌菌群分析发现, 优势群落主要为变形菌门、绿弯菌门、酸杆菌门、拟杆菌门, 四者总相对丰度在80%以上; S15控水处理中层土壤变形菌门相对丰度低于S05和S10控水处理。3个控水处理土壤样品中优势纲(相对丰度大于2%)达15个, 主要包括α-变形菌纲、β-变形菌纲、δ-变形菌纲、厌氧绳菌纲等, 这4个纲的总相对丰度在47%以上, 其中厌氧绳菌纲相对丰度最高; 上层土壤中S05控水处理的β-变形菌纲相对丰度显著低于S10和S15控水处理。因此, 不同深度土壤控水对壤土土壤水势、细菌数量存在影响, 改变了细菌的多样性及丰富度, 对土壤细菌优势菌种类无显著影响。
水稻土; 控水深度; 土壤水势; 土壤微生物; 土壤细菌群落
水稻()是世界上三大粮食作物之一, 中国有65%以上的人以稻米为主食[1]。水稻的一生几乎都离不开水, 但是, 长期淹水限制水稻根际氧的供应, 根系有氧呼吸受到抑制不利于对碳同化和光合产物的利用。水稻生长中后期需通过调节土壤水分, 增加土壤氧气含量, 改善根系生长的土壤环境, 提高水稻产量和氮素利用效率[2-4], 因此, 干湿交替是当前水稻高产栽培的关键技术环节之一, 其中土壤水势是判断干湿交替过程中复水的主要指标, 已在水稻生产及科研中广泛应用。前人研究表明, 结实期轻度水势胁迫可改良稻米品质, 提高籽粒精米率、整精米率以及崩解值, 垩白度及消碱值降低[5]; 灌浆期0 kPa土壤水势提高了水稻千粒重及结实率进而提高其产量[6]。与黏重的黏质水稻土不同, 壤土稻田水稻中后期土壤控水深度为0~10 cm和0~15 cm时根系活力、土壤酶活性减弱, 产量降低[7]。土壤微生物对于维持土壤系统的稳定性和可持续性具有重要的作用[8]。土壤环境与微生物群落间的相互影响与适应在很大程度上体现了土壤的地力水平[9]。土壤微生物多样性是评价土壤质量变化的重要指标之一[10-11], 能迅速地响应水肥管理、种植模式以及土地利用方式带来的变化[12]。近年来国内外有关长期和短期水稻栽培过程中土壤微生物学的特性研究较多, 林瑞余等[13]发现水稻根际土壤微生物群落、活性和功能多样性与水稻品种密切相关; 刘岳燕[14]对干湿交替、水稻种植及其交互作用对土壤微生物群落影响的研究结果表明, 在水稻生长初期, 土壤微生物群落主要受干湿交替和水稻种植的影响, 在水稻生长末期, 干湿交替对土壤微生物群落的影响小于水稻种植。然而, 以土壤水势作为稻田灌水的指标时, 前人以7.5 cm、10 cm或15~20 cm等不同土壤深度来监测水势[15-17], 土壤水势监测深度不同势必造成不同深度土壤水分含量存在差异。而目前关于不同深度土壤水势差异对土壤微生物区系及细菌群落多样性影响的研究鲜见报道。因此, 本试验采用大田土培池栽试验, 通过调控不同深度的土壤水分, 研究水稻生育后期壤土条件下, 不同深度土壤控水处理后土壤水势的变化对不同深度土壤微生物区系及细菌群落多样性的影响, 为稻田高产栽培技术及节水灌溉的生态机制研究提供理论依据。
1 材料与方法
1.1 试验设计
试验于2015年5—11月在河南农业大学科教园区进行。试验材料为常规粳稻品种‘新稻18’。试验用土壤颗粒组成及基本理化性质见表1。
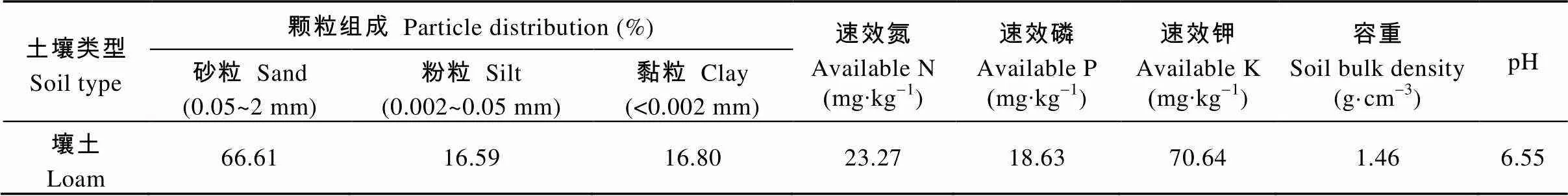
表1 试验用土壤颗粒组成及基本理化性质
试验采用土培池栽(3面为水泥墙, 1面为钢化玻璃, 长×宽×高为2 m×1.5 m×1 m), 设土面以下0~5 cm (S05)、0~10 cm(S10)、0~15 cm(S15)控水3个处理, 并以保持水层(CK)为对照(从处理开始一直保持2 cm左右的水层, 至收获前7 d断水)。不同深度土壤控水处理从孕穗期开始至水稻收获前7 d结束, 分别打开距土面5 cm、10 cm、15 cm的孔上的盖子(图1), S05控水处理当5 cm土壤水势低于-10 kPa时灌水, S10控水处理当5 cm土壤水势低于-15 kPa时灌水, S15控水处理当5 cm土壤水势低于-25~-30 kPa时灌水。灌水采用塑料管大流量土表浇水至整个池中土面全部湿润, 即灌“跑马水”的灌水方式。每个处理重复3次。
全生育期施氮肥(以纯N计)220.8 kg∙hm-2, 按基肥∶分蘖肥∶穗肥3∶3∶4施用。磷肥及钾肥用量以N∶P2O5∶K2O=1∶0.5∶1.2的比例施入, 且全部作为基肥。5月5日塑料软盘单粒播种育秧, 6月上旬单本移栽, 10月中旬收获。栽插密度30 cm×13 cm。常规高产栽培管理。

图1 不同土壤控水深度处理的池栽试验简图
CK: 稻田保持2 cm左右水层; S05: 0~5 cm土层控水, 5 cm土壤水势低于-10 kPa时灌水; S10: 0~10 cm土层控水, 5 cm土壤水势低于-15 kPa时灌水; S15: 0~15 cm土层控水, 5 cm土壤水势低于-25~-30 kPa时灌水。图中空心圆点为孔洞, 用于控制土壤水分。CK: keeping water about 2 cm deep on the soil surface of paddy field; S05: water controlling at 0-5 cm soil layer, irrigating when the soil water potential at 5 cm was lower than-10 kPa; S10: water controlling at 0-10 cm soil layer, irrigating when the soil water potential at 5 cm was lower than-15 kPa; S15: water controlling at 0-15 cm soil layer, irrigating when the soil water potential at 5 cm was lower than-25--30 kPa. The circles are holes used to control soil water.
1.2 测定项目与方法
1.2.1 土壤水势
采用美国Watchdog 2000-Series Weather Stations进行土壤水势监测, 孕穗期将土壤水势传感器埋在5 cm、10 cm、15 cm处, 每1 min测定1次土壤水势, 直至水稻收获。每个小区1次重复。
1.2.2 土壤微生物区系
从花后0 d开始, 即土壤水分控制10 d后, 每隔7 d取1次样, 分别取5 cm、10 cm和15 cm深度土壤样品, 每个小区每个土壤深度3次重复, 采用固体稀释平板法统计微生物数量。细菌、真菌、放线菌分别用牛肉膏蛋白胨琼脂培养基、马丁氏培养基和改良高氏l号培养基[18]。
1.2.3 土壤DNA提取与16S rDNA测序
扬花期(即土壤水分控制10 d后)分别于5 cm、10 cm、15 cm土壤深度取新鲜土样, 置于自封袋中, 然后放入冰盒中, 带回实验室置于-80 ℃冰箱保存, 每个处理3次重复。土壤DNA提取采用试剂盒(Power Soil DNA Isolate Kit, 美国mobio公司)。土壤DNA提取完成后, 进行16S rDNA的V4区扩增, 引物序列如下: 515F: 5¢-GTGCCAGCMGCCGCGGTAA-3¢; 806R: 5¢-GGACTACHVGGGTWTCTAAT-3¢。采用Illumina MiSeq平台进行高通量测序(深圳华大基因公司)。
1.3 数据分析
数据用Microsoft Excel 2010和Origin 2019进行数据处理和作图, 用SPSS 19.0进行数据的统计分析。土壤水势数据取每小时测定的平均值作图。
2 结果与分析
2.1 水稻生育后期不同深度土壤控水处理对土壤水势的影响
由图2a可知, 5 cm处土壤水势在不同控水处理间存在明显差异, S05控水处理水势较高, S10处理次之, S15处理最低。S05处理在5 cm的土壤水势大多维持在-10 kPa左右, S10 处理在5 cm的土壤水势则大多维持在-15 kPa左右。S15处理在5 cm的土壤水势则大多维持在-20~-30 kPa。
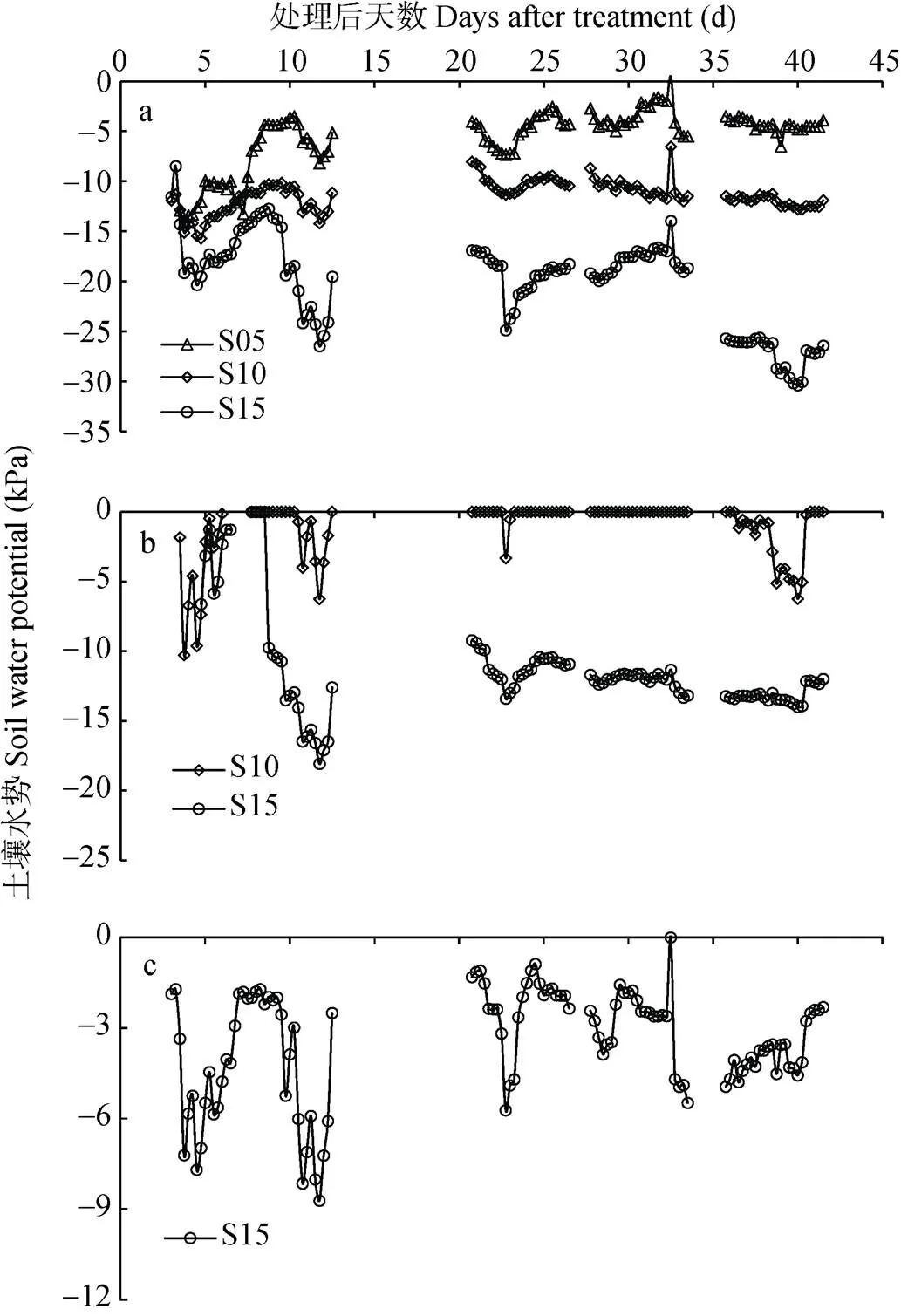
图2 0~5 cm、0~10 cm、0~15 cm控水处理下5 cm土壤深度(a), 0~10 cm、0~15 cm控水处理下10 cm土壤深度(b)和0~15 cm控水处理下15 cm土壤深度(c)的水势变化
因控水处理开始13~21 d出现连续阴天降雨、27 d和34 d因灌水使土壤水势较高超出仪器检测范围, 故出现断点。The missing data occurred at 13-21 d caused by continuous cloudy rain and at 27 d and 34 d caused by irrigation, when soil water potential exceeded the detection limit of soil water potential sensor.
由图2b可知, 10 cm监测深度的土壤水势在不同控水处理间存在差异。S05控水处理10 cm处的土壤水势较高, 仪器未检出; S10控水处理在土壤深度为10 cm处的水势维持在0~-10 kPa, S15控水处理在土壤深度为10 cm处的水势维持在0~-18 kPa。
由图2c可知, S15控水处理在15 cm土壤深度的土壤水势保持在0~-10 kPa, 而由于S05、S10控水处理在15 cm监测深度土壤水势因水分饱和, 仪器未检出。因此, 与S15控水处理相比, S05、S10控水处理主要影响土表至控水层, 即S05控水处理影响了上层(5 cm)、S10控水处理影响了上、中层(5 cm、10 cm)的土壤水势。
2.2 水稻生育后期不同深度土壤控水处理对土壤微生物区系的影响
由图3可见, 5 cm土壤深度, S10控水处理在花后8 d和24~32 d土壤中的真菌、细菌数量, 以及8~24 d土壤中的放线菌数量均显著少于淹水处理(CK); S15控水处理中8 d和32 d土壤中的细菌数量, 0~16 d和32 d土壤中的放线菌数量较CK显著下降; 而S05控水处理与CK间差异未达显著水平。10 cm土壤深度, 3种控水处理花后8 d土壤中真菌和细菌数目以及0~16 d土壤中的放线菌均显著少于CK, 其中S15显著降低了8~32 d 3种微生物的数量。15 cm土壤深度, 各处理对真菌的影响不大, 而S05控水处理16~24 d土壤中细菌数量以及16 d放线菌的数量显著高于CK, S15控水处理则显著降低了整个花后时期的放线菌数量。同一时期, 同一土层深度时随着控水深度的增加, 细菌和放线菌在各时期大多呈下降趋势, S05控水处理的数量较多, S15较少。由此可见, 3种控水处理中, S05控水处理土壤的细菌数量较多, 随着时间的延长上层土壤细菌和放线菌数量大多高于S10、S15控水处理。S15控水处理土壤细菌数量在3个土壤深度均较低。
2.3 水稻生育后期土壤水势与微生物数量的相关性分析
由相关分析结果(表2)可知, 不同深度的土壤水势与真菌和放线菌数量间无显著相关关系。各深度土壤水势与细菌数量间均存在正相关关系, 且在中下层土壤达到极显著。因此, 土壤水势主要影响的是中下层土壤细菌的数量。
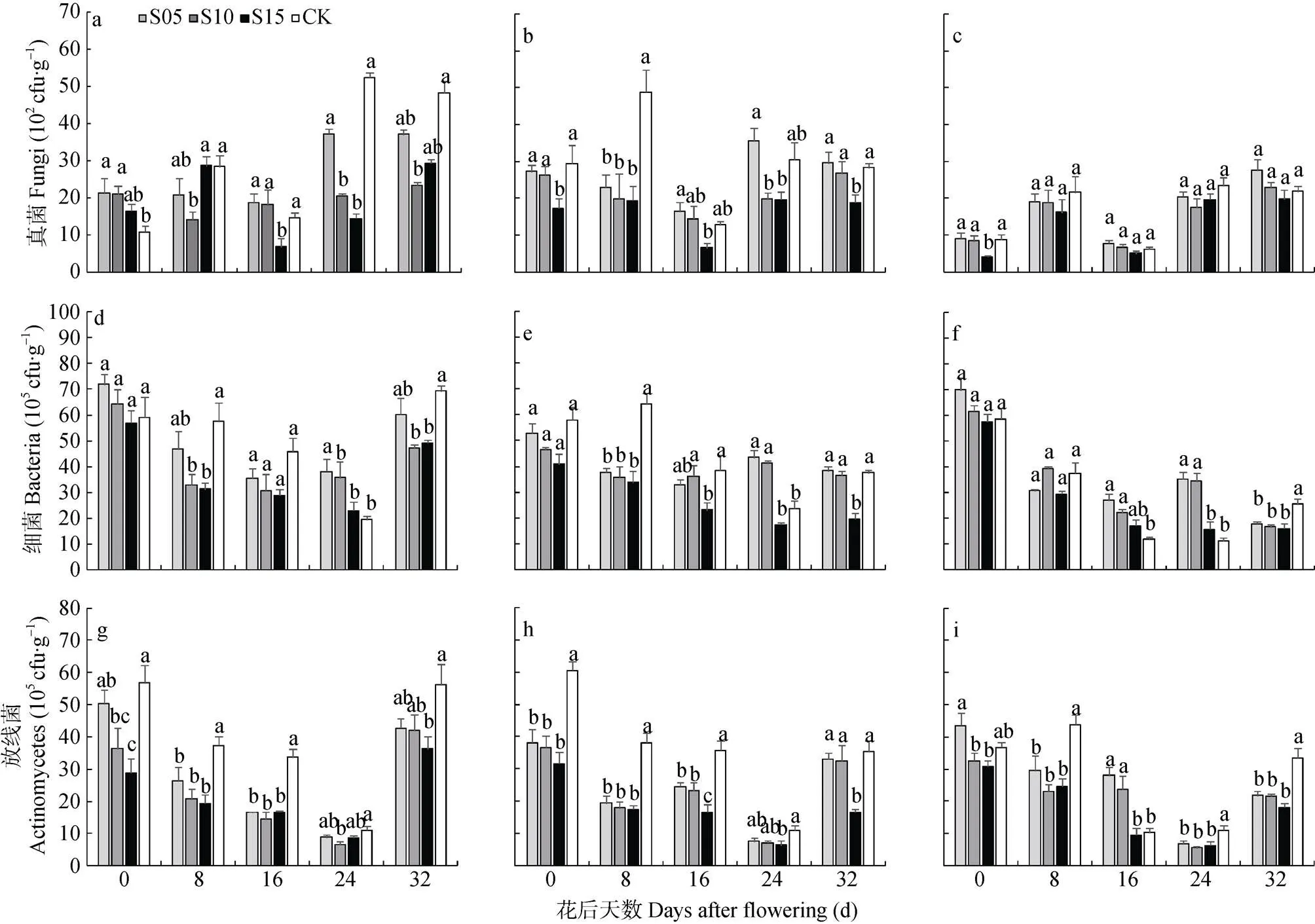
图3 不同深度土壤控水处理中稻田5 cm (a、d、g)、10 cm (b、e、h)、15 cm (c、f、i)土层土壤细菌、真菌和放线菌的数量
不同小写字母表示同一天不同处理间在0.05水平差异显著。Different lowercase letters indicate significant differences among different treatments at the same day at 0.05 level.

表2 水稻生育后期5 cm、10 cm和15 cm土壤水势与微生物数量的相关系数
**表示0.01水平显著相关。** indicates significant correlation at 0.01 level.
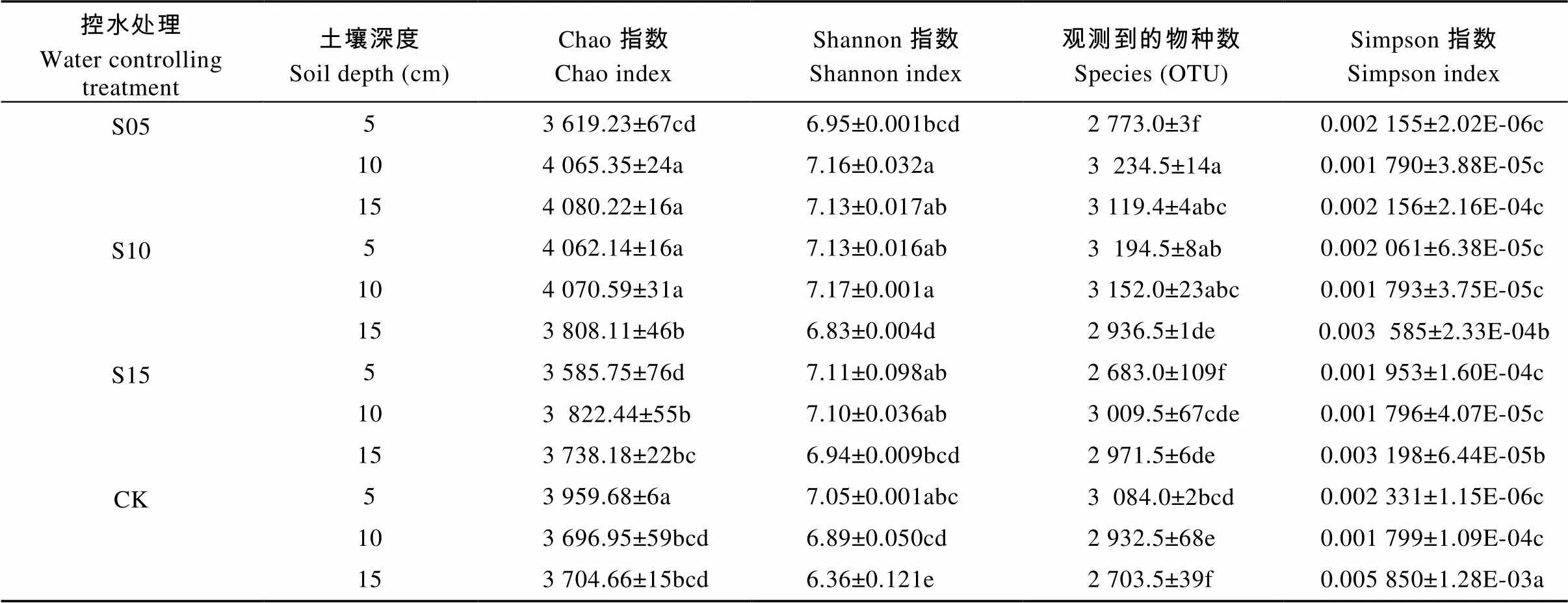
表3 不同深度土壤控水处理中稻田不同深度土壤细菌群落多样性指数
不同小写字母表示处理间在0.05水平差异显著。Different lowercase letters indicate significant differences among treatments at 0.05 level.
2.4 水稻生育后期不同控水处理对细菌群落多样性和群落丰度的影响
通过Illumina MiSeq平台进行Paired-end测序, 36个土壤样品共得到1 124 229个序列(reads), 在97%相似度下划分共得到9 020个OTUs, 利用mothur软件计算多样性指数。由表3可知, 不同控水深度的土壤微生物多样性有显著差异。在S05控水条件下, 5 cm土层的各指数均小于CK, 10 cm以及15 cm土层深度的多样性指数除Simpson指数外, 其他3个指数均大于CK; 控水处理为S10时, 微生物多样性指数除Simpson指数均小于CK外, 其他3个指数整体上均大于CK, 在3个土层中, 10 cm土壤深度的多样性最大, 微生物群落组成最丰富。随着控水深度的递增, 当控水处理为S15时, 除5 cm土壤深度Chao指数(表征物种丰富度)、OTU数以及各层的Simpson指数外, 其他均大于CK。总体上, 在同一土层, 无论是用Shannon指数(表征物种多样性)、Simpson指数还是Chao指数进行评价, 10 cm土壤深度的微生物多样性大多高于5 cm和15 cm土壤深度。由图4可知, 尽管CK处理15 cm土壤深度有的样品序列数已经达22 500, 观察到的物种数仍未到平台值, 说明仍有少量细菌种群未被检测到。12个处理共36个土壤样品稀释曲线已趋于平缓, 说明取样合理, 能比较真实地反映土壤细菌群落, 测序量满足分析要求。
在供试水稻土中, 共有56门的细菌被鉴定出来, 其中丰度较高的前10个门, 包括变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)以及硝化螺旋菌门(Nitrospirae)(图5)。对照处理土壤中细菌主要属变形菌门, 土壤深度为5 cm处, 其变形菌门相对丰度为39.61%, S05和S15控水处理则下降至35.5%和37.22%, 相对丰度分别减少4.11%和2.39%; S10控水处理变形菌门相对丰度较高, 达39.78%。土壤深度为10 cm时, 不同深度控水处理后变形菌门均有小幅度降低, 其中S15处理降幅最大, 为5.39%, 而绿弯菌门较CK均有明显的增加。15 cm土壤深度的变形菌门在各控水处理中均明显增加, 由CK的37.10%分别增加0.92%、5.28%和2.59%, 而拟杆菌门随着控水深度的增加出现递减。
各样品在纲水平具有较高的多样性, 丰度在2%以上的纲达15个(图6), 主要包括α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、厌氧绳菌纲(Anaerolineaceae)、拟杆菌纲(Bacteroidia)、噬纤维菌纲(Cytophagia)、酸杆菌纲(Acidobacteria-6)等。CK的主要土壤细菌, 从纲的水平上来看属绿弯菌门的厌氧绳菌纲, 相对丰度达17.20%, 土壤深度增加后厌氧绳菌纲的相对丰度略微增高, 但各土层深度之间差异不大。其次是变形菌门中的变形菌纲, 变形菌门是淹水土壤的优势类群, 主要包括α-变形菌纲(6.89%)、β-变形菌纲(13.66%)、δ-变形菌纲(9.80%)和γ-变形菌纲(4.66%)。除α-变形菌纲和β-变形菌纲外, 其他变形菌纲相对丰度随着土壤深度的增加逐渐降低。拟杆菌门中主要是拟杆菌纲(Bacteroidia, 2.38%)、噬纤维菌纲(2.50%)和Saprospirae(4.64%)。另外, 放线菌纲(Actinobacteria, 3.44%)和酸杆菌纲(4.10%)的相对丰度随着测量土壤深度的增加, 均出现小幅度升高。
3种控水处理中共同的优势菌纲(>10%)为厌氧绳菌纲(11.70%~18.26%)、β-变形菌纲(7.02%~16.62%)和δ-变形菌纲(6.38%~12.73%)。土壤深度5 cm处, S05控水处理中厌氧绳菌纲的相对丰度为17.63%, 高于S10控水处理(12.11%); β-变形菌纲、δ-变形菌纲则在S05控水处理中相对丰度较低, S10、S15控水处理间差异不大。土壤深度10 cm处, S15控水处理中厌氧绳菌纲的相对丰度高于S05、S10控水处理; β-变形菌纲的相对丰度随着控水处理深度的增加不断下降, CK处理中相对丰度为11.84%, 0~15 cm控水处理相对丰度下降至7.02%; δ-变形菌纲相对丰度则在各处理间变幅不大。土壤深度15 cm处, 厌氧绳菌纲相对丰度在CK处理和S15控水处理中较高, 与S15 控水处理相比, S05控水处理相对丰度降低1.89%, S10控水处理相对丰度降低4.35%。说明随着控水深度的增加, 各个优势菌纲的平均相对丰度均出现不同程度的变化。
3 讨论
研究表明, 水稻中后期干湿交替管理过程中, 土壤水势是重要的复水依据。付景等[17]研究发现, 轻干湿交替灌溉(土壤深度15~20 cm处水势为0~-15 kPa), 提高了水稻结实率和粒重; 而重干湿交替灌溉(15~20 cm土壤深度处水势为0~-30 kPa)则降低了水稻的结实率和粒重。笔者前期的研究结果表明, 以土壤水势-25 kPa作为水稻后期灌水依据, 黏土水势的监测深度宜为15 cm, 壤土则宜为5 cm[7]。水分不仅是微生物原生质的重要组成部分, 也是土壤酶作用的介质[18]。壤土条件下, 0~5 cm控水处理下土壤脲酶和磷酸酶活性均高于0~10 cm和0~15 cm控水处理[7]。本研究从土壤微生物角度出发, 发现S05控水处理有利于土壤细菌的生长繁殖, 控水深度增加引起细菌数量下降, 特别是S15控水处理, 对土壤细菌的生长抑制作用最大。控水处理在一定程度上也降低了土壤真菌以及放线菌数目。因此, S05控水处理有助于壤质水稻土微生物的繁殖增长, 可能是由于不同控水处理下土壤水势发生变化, 改变了稻田土壤的氧气状况所致[19]。
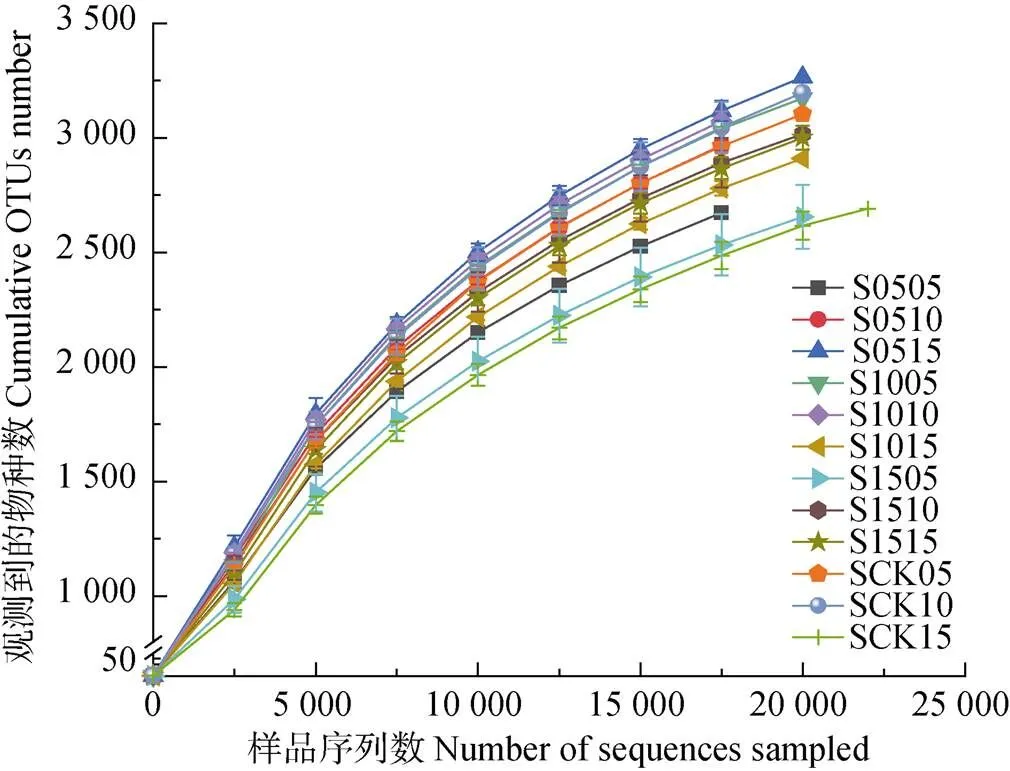
图4 不同深度土壤控水处理中5 cm、10 cm和15 cm土层样品的稀释曲线(各曲线表示在97%的相似性上的总OTUs数)
S后前两位数值代表控水深度, 后两位数值代表土壤取样深度。In the legends, the first two numbers after “S” represent the depth of water controlling, and the latter two numbers represent the depth of soil sampled.
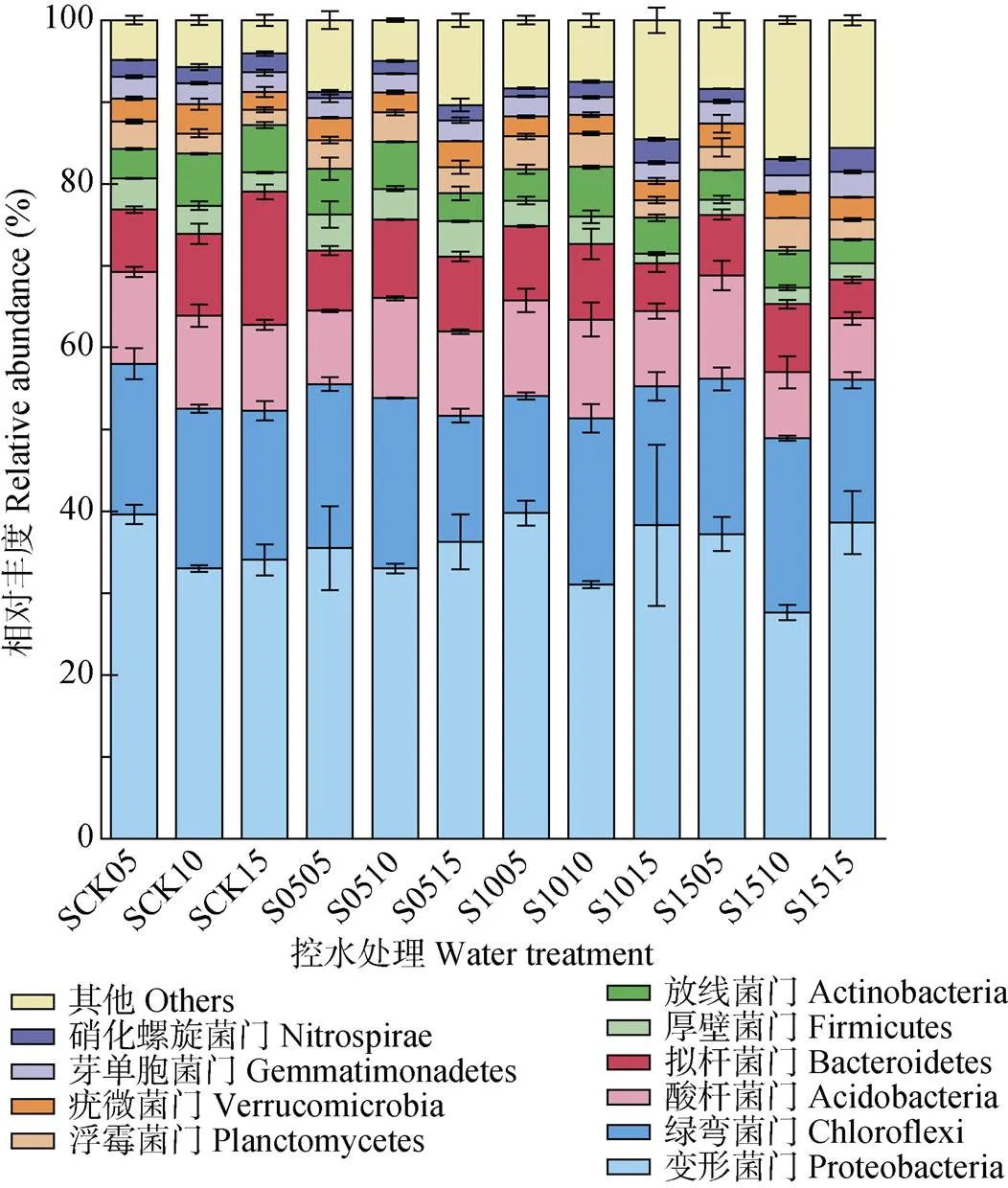
图5 不同深度土壤控水处理中土壤细菌前10大门的相对丰度
S后前两位数值代表控水深度, 后两位数值代表土壤取样深度。For the water treatments, the first two numbers after “S” represent the depth of water controlling, and the latter two numbers represent the depth of soil sampled.
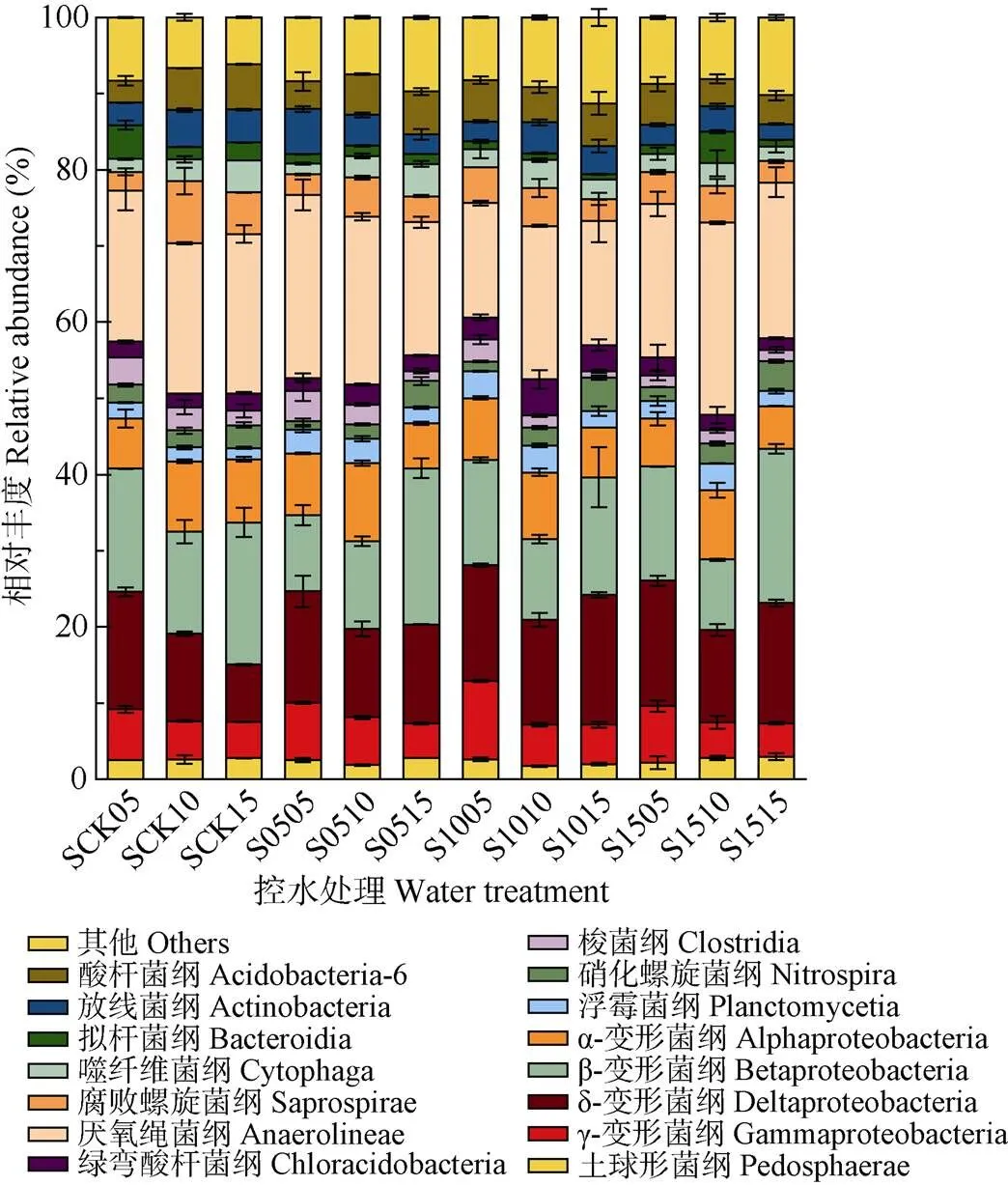
图6 不同深度土壤控水处理中土壤细菌在纲水平 (丰度高于2%)上的分布
S后前两位数值代表控水深度, 后两位数值代表土壤取样深度。For the water treatments, the first two numbers after “S” represent the depth of water controlling, and the latter two numbers represent the depth of soil sampled.
前人研究表明, 相同保存条件下, 对比控水和淹水水稻土微生物活性和群落结构, 无论是Shannon指数, 还是Chao指数或Simpson指数, 淹水土壤的微生物多样性高于控水处理(60%土壤持水量)[20]。同时, 侯海军等[21]从DNA和RNA水平对长期淹水和间歇灌溉稻田土壤细菌群落结构的研究发现, 水分管理方式对稻田土壤细菌丰度和群落结构影响显著; 相较于长期淹水, 间歇灌溉可提高稻田土壤细菌的多样性, 本试验的研究结果与其一致。本研究还发现, 对比不同土层深度, 各控水处理与淹水处理间土壤微生物多样性也存在差异。同一土壤深度进行对比发现, 5 cm土壤深度中土壤微生物多样性只有S10控水处理优于淹水处理, 而中(10 cm)、下(15 cm)土层深度中3种控水处理土壤细菌多样性均高于淹水处理, 且S05控水处理10 cm、15 cm处土壤细菌多样性最好。因此, 控水处理主要是有利于改善壤质水稻土中、下层土壤细菌群落的多样性。
细菌的变形菌门、厚壁菌门、绿弯菌门、拟杆菌门等是厌氧污泥中经常被检测到的类群[22]。与大多数农田土壤相似[23-24], 本研究中门水平的土壤细菌以变形菌门、绿弯菌门、酸杆菌门、拟杆菌门为主, 四者含量约占总测序序列的80.3%, 其中变形菌丰度最高(38.2%)。变形菌门是细菌中最大的门, 其中的许多类群可以进行固氮作用, 并能够适应各种复杂的环境[25-26]。绿弯菌门和酸杆菌门分别占总测序序列的20.5%和11.7%。绿弯菌是一类通过光合作用, 以CO2为碳源产生能量的细菌, 能在有效养分较低的条件下转化难降解的碳。酸杆菌门广泛存在于土壤中, 底泥中的酸杆菌门可参与腐殖质分解的碳循环过程。因此, 土壤不同深度水势的变化将影响到由这些微生物参与的稻田土壤碳素循环过程。
微生物对外界环境变化非常敏感, 土壤微生物优势群落量越多, 其多样性指数越高[27]。刘振香[28]以氮高效率型玉米()品种‘ZN99’为材料, 发现水肥措施主要影响优势菌在群落中的相对丰度, 并不影响这些优势菌的种类。本试验也发现, 相较于长期淹水, 控水处理土壤微生物群落优势菌种类相差不大, 但是相对丰度发生了变化。α-变形杆菌纲、β-变形菌、δ-变形菌纲、γ-变形菌纲、厌氧绳菌纲在各个样品中皆有分布, 属于革兰氏阴性菌, 且含量较高, 说明该壤质稻田土根际周围更容易富集革兰氏阴性菌, 有利于对土壤中腐殖质进行生物降解。细菌群落中厌氧绳菌纲丰度最高, 且淹水土壤中富集的厌氧绳菌纲高于控水土壤, 说明壤土控水后, 不利于厌氧细菌的生长。前人研究还发现[21], 水分胁迫会导致土壤细菌丰度或群落结构发生变化, 水分管理制度的差异也会导致稻田土壤氧化还原电位、pH、土壤无机氮含量、土壤微生物量碳含量、土壤微生物量氮含量、可溶性有机氮含量、可溶性有机碳含量等的变化, 这些因素也是造成土壤细菌丰度和群落结构变化的重要原因。因此, 壤土条件下不同控水深度对土壤细菌的群落结构无明显影响, 主要影响了土壤细菌群落的相对丰度。本试验也为进一步研究不同控水条件下稻田土壤微生物多样性与水稻生长及产量之间的关系打下基础。
4 结论
水稻生育中后期, 不同深度土壤控水对壤土土壤5 cm、10 cm、15 cm深度的水势、微生物区系存在影响, 相较于保持水层处理, 壤土0~5 cm(S05)控水处理有助于提高土壤细菌数量, 改善中下层(10 cm和15 cm)土壤细菌多样性; 同时, 控水处理不会改变各相应土层深度土壤细菌优势菌种类, 只是其相对丰度发生了变化。
[1] WANG F, PENG S B. Yield potential and nitrogen use efficiency of China’s super rice[J]. Journal of Integrative Agriculture, 2017, 16(5): 1000–1008
[2] LIMAMI A M, DIAB H, LOTHIER J. Nitrogen metabolism in plants under low oxygen stress[J]. Planta, 2014, 239(3): 531–541
[3] 胡继杰, 朱练峰, 胡志华, 等. 土壤增氧方式对其氮素转化和水稻氮素利用及产量的影响[J]. 农业工程学报, 2017, 33(1): 167–174 HU J J, ZHU L F, HU Z H, et al. Effects of soil aeration methods on soil nitrogen transformation, rice nitrogen utilization and yield[J]. Transactions of the CSAE, 2017, 33(1): 167–174
[4] JOSHI R, SHUKLA A, MANI S C, et al. Hypoxia induced non-apoptotic cellular changes during aerenchyma formation in rice (L.) roots[J]. Physiology and Molecular Biology of Plants, 2010, 16(1): 99–106
[5] 董明辉, 谢裕林, 刘晓斌, 等. 结实期土壤水势对水稻籽粒品质及其粒间差异的影响[J]. 中国生态农业学报, 2011, 19(2): 305–311 DONG M H, XIE Y L, LIU X B, et al. Effect of soil water potential on grain quality at different spike positions during grain filling in rice[J]. Chinese Journal of Eco-Agriculture, 2011, 19(2): 305–311
[6] 耿艳秋, 金峰, 朱明霞, 等. 灌浆乳熟期土壤水势对苏打盐渍土水稻产量及生理性状的影响[J]. 中国水稻科学, 2014, 28(5): 534–540 GENG Y Q, JIN F, ZHU M X, et al. Effects of soil water potential at grain filling-milky stage on rice yield and physiological traits in saline-alkali soil[J]. Chinese Journal of Rice Science, 2014, 28(5): 534–540
[7] ZHANG J, WANG H B, LIU J. Influence of water potential and soil type on conventionalsuper rice yield and soil enzyme activities[J]. Journal of Integrative Agriculture, 2017, 16(5): 1044–1052
[8] 陶水龙, 林启美, 赵小蓉. 土壤微生物量研究方法进展[J]. 土壤肥料, 1998, (5): 15–18 TAO S L, LIN Q M, ZHAO X R. Research progress on the soil microorganism[J]. Soils and Fertilizers, 1998, (5): 15–18
[9] 徐华勤, 肖润林, 邹冬生, 等. 长期施肥对茶园土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(8): 3355–3361 XU H Q, XIAO R L, ZOU D S, et al. Effects of long-term fertilization on functional diversity of soil microbial community of the tea plantation[J]. Acta Ecologica Sinica, 2007, 27(8): 3355–3361
[10] 罗希茜, 郝晓晖, 陈涛, 等. 长期不同施肥对稻田土壤微生物群落功能多样性的影响[J]. 生态学报, 2009, 29(2): 740–748 LUO X Q, HAO X H, CHEN T, et al. Effects of long-termdifferent fertilization on microbial community functional diversity in paddy soil[J]. Acta Ecologica Sinica, 2009, 29(2): 740–748
[11] 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008, 45(5): 892–900 LIN X G, HU J L. Scientific connotation and ecological service function of soil microbial diversity[J]. Acta Pedologica Sinica, 2008, 45(5): 892–900
[12] 张传更, 高阳, 张立明, 等. 水分管理措施对施用有机肥麦田土壤酶活性和微生物群落结构的影响[J]. 灌溉排水学报, 2018, 37(2): 38–44 ZHANG C G, GAO Y, ZHANG L M, et al. Effects of water management on soil enzyme activities and microbial community structure in wheat fields with organic fertilizer application[J]. Journal of Irrigation and Drainage, 2018, 37(2): 38–44
[13] 林瑞余, 戎红, 周军建, 等. 苗期化感水稻对根际土壤微生物群落及其功能多样性的影响[J]. 生态学报, 2007, 27(9): 3644–3654 LIN R Y, RONG H, ZHOU J J, et al. Impact of rice seedling allelopathy on rhizospheric microbial populations and their functional diversities[J]. Acta Ecologica Sinica, 2007, 27(9): 3644–3654
[14] 刘岳燕. 水分条件与水稻土壤微生物生物量、活性及多样性的关系研究[D]. 杭州: 浙江大学, 2009: 86–95 LIU Y Y. Relationship between soil moisture regime and microbial biomass, activity, diversity in paddy soils[D]. Hangzhou: Zhejiang University, 2009: 86–95
[15] 邱泽森, 丁艳峰, 童晓明, 等. 土水势在水稻节水灌溉中的应用[J]. 江苏农业科学, 1993, (2): 5–8 QIU Z S, DING Y F, TONG X M, et al. Application of soil water potential in water saving irrigation of rice[J]. Jiangsu Agricultural Sciences, 1993, (2): 5–8
[16] 朱庆森, 邱泽森, 姜长鉴, 等. 水稻各生育期不同土壤水势对产量的影响[J]. 中国农业科学, 1994, 27(6): 15–22 ZHU Q S, QIU Z S, JIANG C J, et al. Effect of low soil water potential on rice yield[J]. Scientia Agricultura Sinica, 1994, 27(6): 15–22
[17] 付景, 刘洁, 曹转勤, 等. 结实期干湿交替灌溉对2个超级稻品种结实率和粒重的影响[J]. 作物学报, 2014, 40(6): 1056–1065 FU J, LIU J, CAO Z Q, et al. Effects of alternate wetting and drying irrigation during grain filling on the seed-setting rate and grain weight of two super rice cultivars[J]. Acta Agronomica Sinica, 2014, 40(6): 1056–1065
[18] 武汉大学,复旦大学生物系微生物教研室. 微生物学[M]. 北京: 高等教育出版社, 1987: 30–35Wuhan University, Microbiology Teaching and Research Office in the Department of Biology in Fudan University. Science of Microbiology[M]. Beijing: Higher Education Press, 1987: 30–35
[19] 张静, 刘娟, 陈浩, 等. 干湿交替条件下稻田土壤氧气和水分变化规律研究[J]. 中国生态农业学报, 2014, 22(4): 408–413 ZHANG J, LIU J, CHEN H, et al. Change in soil oxygen and water contents under alternate wetting and drying in paddy fields[J]. Chinese Journal of Eco-Agriculture, 2014, 22(4): 408–413
[20] 王娟. 稻田土壤碳氮转化与微生物群落结构及活性之间的联系机制[D]. 杭州: 浙江大学, 2015: 29–43 WANG J. The relationship of microbial community structure and activity to carbon and nitrogen transformations in paddy soil[D]. Hangzhou: Zhejiang University, 2015: 29–43
[21] 侯海军, 张文钊, 沈建林, 等. 水分管理对稻田细菌丰度与群落结构的影响[J]. 生态环境学报, 2016, 25(9): 1431–1438 HOU H J, ZHANG W Z, SHEN J L, et al. Effect of water management on soil bacterial abundance and community in the rice paddy field[J]. Ecology and Environmental Sciences, 2016, 25(9): 1431–1438
[22] AHRING B K. Perspectives for anaerobic digestion[J]. Advances in Biochemical Engineering/Biotechnology, 2003, 81: 1–30
[23] FIERER N, JACKSON R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626–631
[24] JANSSEN P H. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes[J]. Applied and Environmental Microbiology, 2006, 72(3): 1719–1728
[25] LIU J J, SUI Y Y, YU Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113–122
[26] 罗培宇. 轮作条件下长期施肥对棕壤微生物群落的影响[D]. 沈阳: 沈阳农业大学, 2014 LUO P Y. Effect of Long-term fertilization on microbial community in a brown soil under crop-rotation system[D]. Shenyang: Shenyang Agricultural University, 2014
[27] 邵颖, 刘长海. 土壤微生物与植被、温度及水分关系的研究进展[J]. 延安大学学报: 自然科学版, 2017, 36(4): 43–48 SHAO Y, LIU C H. Research progress on the relationship between soil microorganism and vegetation, temperature and moisture[J]. Journal of Yan’an University: Natural Science Edition, 2017, 36(4): 43–48
[28] 刘振香. 不同水肥处理对夏玉米田土壤理化性质及微生物特性的影响[D]. 泰安: 山东农业大学, 2014 LIU Z X. Effects of irrigation and nitrogen on physical and chemical properties and microbiologic properties of soil on summer corn field[D]. Tai’an: Shandong Agricultural University, 2014
Influence of water controlling depth on soil microflora and bacterial community diversity in paddy soil*
ZHANG Jing, KE Wenjing, LIU Juan, WANG Liuhang, CHEN Hao, PENG Ting, ZHAO Quanzhi**
(College of Agronomy, Henan Agricultural University / Collaborative Innovation Center of Henan Grain Crops / Key Laboratory of Rice Biology in Henan Province, Zhengzhou 450046, China)
Soil water potential as one of the main indexes of irrigation during alternation of wetting and drying process, has been widely applied in rice production and scientific research. To investigate the influence of soil water potential on soil micoflora and bacterial community diversity, 3 treatments of soil water controlling depth [0-5 cm (S05), 0-10 cm (S10) and 0-15 cm (S15)] were set in a pool-culture experiment. Dilution-plate method and the technology of high-throughput sequencing on Illumina Miseq platform were used to detect the numbers of fungi, bacteria and actinomycetes, and bacterial community structure and diversity under different treatments (CK, keeping 2 cm surface water layer). The results showed that soil water potential decreased with the increase of water controlling depth. The treatment of S05 mainly affected soil water potential of the upper soil layer (5 cm), while the treatment of S10 affected soil water potential of the top and middle soil layer (5 cm and 10 cm). Soil water potential of S15 treatment enhanced with the increase of soil layer depth. Soil bacteria number at the upper layer (5 cm) under S05 treatment was higher than that under S10 and S15 treatments at 8 and 32 days after rice flowering, while that at the middle and lower soil layer (10 cm and 15 cm) under S05 treatment was higher than that under S15 treatments at 16-24 days after rice flowering. Soil water potential was significantly correlated with soil bacterial number at the late period of rice growth. The bacterial community structure was profiled by sequencing the V4 16S rDNA gene. A total of 1 124 229 sequences were obtained, and 9 020 OTUs (Operational Taxonomic Units) were generated at 3% cutoff level. The richness (Chao index) of bacterial community at the 10 cm and 15 cm soil layers under S05 treatment were significantly higher than that under S15 and CK treatments. The diversity of bacterial community (Shannon index) in 5 cm soil layer was lowest under S05 treatment. The dominant bacteria phylums were Proteobacteria, Chloroflexi, Acidobacteria, and Bacteroidetes, whose relative abundance were more than 80%. The relative abundance of Proteobacteria of the 10 cm soil under S15 treatment was less than that under S05 and S10 treatments. Fifteen predominant classes (relative abundance > 2%) were found in these samples, in which the total relative abundance of Alphaproteobacteria, Betaproteobacteria, Deltaproteobacteria, and Anaerolineae was above 47%. Anaerolineae was the most abundant class. The relative abundance of Betaproteobacteria in 5 cm soil layer under S05 treatment was less than that under S10 and S15 treatments. Therefore, water controlling depth in loam influenced soil water potential and soil microbial number, and then affected the diversity and abundance of bacterial community. The water controlling depth of 0-5 cm in loam was helpful to improve the soil bacterial number and diversity at the 10 cm and 15 cm soil layers.
Paddy soil; Water controlling depth; Soil water potential; Soil microflora; Soil bacterial community
, E-mail: qzzhaoh@126.com
Apr. 12, 2018;
Sep. 7, 2018
S511; S275
A
2096-6237(2019)02-0277-09
10.13930/j.cnki.cjea.180373
* 国家自然科学基金项目(31271651)、国家重点研发计划项目(2016YFD0300505, 2016YFD0300900)、河南省水稻产业技术体系(S2012-04-G02)和公益性行业(农业)科研专项(201303102)资助
赵全志, 主要研究方向为水稻生理生态。E-mail: qzzhaoh@126.com
张静, 主要研究方向为水稻生理生态。E-mail: zhjing98@126.com
2018-04-12
2018-09-07
* This study was supported by the National Natural Science Foundation of China (31271651), the National Key Research and Development Project of China (2016YFD0300505, 2016YFD0300900), the Industrial Technology System of Rice of Henan Province (S2012-04-G02), and the Special Fund for Agro-scientific Research in the Public Interest of China (201303102).
张静, 可文静, 刘娟, 王留行, 陈浩, 彭廷, 赵全志. 不同深度土壤控水对稻田土壤微生物区系及细菌群落多样性的影响[J]. 中国生态农业学报(中英文), 2019, 27(2): 277-285
ZHANG J, KE W J, LIU J, WANG L H, CHEN H, PENG T, ZHAO Q Z. Influence of water controlling depth on soil microflora and bacterial community diversity in paddy soil[J]. Chinese Journal of Eco-Agriculture, 2019, 27(2): 277-285

