4种常见药(毒)物GC-MS定性分析的离子丰度比
刘少丹 ,闵涛 ,辛国斌 ,张大明
(1.迪安鉴定科学研究院,浙江 杭州 310000;2.上海迪安司法鉴定有限公司,上海 200000;3.北京市公安司法鉴定中心,北京 100192)
法医毒物分析中,气相色谱-质谱(gas chroma⁃tography-mass spectrometry,GC-MS)定性分析结果的确认主要基于两部分:一是保留时间的确认;二是质谱数据的分析。质谱数据的分析需要在确认保留时间的前提下进行。离子丰度比是指物质的特征碎片离子的丰度与基峰丰度的比值。通常特征碎片离子相对丰度的确认指标是根据相对丰度或离子丰度比的大小分段进行比较的,目前最常见的分段是按照特征碎片离子相对丰度或离子丰度比的大小将其分为4段,各段有其相应的最大允许偏差[1-8]。但是目前也有一些指南的判定不考虑相对丰度或离子丰度比的大小[9-14]。国家标准[15-17]中,要求质谱特征碎片离子及相对丰度一致;行业标准[18]中,则要求谱库检索匹配率不低于90%。另一行业标准[19]仅要求生物样本中出现相应特征碎片离子即可,对相对丰度没有提出要求。虽然近年来发布的标准方法、规范或指南性文件中,不同应用领域均对色谱-质谱定性判断给出了明确的判定要求,但是各标准差异较大,即使是同领域的不同标准[4,14]也存在差异,尚不明确其定性判定要求的具体数值因何而来。同时,多数指南均提出待检样本应与空白添加标准物质或标准物质溶液在可比较的浓度、同一批处理及相同的条件下测定[1-5,9-17]。da SILVA[20]运用气相色谱-串联质谱(gas chromatog⁃raphy-tandem mass spectrometry,GC-MS/MS)研究2种农药检出限水平的色谱质谱图,采用贝叶斯定理分析数据,发现相对丰度的偏差无法设定为一个具体数值,只有药物浓度在检测限(limit of examination,LOE)以上时才有阳性的可能。MOL等[21]运用不同的液相色谱-质谱仪研究蔬菜水果中农药的离子丰度比的最大允许相对偏差,判定范围为±45%,但是该实验没有考虑浓度与离子丰度比偏差的关系。另外,质谱数据的分析不仅与待测物质浓度有关,还需考虑其他因素,如选择合适的特征离子(峰)的数量。多数指南[1-5,9-13,15-17]中要求,在全扫描或者选择离子监测(se⁃lected ion monitor,SIM)模式下需选择至少3个碎片,同时要求所选择的特征离子的信噪比(S/N)必须大于3。在此基础上,本研究通过采用GC-MS全扫描模式对地西泮、艾司唑仑、敌敌畏和甲拌磷4种常见药(毒)物进行检测,以探讨GC-MS检测血样中常见药(毒)物特征碎片离子的离子丰度比的最大允许偏差,以期为质谱定性判断提供科学可靠的实验数据。
1 材料与方法
1.1 主要仪器与试剂
GCMS-TQ8030三重四极杆气质联用仪(日本岛津公司),7890A-5875C气相色谱-质谱联用仪(美国Agilent公司),3-30K高速冷冻离心机(德国Sigma公司),PL2002-IC电子天平[梅特勒-托利多仪器(上海)有限公司],10-XC-88L医用低温箱(合肥市齐美电器有限公司)。
敌敌畏、甲拌磷、地西泮和艾司唑仑标准品(1 mg/mL)均购于中国计量科学研究院,磷酸三丁酯(99.8%)和盐酸双苯戊二氨酯(SKF525A,99.8%)均购于美国Sigma公司,甲醇、乙醇及乙酸乙酯为分析纯。
1.2 GC-MS条件
GC-MS条件1和GC-MS条件2在实验室1(Lab1)进行,GC-MS条件3在实验室2(Lab2)进行。
1.2.1 GC-MS条件1
GCMS-TQ8030三重四极杆气质联用仪,色谱柱为Rxi-5MS毛细管柱(30m×0.25mm,0.25μm);柱温:初始温度100℃,保持1 min,升温速率为10℃/min,至280℃保持5 min;载气为He,流速1 mL/min;分流进样,分流比10∶1,进样体积1μL。
质谱条件:电子轰击(electron impact,EI)离子源,电子束能量70 eV,离子源温度250℃,接口温度270℃,溶剂延迟时间为2min;扫描方式为全扫描,扫描范围m/z50~450。
1.2.2 GC-MS条件2
GCMS-TQ8030三重四极杆气质联用仪,色谱柱为DB-5MS毛细管柱(30m×0.32mm,0.25μm);柱温:初始温度80℃,保持2 min,升温速率为10℃/min,至280℃保持5 min;载气为He,流速1 mL/min;分流进样,分流比10∶1,进样体积1μL。
质谱条件同1.2.1节所述质谱条件。
1.2.3 GC-MS条件3
7890A-5875C气相色谱-质谱联用仪,色谱柱为DB-5MS毛细管柱(30m×0.25mm,0.25μm);柱温:初始温度100℃,保持1 min,升温速率为10℃/min,至230℃保持5 min;载气为He,流速1 mL/min;分流进样,分流比10∶1,进样体积1μL。
质谱条件同1.2.1节所述质谱条件。
1.3 标准溶液的配制
用甲醇配制质量浓度为100 μg/mL的甲拌磷和敌敌畏混合标准储备液A,用乙醇配制质量浓度为100 μg/mL的地西泮和艾司唑仑混合标准储备液B,分别置于-20℃冰箱冷冻保存。使用时按需稀释成不同质量浓度的标准工作液。
用乙醇配制质量浓度均为1 mg/mL的磷酸三丁酯、SKF525A内标储备液,分别置于-20℃冰箱冷冻保存。使用时稀释成10μg/mL的内标标准工作液。
分别取适量混合标准储备液A,逐级稀释成质量浓度为 0.5、1.0、2.0、5.0和10.0 μg/mL 的混合标准工作液,每个工作液中均含有2μg/mL的内标磷酸三丁酯,同一质量浓度制备12个。
分别取适量混合标准储备液B,逐级稀释成质量浓度为 0.5、1.0、2.0、5.0和10.0 μg/mL 的混合标准工作液,每个工作液中均含有1μg/mL的内标SKF525A,同一质量浓度制备12个。
1.4 样品前处理
样品前处理程序:移取血液0.5mL,加1mL乙酸乙酯,超声10 min混匀,-4℃下以10 397×g离心5 min,移取上清液600 μL,添加200 μL不同质量浓度的标准工作液和200μL内标工作液,摇匀后,取1μL进样。
抽取编号为1~20的20个来源的空白血样,配制成质量浓度为0、1.0、2.0、5.0 μg/mL的甲拌磷和敌敌畏混合加标血样,同一质量浓度的加标血样在每个来源的血样中均制备3个。抽取编号为21的空白血样,按照上述前处理过程配制成质量浓度为0、0.5、1.0、2.0、5.0、10.0μg/mL的甲拌磷和敌敌畏混合加标血样,同一质量浓度的加标血样制备11个。上述样本以Lab1的GC-MS条件1进样。共71个空白血样,235个加标血样。
抽取编号为1~20的20个来源的空白血样,配制成质量浓度为0、0.5、1.0、2.0、5.0、10.0 μg/mL的地西泮和艾司唑仑混合加标血样,同一质量浓度的加标血样在每个来源的血样中均制备6个。上述样本以Lab1的GC-MS条件2进样。共120个空白血样,600个加标血样。
抽取编号为1~20的20个来源的空白血样,配制成质量浓度为0、0.5、1.0、2.0、5.0、10.0 μg/mL的甲拌磷和敌敌畏混合加标血样,同一质量浓度的加标血样在每个来源的血样中均制备3个。上述样本以Lab2的GC-MS条件3进样。共60个空白血样,300个加标血样。
根据预实验结果,血样添加甲拌磷和敌敌畏的检出限(limit of detection,LOD,信噪比大于3)和2倍检出限(2LOD)分别为0.05μg/mL和0.10μg/mL,血样添加甲拌磷和敌敌畏的定量限(limit of quantitation,LOQ,信噪比大于10)和2倍定量限(2LOQ)分别为0.15 μg/mL和0.30 μg/mL;血样添加地西泮和艾司唑仑的LOD和2LOD分别为0.03 μg/mL和0.06 μg/mL,血样添加地西泮和艾司唑仑的LOQ和2LOQ分别为0.10μg/mL和0.20μg/mL。配制相应质量浓度的血液添加样本,每个质量浓度制备12个,共96个加标血样,按照上述前处理方法进行前处理。分别以Lab1的GC-MS条件1和GC-MS条件2进样。同时按照1.3节标准溶液的配制,制备相应质量浓度的混合标准溶液,每个质量浓度制备12个。
1.5 进样顺序
按照空白乙醇试剂、不同质量浓度混合标准工作液、不同浓度加标血样的顺序循环进样,进样过程中均按照0、0.5、1.0、2.0、5.0、10.0μg/mL的顺序进样,在10.0 μg/mL质量浓度后添加洗针步骤。Lab1共有835个加标血样进样,Lab2共有300个加标血样进样。
按照空白乙醇试剂、不同质量浓度检出限混合标准工作液、不同浓度检出限加标血样的顺序循环进样。Lab1共有96个不同质量浓度的加标血样进样。
1.6 数据处理
本研究选择的特征碎片离子如表1所示。由于标准品的离子丰度比与浓度和信噪比均相关,本研究为了更好地反映离子丰度比参考值(reference ion ratios,R-I-R)[21],在分析标准品的离子丰度比与浓度关系时,选择相对标准偏差(relative standard devia⁃tion,RSD)<10%的离子丰度比,计算其平均值。在分析标准品的离子丰度比与信噪比关系时,选择信噪比大于100的离子丰度比,计算其平均值。

表1 常见药(毒)物的特征碎片离子
加标血样的离子丰度比与R-I-R的差值即为绝对偏差(deviation,D)1,以百分比形式表示。加标血样的离子丰度比的相对偏差(relative deviation,RD)1为D1与R-I-R的比值。由于离子丰度比具有浓度依赖性[14],离子丰度比的绝对偏差D2是1~21号加标血样所测得的离子丰度比与前一次进样的同一浓度混合标准品的离子丰度比相减所得。离子丰度比的D2与其相同浓度标准品溶液中离子丰度比的比值为加标血样离子丰度比的相对偏差RD2。
在2个实验室、3种色谱条件下,离子丰度比的D1、D2、RD1、RD2经SPSS 20.0软件的两样本t检验,发现2个实验室离子丰度比D1、D2、RD1、RD2的差异均无统计学意义(P>0.05)。因此将2个实验室加标血样的离子丰度比数据合在一起分析。
假阴性率是指加标血样中各物质满足相应的绝对保留时间为±0.05 min或相对保留时间为±0.5%范围内,同时离子丰度比的信噪比≥3,依据MOL等[21]对信噪比进行分段,各分段中不满足离子丰度比假设的各个范围的最大允许偏差的概率。
假阳性率是指空白血样中各物质满足相应的绝对保留时间为±0.05 min或相对保留时间为±0.5%范围内,且相应离子丰度比的相对偏差在±50%范围内的样本个数所占比例。Lab1中共检测191个空白血样,用来分析假阳性率。
本实验中一共有1231个加标血样,总计7386个特征碎片离子的离子丰度比。实验中将不符合要求的数据(信噪比小于3或因人为及仪器因素所致不正常的数据)剔除,共6453个有效数据。其中有质量浓度为2LOQ的24个混合加标血样(48个单标血样),总计144个离子丰度比,去除不符合要求的数据,满足实验条件的离子丰度比数据有132个。
2 结 果
2.1 标准品的离子丰度比
2.1.1 标准品的离子丰度比与浓度和信噪比的关系
从表2~3可以看出,各标准品的离子丰度比在质量浓度为2.0 μg/mL及其以上时,RSD均小于10%。从图1~2可以看出,当信噪比小于100时,离子丰度比分布散乱,当信噪比大于100时,分布均一。

表2 Lab1标准品的离子丰度比在不同质量浓度的平均值和相对标准偏差 (n=12)
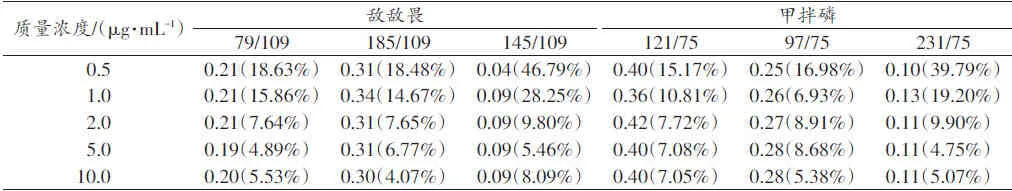
表3 Lab2标准品的离子丰度比在不同质量浓度的平均值和相对标准偏差 (n=12)
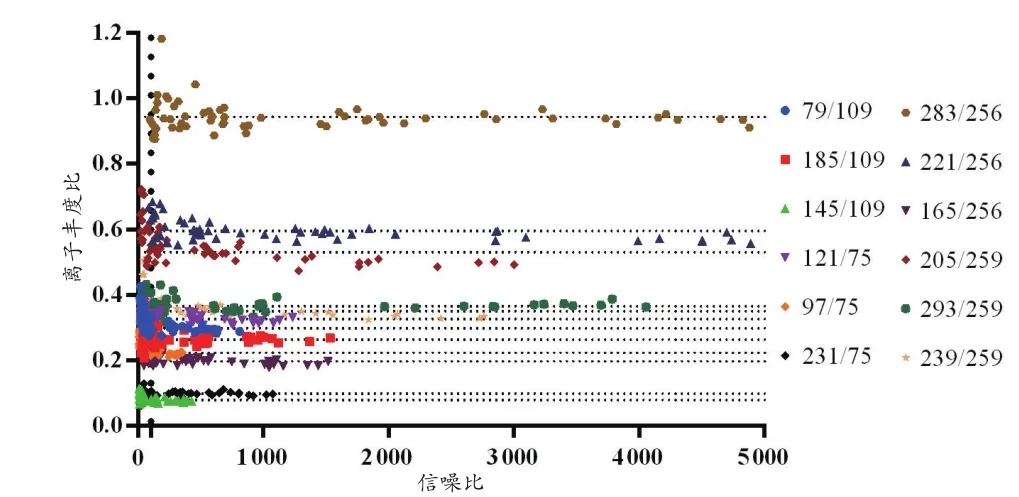
图1 Lab1标准品的离子丰度比与信噪比的关系
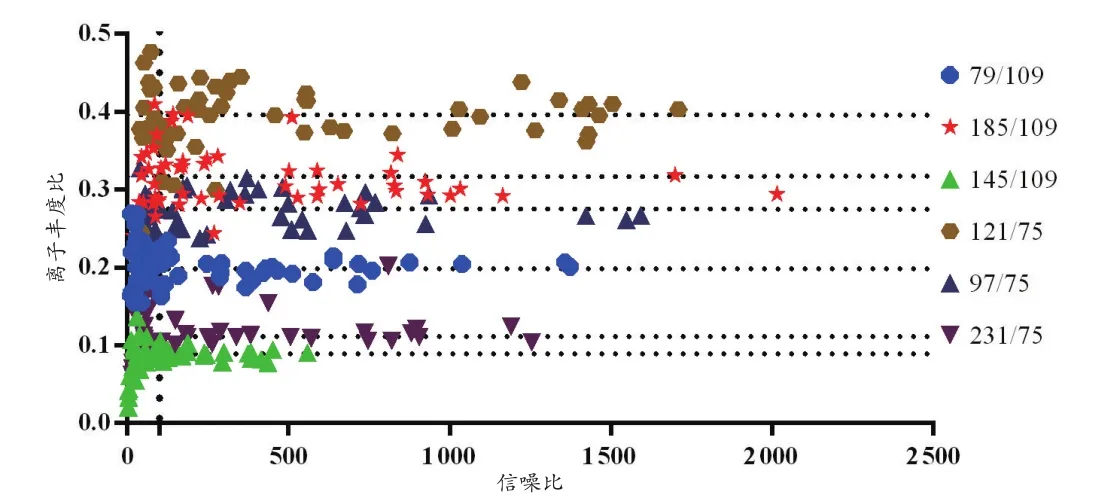
图2 Lab2标准品的离子丰度比与信噪比的关系
2.1.2 离子丰度比的参考值
标准品的离子丰度比按浓度和信噪比两种方式计算,由于两种计算方式的离子丰度比差异无统计学意义,故以浓度方式计算的离子丰度比作为R-I-R,具体见表4。

表4 标准品的离子丰度比参考值
2.2 加标血样离子丰度比的偏差
2.2.1 加标血样离子丰度比的偏差与R-I-R的关系
图3中离子丰度比的D1有99.97%(6 451/6 453)在±20%范围内,98.76%(6 373/6 453)在±10%范围内。图4中离子丰度比的RD1有93.47%(6031/6453)在±20%范围内,96.02%(6196/6453)在±25%范围内。
2.2.2 加标血样离子丰度比的偏差与质量浓度的关系
从图5~6可以看出,D2和RD2随质量浓度的增加均呈减小趋势。低质量浓度(LOD、2LOD、LOQ)时,95.04%(6 133/6 453)的D2≤10%。经统计分析,离子丰度比D2的95%置信区间为(-12.24%,10.26%)。在低质量浓度时,RD2较大甚至超过±70%。当质量浓度为2LOQ时,95.45%(126/132)的RD2≤50%。但是在质量浓度≥2.0 μg/mL时,95%的RD2≤25%。不考虑质量浓度的情况下,95.31%(6 152/6 453)的RD2≤35%。经统计分析,离子丰度比RD2的95%置信区间为(-32.26%,37.53%)。

图3 加标血样离子丰度比的D1与R-I-R的关系
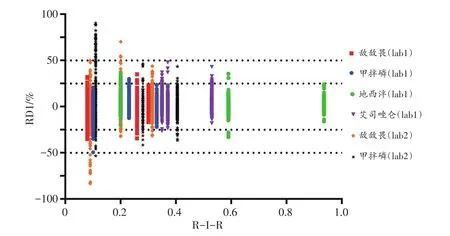
图4 加标血样离子丰度比的RD1与R-I-R的关系

图5 加标血样离子丰度比的D2与质量浓度的关系
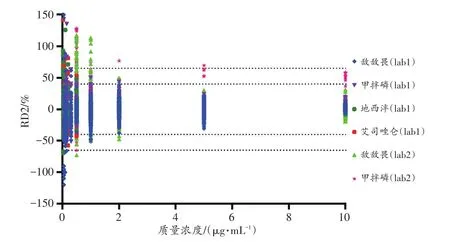
图6 加标血样离子丰度比的RD2与质量浓度的关系
2.2.3 加标血样离子丰度比的RD1与信噪比的关系
从图7可以看出,随着信噪比的增加,RD1分布在±25%范围内。
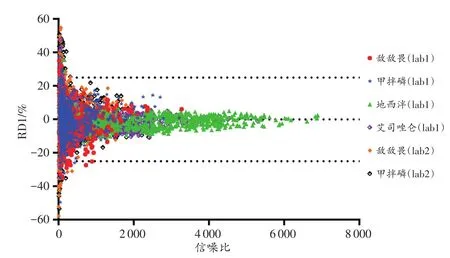
图7 加标血样离子丰度比的RD1与信噪比的关系
2.2.4 加标血样离子丰度比RD1的分布
经统计分析加标血样离子丰度比的RD1,发现其呈现近似正态分布,平均值为0.02%,标准差(standard deviation,SD)为10.46%,95%置信区间为(-20.57%,23.55%),详见图8。
2.3 假阴性率
在同一最大允许偏差范围时,随着信噪比的增加,假阴性率减小。在同一信噪比范围内,随着最大允许偏差范围的增加,假阴性率减小。在信噪比(3~15)范围内,共有33个数据,最大允许偏差为50%时,假阴性率为3.0%(1/33)。当信噪比≥3时,最大允许偏差为25%时,假阴性率为3.4%(219/6453)。具体见表5。
在质量浓度为LOD、2LOD、LOQ、2LOQ时,Lab1中4种药(毒)物的假阴性率见表6。当质量浓度≥2LOQ时,选择离子丰度比的相对偏差进行判定,假阴性率低于5%。
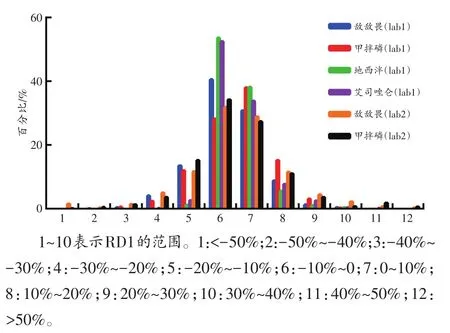
图8 加标血样离子丰度比RD1的分布

表5 加标血样中离子丰度比的最大允许偏差范围对假阴性率的影响 (%)
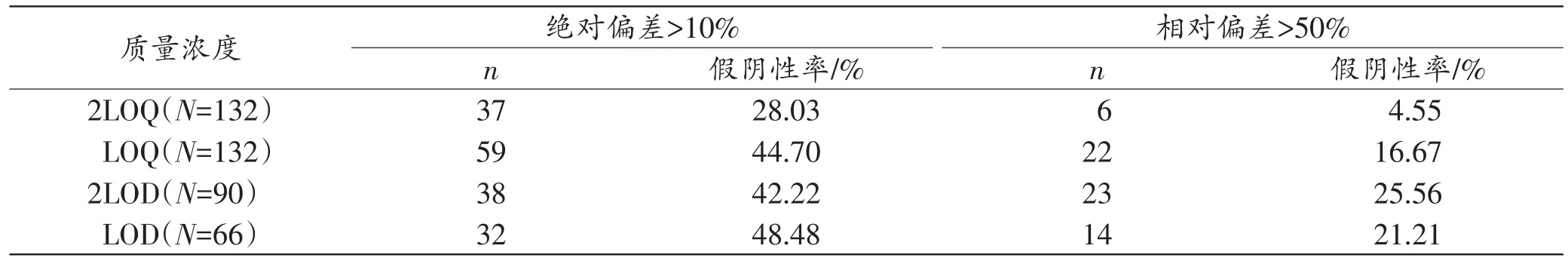
表6 低质量浓度时加标血样离子丰度比的假阴性率
2.4 假阳性率
本实验Lab1中191个空白血样均不满足保留时间判定的要求,故本实验的假阳性率为0。
3 讨 论
在国外的指南性文件中,离子丰度比的偏差是指待检样本特征离子的离子丰度比与同一批处理中标准物质[1-2,10-13]或空白添加标准物质[3-4,9]离子丰度比之间的差值,国内标准则定义为其与添加标准物质之间的差值[7-8,19]。本实验中,考虑到已知质量浓度的实际样本较少,同时实际样本的质量浓度是不可控的,不能满足整个实验所需的多个质量浓度点,而且如果采用添加样本,必须考虑回收率问题,质量浓度的控制就会出现一定的偏差,因此选择对血样提取后添加样本的离子丰度比与标准对照品的偏差来进行定性的最大允许偏差范围研究。
3.1 加标血样的离子丰度比偏差的判定
在法医毒物分析领域,最具有权威性的指南性文件有两个:一是《法庭毒物分析质量控制指南》[4],在此文件中对于相对偏差的判定就是采用典型的四段法,即离子丰度比越小,相对偏差越大;二是《法庭毒物分析实验室指南》[14],在这个文件中规定特征碎片的离子丰度比的相对判定指标为±20%,说明离子丰度比的相对偏差是相对独立的,与离子丰度比的大小无关。
3.2 加标血样的离子丰度比绝对偏差的判定
实际应用中很少有指南或者文件采用离子丰度比的绝对偏差来作为判定指标[9-10,13]。就本实验结果而言,当4种常见药(毒)物离子丰度比的相对偏差的判定范围从±10%增加到±20%时,阳性率并没有明显的改善。低质量浓度(质量浓度小于2LOQ)的D2较大,导致RD2的范围扩大。因此在分析生物样品中物质时,应尽量改进方法,浓缩物质的含量,否则在低质量浓度情况下易造成假阴性结果。因此,就本实验的仪器、药(毒)物而言,4种常见药(毒)物加标血样离子丰度比的绝对偏差设定在±10%的范围更加合理。
3.3 加标血样的离子丰度比相对偏差的判定
在本实验中,4种常见药(毒)物加标血样离子丰度比的相对偏差无论是相对参考值还是信噪比而言,都是相对独立的,不符合四段法的判定要求,更符合《法庭毒物分析实验室指南》[14]的定性判定要求。本实验结果在±25%内变化,比其规定稍大。只要特征碎片有足够的响应,就可以有一个稳定的离子丰度比和较小的相对偏差,而与特征离子自身离子丰度比的大小无明显关系。考虑在低质量浓度(质量浓度小于2LOQ)或低信噪比(3~15)情况下,只有选择相对偏差±50%的判定,假阴性率才会小于5%。
综合分析4种常见药(毒)物加标血样离子丰度比的偏差大小,发现与质量浓度和信噪比均有关系,建议4种常见药(毒)物加标血样离子丰度比绝对偏差的判定范围为±10%,相对偏差的判定范围为±25%,在低质量浓度(质量浓度小于2LOQ)或低信噪比(3~15)情况下,相对偏差应扩大为±50%。由于不同药物、不同型号仪器以及不同基质如尿液、毛发、肝组织等都可能会对实验结果造成影响,本实验结果仅针对本实验所用仪器及药物,因此,本研究存在一定的局限性,应进一步探讨,为法医毒物分析领域中物质的定性提供更全面、可靠的依据。

