响应面法优化平菇单核原生质体的制备及再生技术
孔维丽 崔筱 刘芹 袁瑞奇 段亚魁 康源春 孔维威 张玉亭

摘 要:为了提高平菇原生质体融合育种效率,本研究通过构建基于原生质体产量及单核原生质体再生率的响应面模型,优化平菇原生质体制备体系。以平菇菌株黑平16-1为试材,分别通过单因素试验考察菌丝菌龄(3~6 d)、酶液浓度(0.5%~2.0%)、酶解温度(28~34 ℃)和酶解时间(3~6 h)对原生质体制备及再生率的影响,并在单因素试验基础上,设计4因素3水平的响应面试验,建立各因素与响应值(原生质体产量和单核原生质体再生率)之间的数学模型,确定原生质体制备及单核原生质体再生的最佳提取工艺。结果表明,最佳提取工艺为菌龄4 d、酶液浓度1.51%、酶解温度28.3 ℃、酶解时间3.7 h,在此条件下平菇原生质体产量和单核原生质体再生率分别为(2.25±0.21)×107个·mL-1和(6.80±0.42)%,与模型预测值接近(2.27×107个·mL-1和6.83%),方程拟合度良好,该方法适用于对平菇原生质体的制备及单核原生质体再生条件的参数优化。
关键词:响应面法;平菇;原生质体产量;单核原生质体再生率;参数优化
中图分类号: S646.1+4 文献标识码: A DOI 编码:10.3969/j.issn.1006-6500.2019.12.002
Abstract: In order to improve the efficiency of Pleurotus ostreatus protoplast fusion breeding, a response surface model based on protoplast yield and mononuclear protoplast regeneration rate was constructed to optimize the protoplast preparation system of P. ostreatus. The effects of mycelium age (3~6 d), enzyme concentration (0.5%~2.0%), enzyme solution temperature (28~34 ℃) and enzymatic hydrolysis time (3~6 h) on protoplast preparation and regeneration rate was studied by using P. ostreatus strain Heiping 16-1 as material. On the basis of single factor experiment, the response surface test of 4 factors and 3 levels was designed, and the mathematical model between each factor and response value (protoplast yield and mononuclear protoplast regeneration rate) was established to determine the optimal extraction process of protoplast preparation and single nuclear protoplast regeneration. The results showed that the optimal extraction process was as follows: the mycelium age was 4 d, the enzyme solution concentration was 1.51%, the enzyme solution temperature was 28.3 °C, and the enzymatic hydrolysis time was 3.7 h. Under the above condition, the preparation rate of P. ostreatus protoplasts was(2.25±0.21)×107 cells·mL-1, and the regeneration rate of mononuclear protoplasts was (6.80±0.42)%, which was closed to the predicted value of the model(2.27×107 cells·mL-1, 6.83 %). In conclusion, the response surface equation was well fitted, and this method is suitable for the preparation of P. ostreatus protoplasts, and the parameter optimization of mononuclear protoplast regeneration conditions.
Key words: response surface method; Pleurotus ostreatus; protoplast yield; regeneration rate of mononuclear protoplast; parameter optimization of protoplast
真菌原生質体融合研究始于20世纪60年代,与常规育种相比,原生质体融合技术可以实现远缘杂交、扩大遗传物质的重组范围以及基因转化和定向诱变,产生更丰富的遗传变异,获得具有突出优良性状的新类型,在品种改良和选育工作中发挥了积极作用,为食用菌育种提供了有效的手段[1]。原生质体融合技术在香菇[2]、白灵菇[3]、金针菇[4-5]品种选育方面已经开始应用。原生质体再生、诱变、融合育种、转化育种、基因组重排以及基因组定向编辑技术均需以高产量和高再生率的原生质体为前提。原生质体单核化是平菇、凤尾菇、金针菇等异宗结合食用菌的菌丝体在原生质体制备过程中的一个普遍现象[6-7],是快速获得单核体杂交亲本的有效手段,这一技术将为食用菌育种研究开辟一条新途径,故优化原生质体制备和再生的条件十分必要[8]。由于酶液浓度、菌龄、酶解时间和酶解温度等因素对原生质体制备的影响各不相同,故在原生质体制备和再生中应综合考虑相关因素,寻求最佳制备条件[9]。
响应面法(Response Surface Methodology,RSM)是利用合理的试验设计方案,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析优化工艺参数,测响应值的一种统计方法[10-11]。响应面法能快速有效地确定试验过程中的最佳条件,且可对各因子及其交互作用进行评价,被广泛应用于发酵[12]、食品[13]、药品[11]中各成分的提取和工艺设计[14]及食用菌多糖[15]提取工艺的研究。
本研究以提高平菇菌丝原生质体产量及单核再生率为目标,应用响应面法优化其制备条件,为研究平菇原生质体融合育种和遗传转化奠定基础。
1 材料和方法
1.1 试验材料
供试菌株:黑平16-1,由河南省农业科学院植物营养与资源环境研究所选育。
溶壁酶购于sigma公司,蔗糖购于国药集团,硫酸镁、柠檬酸钠、山梨醇等试剂菌购于天津科密欧有限公司。
P-buffer:0.6 mol·L-1的缓冲渗稳剂。称取硫酸镁39.35 g,柠檬酸三钠11.76 g,用蒸馏水定容至200 mL后调至pH=5.5,灭菌后备用。
STC:称取山梨醇18.21 g,二水合氯化钙0.735 g,加入到80 mL蒸馏水中溶解后加入1 mol·L-1 Tris-HCl(pH=8.0)5 mL, 定容至100 mL,灭菌备用。
PD综合液体培养基:马铃薯200 g,葡萄糖20 g,蛋白胨2 g,磷酸二氢钾1 g,硫酸镁0.5 g,加水定容至1 000 mL。
再生培养基:PDA培养基内添加0.6 mol·L-1甘露醇。
1.2 方 法
1.2.1 菌丝体的制备 PDA培养基上培养6~7 d的平菇菌丝接种到PD综合液体培养基中,在25 ℃,150 r·min-1摇床中培养3~5 d,过滤收集菌丝备用。
1.2.2 酶液的制备 称取酶制剂溶于P-buffer中,并用0.25 μm微孔过滤膜过滤除菌,配制成相应浓度酶液。
1.2.3 原生质体的制备 将液体培养的菌丝用5层无菌擦镜纸过滤,吸干水分,按照菌丝质量与酶液1∶10的比例混合,将三角瓶置于摇床中酶解3~6 h,酶解温度30~36 ℃,将酶解后的液体过滤到无菌离心管中,充分混匀,于4 000 r·min-1,4 ℃离心10 min,弃上清。加入10 mL STC溶液充分混匀,洗涤2次,于4 000 r·min-1,4 ℃离心10 min,弃上清后再加入10 mL STC溶液充分悬浮,每个处理重复3次,在显微镜下镜检原生质体,并用血球计数板进行计数。
1.2.4 单核原生质体的再生 原生质体悬浮液稀释至5×103个·mL-1,吸取100 μL,涂布于再生培养基,25 ℃培养5~7 d,原生质体萌发后,挑取单菌落于新的培养皿,插片培养,显微镜检,计算单核原生质体的再生率,每个处理重复3次,单核原生质体再生率(%)=(再生培养基长出的菌落-PDA培养基长出的菌落-双核菌落数量)/涂布的原生质体×100。
1.2.5 原生质体制备、单核原生质体再生条件的单因素试验 在原生质体制备过程中分别考察不同菌龄(3~6 d)、不同的溶壁酶浓度(0.5%~2.0%)、不同的酶解时间(3~6 h),不同的酶解温度(28~34 ℃)对原生质体产量及单核原生质体再生率的影响。
1.2.6 原生质体制备及单核原生质体再生的响应面试验 在单因素试验的基础上,以菌丝菌龄、酶液浓度、酶解时间和酶解温度4个因素为自变量,以原生质体产量和单核原生质体再生率为响应值,设计4因素3水平的响应面分析试验。
1.3 数据统计与分析
采用Design-Expert7.0软件进行响应面试验设计、分析及制图。
2 结果与分析
2.1 单因素试验
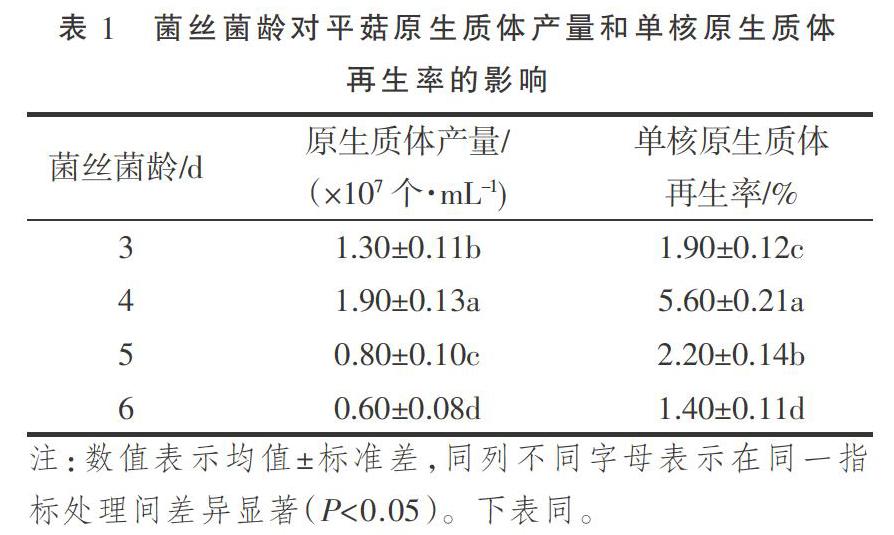
2.1.1 菌丝菌龄 由表1可知,当酶液浓度1.5%、酶解时间4 h、酶解温度30 ℃时,随菌丝菌龄即菌丝培养时间的延长,原生质体的产量和单核原生质体的再生率先增加后降低,均于菌龄4 d时达到峰值,原生质体释放量最大。方差分析结果表明,在相同酶液浓度、酶解时间、酶解温度,不同菌丝菌龄对平菇原生质体产量及单核原生质体再生率影响均达到显著水平(P<0.05)。
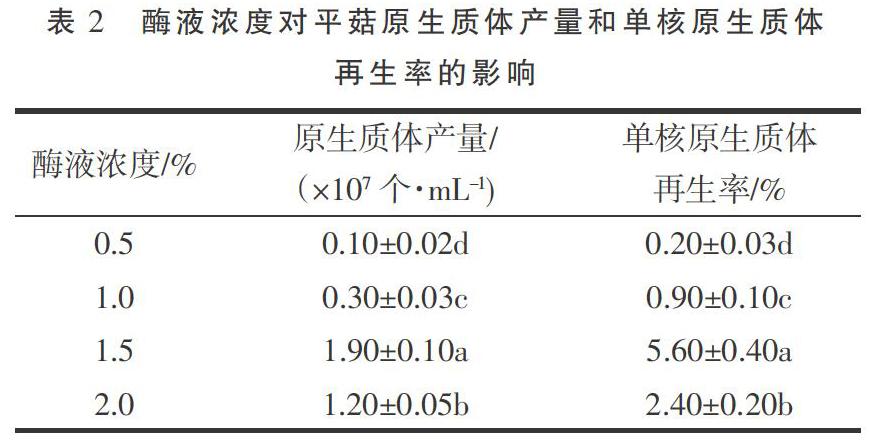
2.1.2 酶液浓度 由表2可知,当酶解时间3 h、菌丝菌龄4 d、酶解温度30 ℃时,随酶液浓度的增加,原生质体产量及单核再生率呈先增加后减少的趋势,均于酶液浓度为1.5%时达到峰值。方差分析结果表明,在相同酶解时间、菌丝菌龄、酶解温度,不同酶液浓度对平菇原生质体产量及单核原生质体再生率影响均达到显著水平(P<0.05)。
2.1.3 酶解温度 由表3可知,当酶液浓度1.5%、酶解时间4 h、菌丝菌龄4 d时,随酶解温度的增加,原生质体产量及单核再生率呈先增加后减少的趋势,二者均于酶解温度为30 ℃时达到峰值。方差分析结果表明,在相同酶液浓度、酶解时间、菌丝菌龄,不同酶解温度对平菇原生质体产量和单核原生质体再生率的影响均达到显著水平(P<0.05)。
2.1.4 酶解时间 由表4可知,当酶液浓度1.5%、菌丝菌龄4 d、酶解温度30 ℃时,随酶解时间的延长,原生质体产量及单核再生率呈先增加后减少的趋势,均于酶解时间为4 h时達到峰值。分析其原因,如果酶解时间太短,原生质体释放不完全,而酶解时间太长,新的原生质体不再释放或释放量少,而早期释放的原生质体却不断破裂,这样原生质体的量不但不会增加,反而会减少。方差分析结果表明,在相同酶液浓度、菌丝菌龄、酶解温度,不同酶解时间对平菇原生质体产量和单核原生质体再生率的影响均达到显著水平(P<0.05)。
2.2 响应面试验
运用响应面试验分析酶液浓度、酶解时间、培养时间、酶解温度这4个因素(表5)对原生质体产量及单核原生质体再生率的影响,对试验数据(表6)进行多元回归拟合,获得平菇原生质体产量和单核原生质体再生率与各因素变量的二次多项回归方程模型。
平菇原生质体产量与各因素变量的二次多项回归方程模型:
Y(1)原生质体产量=-553.597+44.489 16×A+16.886 74×B+16.886 74×C+29.837 05×D-1.117 61×A×B- 1.192 03×A×C-0.175 00×A×D-0.325 00×B×C-0.075 000×B×D-0.112 50×C×D-9.726 9×A2-2.179 73×B2-1.323 63×C2-0.480 41×D2
平菇原生质体再生率与各因素变量的二次多项回归方程模型:
Y(2)单核原生质体再生率= 1.90+0.25×A-0.100×B-0.033×C+0.050×D-0.23×A×B-0.38×A×C-0.100×A×D+0.075×B×C+0.100×B×D-0.050×C× D-0.65×A2-0.60×B2-0.48×C2-0.70×D2
式中,Y(1)原生质体产量为原生质体产量(×107个·mL-1);
Y(2)原生质体再生率为原生质体再生率(%);A为酶液浓度(%);B为菌丝菌龄(d);C为酶解时间(h);D为酶解温度(℃)。
2.2.1 回归方程的方差分析 平菇原生质体产量及单核原生质体再生率与酶液浓度、菌丝菌龄、酶解时间和酶解温度4因素变量的二次拟合方程的方差分析结果(表7)表明,本试验选用的二阶模型具有统计学意义,其显著性均表现为P<0.000 1,说明所建模型Y(1)原生质体产量和Y(2)单核原生质体再生率均与实际情况拟合度良好,能够反映平菇原生质体产量及单核原生质体再生率与4因素之间的关系;校正决定系数[R2(adj)]分别为0.911 5和0.887 5,且失拟项差异均不显著(P>0.05),即模型分别能解释试验所选择4个变量对响应值影响的91.15%和88.75%,说明该模型条件能够很好地反映实际值,其他影响因素对平菇原生质体产量的影响很小;模型的决定系数(R2)分别0.955 7和0.943 8,表明回归模型相对于纯误差失拟不显著(P>0.05),试验误差小。综合说明,此二次回归方程模型可用于平菇原生质体制备产量及再生率的分析与预测。
根据F值(表7)大小可以判断,4个因素对平菇原生质体产量[Y(1)原生质体产量]影响程度表现为:酶液浓度(A)>菌丝菌龄(B)>酶解时间(C)>酶解温度(D),其中A、B、AB、AC及二次项 A2、B2、C2、D2均为显著影响因素(P<0.05),说明酶液浓度(A)与菌丝菌龄(B)和酶解时间(C)在对平菇原生质体产量的影响上均存在显著的交互作用(P<0.05);4个因素对平菇单核原生质体再生率[Y(2)单核原生质体再生率]的影响表现为酶液浓度(A)>菌丝菌龄(B)>酶解温度(D)>酶解时间(C),其中A和AC及二次项A2、B2、C2、D2均为显著影响因素(P<0.05),说明酶液浓度(A)与酶解时间(C)在对平菇单核原生质体再生率的影响上存在显著的交互作用(P<0.05)。
2.2.2 各因素交互作用的响应面分析 对二次回归方程Y(1)原生质体产量和Y(2)单核原生质体再生率中存在显著交互作用的因素绘制响应面图(图1~图3),图中曲面的陡峭程度可以表明变量对因变量(平菇原生质体产量和单核原生质体再生率)的影响程度,响应值呈抛物线形趋势,因此回归方程有极大值。
2.2.3 验证试验 通过Design Expert 7.0软件的Optimization Numerical模块对试验结果数值分析,确定平菇原生质体产量最高的制备工艺为酶液浓度1.51%、菌龄3.79 d、酶解时间 3.72 h、酶解温度28.27 ℃,此条件下由公式Y(1)原生质体产量计算平菇原生质体产量的理论值为2.27×107 个·mL-1,由公式Y(2)单核原生质体再生率计算单核原生质体的再生率为6.83%。
为方便实际操作将酶解温度定为28.3 ℃,菌丝菌龄4 h,在此条件下进行平菇原生质体制备, 3个重复。结果表明,平均原生质体产量为(2.25±0.21)×107个·mL-1,变异系数为9.33%;平均单核原生质体再生率为(6.8±0.42)%,变异系数为6.18%,测定数据稳定,试验结果可靠,说明二次多项回归方程模型Y(1)原生质体产量、Y(2)单核原生质体再生率具有一定的实际预测性。
3 结论与讨论
原生质体制备与再生过程中产生单核原生质体和双核原生质体,双核原生质体保持亲本菌株的性状,而单核原生质体只有亲本的一半遗传信息,常用于易宗结合菌类育种,特点是萌发较晚[16]。Wessels[17]对裂褶菌原生质体的制备与再生中发现再生菌丝中双核体约占60%~80%,而单核体只有20%~40%,不同金针菇品种单核化率从27.7%~86.5%。单核原生质体作为一个重要的遗传材料,为食用菌的育种研究开辟了一条新途径。因此如何从菌丝处理方式、品种等方面提高单核原生质体的制备率具有重要意义。本试验以单核原生质体再生率为主要目标,菌丝体经过研磨处理,通过单因素试验发现,菌丝菌龄、酶液浓度、酶解时间、酶解温度对食用菌菌丝体原生质体产量及单核原生质体再生率的影响均显著(P<0.05)。
不同类型的食用菌其原生质体及原生质体再生率高产的条件差异较大,根据已有的研究,总结草菇、白灵菇、大球盖菇和金针菇的最适制备条件,详见表8。本研究在单因素试验基础上,通过响应面试驗优化了评估平菇原生质体的制备及单核原生质体再生条件,即酶液浓度1.51%、菌丝菌龄4 d、酶解时间3.7 h、酶解温度28.3 ℃,该条件下平菇原生质体产量为(2.25±0.21)×107个·mL-1,单核原生质体再生率为(6.8±0.42)%,与响应面法获得的二次多项回归方程模型预测值(2.27×107个·mL-1,6.83%)接近。
参考文献:
[1]张淑君,李伟庆,牟志美,等.应用原生质体融合技术构建纤维素发酵产油脂菌株的试验[J].蚕业科学,2017,43(2):296-303.
[2]潘迎捷,陈明杰,汪昭月.香菇菌丝原生质体的分离与培养[J].上海农业学报,1989,5(1):25-30.
[3]朱坚,张鹏.白灵菇原生质体制备条件的优化[J].中国农学通报2011,27(25):153-157.
[4]江玉姬,谢宝贵,吴文礼.金针菇的原生质体单核化[J].福建农业大学学报,2001,30(1):44-47.
[5]陈鹏,郭成金.金针菇原生质体制备和再生探究[J].江苏农业科学,2014,42(9):200-204.
[6]潘迎捷,张树庭.异宗结合食用菌的原生质体单核化[J].上海农业学报,1993(5):10-11.
[7]吕作舟.食用真菌基因工程实验技术[J].中国食用菌,1992,11(1):13.
[8]王金斌,李文,张俊沛,等.草菇原生质体制备、再生条件的响应面法优化及诱变效应[J].分子植物育种,2017,15(10):4110-4119.
[9]任轩,贾乐,杨凤苓.食用菌原生质体融合育种研究进展[J].生物技术通报,2008,41(2):42-44.
[10]赵强,余四九,王廷璞,等.响应面法优化秃疮花中生物碱提取工艺及抑菌活性研究[J].草业学报,2012,21(4):206-214.
[11]许俊齐,曹正,谢春芹,等.模糊综合评判及响应面法优化黑皮鸡枞菌曲奇的加工工艺[J/OL].现代食品科技,[2019-10-30].http://kns.cnki.net/kcms/detail/44.1620.TS.20191029.1147.008.html.
[12]李姝江,王淋敏,谯天敏,等.利用响应面法优化贝莱斯芽孢杆菌ZJ20发酵参数[J].西北农林科技大学学报(自然科学版),2019,47(2):88-95.
[13]杨文雄,高彦祥.响应面法及其在食品工业中的应用[J].中国食品添加剂,2005(2):68-71.
[14]周鑫,孙海龙,张泽乾.响应面法在污水处理工艺优化中的应用[J].化学研究与应用,2017,29(6):753-760.
[15]万阅,齐计,英曾红,等.响应面法优化香菇多糖的超声辅助提取工艺[J].生物技术通报,2015,31(1):79-85.
[16]丛倩倩,崔晓,王庆武.灵芝原生质体单核菌株的制备及形态特性比较[J].食用菌,2019,41(2):34-36.
[17]WESSELS D G. Wall structure, wall degradation, protoplast liberation and wall regeneration in Schizophyllum commune[C]// Yeast mould and plant protoplasts. London: Academic press, 1973: 295-306.
[18]王金斌,李文,張俊沛,等.草菇原生质体制备、再生条件的响应面法优化及诱变效应[J].分子植物育种,2017,15(10):4110-4119.
[19]刘文芳,郭成金.白灵菇原生质体制备与再生研究[J].天津师范大学学报(自然科学版),2012,32(1):88-92.
[20]许梅,胡顺珍,贾乐.大球盖菇原生质体制备与再生条件研究[J].生物技术,2006(6):57-60.
[21]陈鹏,郭成金.金针菇原生质体制备和再生探究[J].江苏农业科学,2014,42(9):200-204.

