PKCα/CaV1.2在有氧运动改善高血压肠系膜动脉功能中的作用
单美玲,陈 渝,张严焱,周 杨,吴 迎,2,李 丽,石丽君,2*
(1.北京体育大学 运动生理教研室,北京 100084;2.北京体育大学 运动与体质健康教育部重点实验室,北京 100084)
高血压是多种心、脑血管疾病的重要病因和危险因素,迄今为止,仍是心血管疾病导致死亡的主要原因之一(NHBPEP,2003)。高血压往往伴随着小动脉和微动脉血管张力的不断增加、血管舒张功能紊乱及血管收缩特性的改变等(Brozovich et al.,2016)。在血管张力调节方面,除机体的神经-体液途径外,血管平滑肌也可通过其膜上的相关离子通道活动对血管收缩进行调控,从而参与调节血管张力(张严焱等,2018)。研究表明,当血管长期处于高血压状态时,血管平滑肌上的离子通道会发生功能重构,从而影响血管张力(Harder et al.,1983),其中,钙离子通道在调节血管平滑肌细胞(vascular smooth muscle cell,VSMC)内钙水平、细胞收缩和舒张以及血管张力中都起到了重要作用(Joseph et al.,2013)。
L型电压门控钙离子通道(voltage-gated L-type Ca2+channel,CaV1.2)是VSMC膜外钙离子内流的主要通道,是血管平滑肌收缩的主要机制,其对血管平滑肌功能具有重要的调节作用。除Ca2+依赖性的肌球蛋白轻链磷酸化外,血管平滑肌功能还主要受蛋白激酶C(protein kinase C,PKC)调控(Pourmahram et al.,2008)。血管平滑肌中PKC过表达或是活性增加,可导致血管收缩功能紊乱,使得微血管阻力不断增加,最终导致高血压(Khalil et al.,2013;Lacerda et al.,1988)。研究表明,PKC的磷酸化可参与控制细胞内钙的流入和排出,PKC可增强各种平滑肌细胞中的CaV1.2电流,如肺动脉、脑动脉等(Perzvizcaino et al.,2010)。但也有研究报道,PKC对CaV1.2通道的功能具有双重调节作用,这种双重调节作用可能与PKC在不同组织中表达的亚型不同有关(Sharon et al.,2015)。PKCα(protein kinase Cα,PKCα)为Ca2+依赖性的经典型PKC亚型,广泛表达于血管平滑肌中。高血压时,血管平滑肌中PKCα表达增多。PKCα可通过肌球蛋白轻链磷酸化、Ca2+通道激活或K+通道抑制等参与血管平滑肌收缩(Ringvold et al.,2016)。在离体肺动脉的实验中发现,H2O2诱导的PKC活化可激活血管平滑肌上的CaV1.2通道,同时H2O2诱导的Ca2+敏感性和血管收缩增强等主要与PKCα亚基有关,而这些反应均可被PKCα抑制剂所抑制(Park et al.,2006)。综上所述,PKCα与CaV1.2通道功能可能存在一定的调控关系。
前期研究表明,有氧运动可有效降低自发性高血压大鼠(spontaneously hypertensive rat,SHR)血压,改善血管功能,这可能与膜上的离子通道有关(张严焱等,2018)。血管平滑肌CaV1.2通道功能上调是高血压的一个标志性特征,而有氧运动可有效改善高血压诱发的CaV1.2通道功能上调(陈渝 等,2015;鲁妮 等,2015)。但有氧运动调节CaV1.2通道功能的潜在机制尚不完全清楚,PKC对高血压大鼠VSMC的CaV1.2通道功能作用及其具体发挥作用的亚型尚不明确,有氧运动能否通过PKCα/CaV1.2信号通路调节SHR肠系膜动脉功能,目前尚无文献报道。
因此,本研究旨在探究PKCα与CaV1.2通道之间的关系;观察原发性高血压时,肠系膜动脉平滑肌细胞中的PKCα、CaV1.2通道α1C亚基表达、分布及二者共定位情况,PKCα/CaV1.2在血管张力调节中的作用,从而进一步探究PKCα/CaV1.2信号通路在有氧运动改善高血压肠系膜平滑肌功能中的作用。
1 材料与方法
1.1 实验动物与运动方案
SHR和正常血压大鼠对照组(Wistar Kyoto,WKY)各24只(12周龄,雄性),随机分为有氧运动组(SHR-EX、WKY-EX)和安静对照组(SHR-SED、WKY-SED),每组各12只。大鼠分笼饲养,用国家标准啮齿类动物饲料喂养,实验动物自由饮食,控制饲养环境温度(22℃~24℃)、相对湿度(40%~60%)和光照(12 h昼,12 h夜)。有氧运动组先进行适应性训练1周,随后进行12周中等强度的跑台运.动。运动方案:坡度为0,20 m/min(相当于55%~65%VO2max),60 min/天,5 天/周,每周测定各组大鼠体重(BW),尾动脉无创血压测试仪(BP-2010A,Softron Biotechnology)监测安静时收缩压(SBP)、心率(HR)。
1.2 离体微血管环制备和张力测定
腹腔注射戊巴比妥钠(50 mg/kg)将大鼠麻醉后,迅速打开腹腔,取3级肠系膜动脉,在Na-HEPES溶液中将血管周围的脂肪组织仔细剥离干净,随后将血管剪成4个5 mm左右的小段,并将其固定于微血管张力测定仪(Multiwire myograph system-620M,DMT,Denmark)的4个浴槽中等待进行血管收缩特性的测定。在整个剥离和固定过程中避免对血管的过度牵拉。在预先孵育20 min非选择性NOS抑制剂Nω-硝基L-精氨酸甲酯(L-NAME,100 μmol/L)的基础上,测定各组肠系膜动脉对BayK8644(CaV1.2通道激动剂)、Nifedipine(CaV1.2通道抑制剂)、PDBu(PKC激动剂)、Gö6976(PKCα抑制剂)的张力反应。
1.3 急性分离肠系膜动脉平滑肌细胞
采用急性酶分离方法获取VSMC。取2级以下肠系膜动脉,于分离液中将动脉周围的脂肪组织剥离干净,并将其剪至1~2 mm左右的均匀小段。分离液组成成分(mmol/L):137 NaCl、5.6 KCl、1 MgCl2、10 HEPES、10 Glucose、0.42 Na2HPO4、0.44 NaH2PO4、4.2 NaHCO3,用 NaOH将pH值调至7.3。待血管段静置3~5 min后,将其在酶消化液中消化28~30 min,随后在室温下用分离液清洗3次以终止消化,每次静置3~5 min。消化液组成成分(mg/ml):2牛血清白蛋白(BSA)、4木瓜蛋白酶(Papain)、1二硫苏糖醇(DTT)。最后用胶头滴管吹打血管段20~25次,并用滤网将悬液中的VSMC过滤至实验用浴槽中,于4℃冰箱中贴壁待用。整个消化过程均在37℃恒温水浴箱中完成。
1.4 全细胞电流记录
采用全细胞电压钳模式记录CaV1.2通道电流。实验前,将装有VSMC的浴槽内的分离液换成细胞外液。细胞外液组成成分(mmol/L):20 BaCl2、10 HEPES、5 Glucose、1 MgCl2、124 choline chloride,用 CsOH 将pH值调至7.4。电极内液组成成分(mmol/L):130 CsCl、10 HEPES、3 Na2ATP、0.1 Na2GTP、1.5 MgCl2、10 Glucose、10 EGTA、0.5 MgATP,用CsOH将pH值调至7.3。电极电阻为5~6 MΩ,串联电阻在10 MΩ以下。血管平滑肌细胞置于-40 mV钳制电压,检测电压为-30~+40 mV,阶跃电位为10 mV,持续时间为250 ms。所测的电流信号经Axon 700B放大器放大。观察比较CaV1.2通道基础电流以及加入Gö6976后,各组肠系膜动脉VSMC的CaV1.2通道电流变化。
1.5 免疫荧光
肠系膜动脉急性分离VSMC,室温贴壁30 min后,4%多聚甲醛固定30 min,随后用PBS溶液清洗3遍,用0.2%Triton X-100穿孔10 min,再用10%山羊血清封闭60 min,分别加入一抗Polyclonal Anti-CaV1.2(浓度为1:200)、Anti-PKCα(浓度为1:200)。随后将细胞置于4℃冰箱中过夜,第2天在避光条件下加二抗Goat Anti-Rabbit IgG Antibody(浓度为1:1 000),并在室温下孵育60 min,随后采用Prolong Gold Antifade Mount ant抗淬灭封片剂进行封片,于室温、干燥条件下保存24 h后,采用激光共聚焦系统(SP8 TCS,Leica,Germany)采集 PKCα、CaV1.2α1C 信号。免疫荧光数据采用LAS X软件进行共定位分析,得到共定位系数(colocalization rate),采用ImageJ软件分离出共定位区域。
1.6 数据处理与分析
实验数据均以平均数±标准误(M±SEM)表示,采用统计学软件SPSS 22.0进行双因素方差分析(two-way ANOVA,高血压×运动)。P<0.05,表示有显著性差异。
2 结果
2.1 有氧运动对高血压大鼠体重、血压、心率的影响
运动前各组大鼠体重、血压和心率测定结果显示(表1),WKY-EX与SHR-EX在体重、收缩压和心率上与其各自安静对照组相比,均无显著性差异(P>0.05),SHR-SED组体重显著低于WKY-SED组(P<0.05);而SHR-SED组收缩压、心率均显著高于WKY-SED组(P<0.05)。12周有氧运动后,在体重方面,与其各自的安静对照组相比,WKY-EX、SHR-EX组均显著降低(P<0.05),SHR-SED组体重仍显著低于WKY-SED组(P<0.05)。血压方面,SHR-SED组收缩压显著高于WKY-SED组(P<0.05),而与WKY-SED组相比,WKY-EX组收缩压显著降低(P<0.05);与SHR-SED组相比,SHR-EX组收缩压也显著降低(P<0.05)。心率方面,SHR-SED组心率显著高于WKYSED组(P<0.05),而与SHR-SED组相比,SHR-EX组心率显著降低(P<0.05),WKY-EX与WKY-SED组间无显著性差异。提示,有氧运动可有效降低高血压大鼠的血压、心率和体重。
2.2 有氧运动对SHR肠系膜动脉收缩特性的影响
用60 mmol/L KCL诱导血管呈最大收缩即Kmax(图1A)。其他药物引起的收缩或舒张程度均与Kmax相比,并表示为%Kmax。如图1B所示,KCL诱导的各组肠系膜动脉的最大收缩幅度均无显著性差异(P>0.05)。

表1 有氧运动对WKY和SHR体重、血压、心率的影响Table 1 Effects of Aerobic Exercise on Body Weight,Blood Pressure and Heart Rate in WKY and SHR

图1 KCL诱导的各组肠系膜动脉的张力反应Figure 1.Tension Response of Mesenteric Arteries Induced by KCL
2.2.1 有氧运动对BayK8644诱发的肠系膜动脉收缩反应的影响
由于CaV1.2通道在血管张力调节中的重要作用,我们首先采用离体微血管环张力测定CaV1.2通道在肠系膜动脉张力调节中的作用。预先孵育20 min L-NAME(100 μmol/L)以破坏内皮型一氧化氮合酶(eNOS)的作用,随后加入CaV1.2通道激动剂BayK8644(10-5M),观察各组肠系膜动脉的收缩反应(图2A)。结果如图2B所示,BayK8644可诱发各组肠系膜动脉收缩。与WKY-SED组(25.6±5.6%Kmax)相比,SHR-SED 组(63.7±11.0%Kmax)肠系膜 动脉对BayK8644的收缩反应显著增高(P<0.05)。与SHR-SED组相比,SHR-EX组(46.2±8.6%Kmax)肠系膜动脉收缩反应明显降低(P<0.05);同时,12周有氧运动后,WKY-EX组(38.2±6.6%Kmax)血管对 BayK8644的收缩反应较WKY-SED组显著增高(P<0.05),各组n=6。结果提示,高血压可增强肠系膜动脉对BayK8644的收缩反应(P<0.05),而有氧运动可有效减弱SHR-EX对BayK8644的收缩反应(P<0.05)。同时,有氧运动还增强了WKY对BayK8644的收缩反应(P<0.05)。
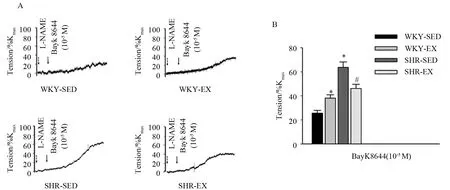
图2 BayK8644诱导的各组肠系膜动脉的张力反应Figure 2.Tension Response of Mesenteric Arteries Induced by BayK8644
2.2.2 有氧运动对Nifedipine诱发的肠系膜动脉舒张反应的影响
去甲肾上腺素(NE)可诱发各组血管收缩,在NE诱发的最大收缩张力中,SHR-SED组显著高于WKY-SED组(P<0.05),而SHR-EX组与SHR-SED组相比显著减小(P<0.05)。CaV1.2通道特异性抑制剂Nifedipine可诱发各组肠系膜动脉呈浓度依赖性舒张。如图3A所示,NE诱发的收缩出现平台期后,递增浓度的Nifedipine(10-8~10-5M)可诱发血管舒张。在Nifedipine诱导的各组血管最大舒张反应中,SHR-SED组显著高于WKY-SED(P<0.05),而与SHR-SED组相比,SHR-EX对Nifedipine的舒张反应显著降低(P<0.05)。如图3B所示,在各组肠系膜动脉对Nifedipine的敏感性中,SHR-SED组(pIC50:6.78±0.15)显 著 高 于 WKY-SED 组(pIC50:5.84±0.26)(P<0.05),与 SHR-SED 组相比,SHR-EX 组(pIC50:6.38±0.22)对Nifedipine的药物敏感性显著降低(P<0.05),而WKY-EX组(pIC50:6.00±0.19)与WKY-SED组间无显著性差异(P>0.05),各组n=6。结果提示,高血压时,肠系膜动脉对Nifedipine的敏感性增强;有氧运动可减弱SHR对Nifedipine的敏感性。
2.2.3 有氧运动对Gö6976诱发的肠系膜动脉舒张反应的影响
PKCα抑制剂Gö6976可诱导各组肠系膜动脉的浓度依赖性舒张(图4A)。其中,SHR-SED组肠系膜动脉的最大舒张反应显著高于WKY-SED组(P<0.05);而与SHRSED组相比,SHR-EX组血管的最大舒张反应显著降低(P<0.05),但WKY-EX组与WKY-SED组相比,两者无显著性差异(P>0.05)。如图4B所示,在各组肠系膜动脉对Gö6976的敏感性中,SHR-SED组(pIC50:5.95±0.12)显著高于WKY-SED组(pIC50:5.47±0.21)(P<0.05),与SHRSED组相比,SHR-EX组(pIC50:5.71±0.11)对Gö6976的药物敏感性显著降低(P<0.05),而WKY-EX组(pIC50:5.61±0.15)与WKY-SED组间无显著性差异(P>0.05),各组n=6。结果提示,高血压时,血管对Gö6976的敏感性显著增强,而有氧运动可有效减弱SHR对Gö6976的敏感性。
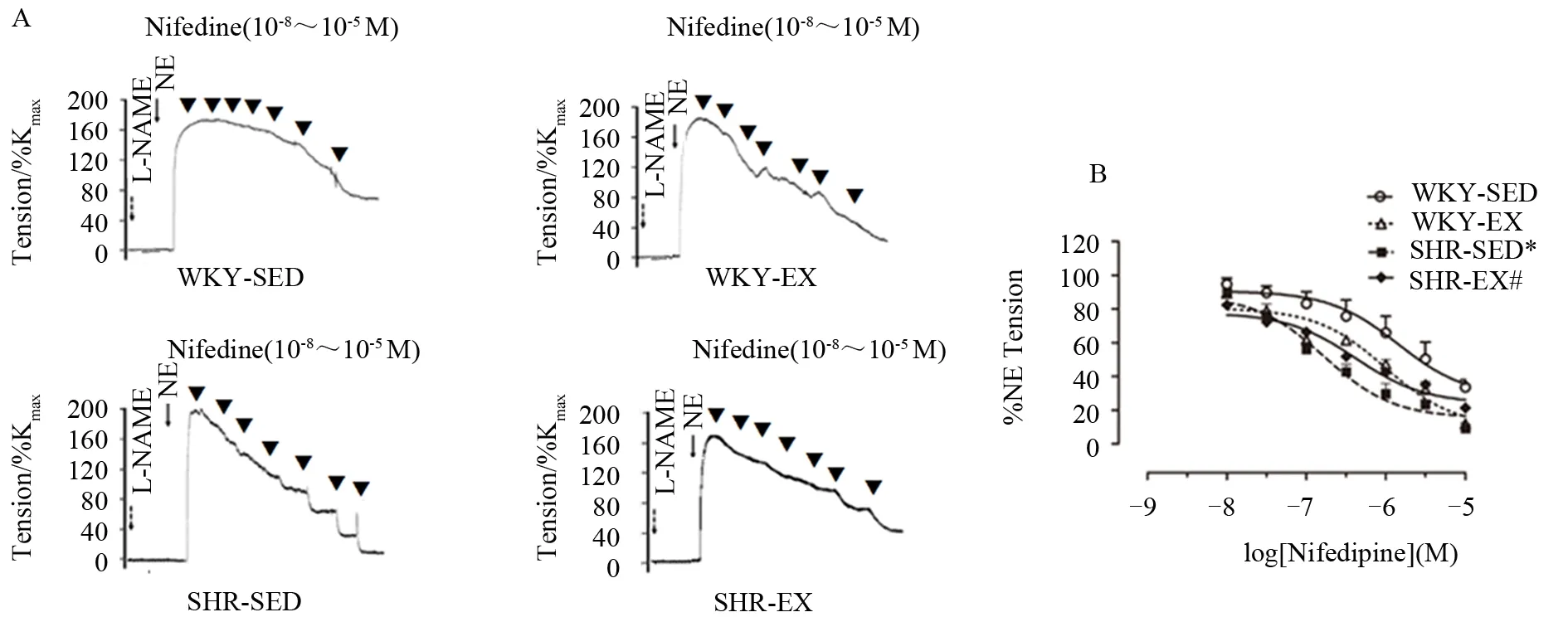
图3 各组肠系膜动脉对Nifedipine的张力反应Figure 3.Tension Response of Mesenteric Arteries to Nifedipine in Each Group

图4 递增浓度的Gö6976对各组肠系膜动脉张力的影响Figure 4.Effect of Incremental Concentrations of Gö6976 on Mesenteric Artery Tension in Each Group
2.3 PKCα对CaV1.2通道功能的影响
2.3.1 PKCα在调节血管张力中的作用
如图5Aa所示,PKC激动剂PDBu可诱使肠系膜动脉收缩,使血管张力增加。SHR-SED组血管张力增加幅值显著高于WKY-SED组(P<0.05);与SHR-SED组相比,SHR-EX组对PDBu诱发的血管张力反应显著降低(P<0.05)。同时,与WKY-SED组相比,WKY-EX组对PDBu诱发的血管张力反应显著增高(P<0.05)。在PDBu后加入CaV1.2通道抑制剂Nifedipine发现,各组血管均呈现出浓度依赖性的舒张,这表明,PKC在高血压血管收缩功能调节中占据重要地位,CaV1.2通道在其中发挥了重要作用。
为明确PKCα在其中的作用,我们采用PKCα抑制剂Gö6976孵育血管10 min,在抑制PKCα活性后加入PDBu诱发各组肠系膜动脉收缩,随后加入Nifedipine,观察各组肠系膜动脉的舒张反应,从而进一步探究PKCα在高血压时血管张力调节中的作用以及CaV1.2通道在其中的贡献(图5Ab),各组n=6。结果如图5B、5C所示,与直接加入PDBu相比,各组大鼠肠系膜动脉在预先孵育Gö6976后,PDBu诱发各组肠系膜动脉的收缩反应降低,与其各自安静对照组相比,WKY-EX、SHR-EX对PDBu诱发的收缩反应均无显著性差异(P>0.05);加入Nifedipine后各组血管舒张程度也变小,其中SHR-SED组血管张力仍显著高于WKY-SED组(P<0.05),但WKY-EX、SHR-EX与其各自对照组相比,加入Nifedipine后,各组血管张力变化均无显著性差异(P>0.05)。以上结果提示,PKCα在高血压肠系膜动脉张力调节中具有重要作用,PKCα可通过调控CaV1.2通道功能来调节高血压肠系膜动脉的舒缩功能。

图5 PKCα对CaV1.2通道功能的影响Figure 5.Effects of PKCα on CaV1.2 Channel Functionality
2.3.2 PKCα对CaV1.2通道电流的影响
为进一步探究PKCα对CaV1.2通道功能的调节作用,采用全细胞电压钳模式记录Gö6976对CaV1.2通道电流的影响。本实验中,各组间肠系膜动脉平滑肌细胞的膜电容均无显著差异(P>0.05)。在未加药前的基础电流(control)中,与 WKY-SED 组(-8.2±1.2 pA/pF,n=28)相比,WKY-EX组(-10.0±1.1 pA/pF,n=30)、SHR-SED组(-13.9±1.5 pA/pF,n=33)的CaV1.2通道电流幅值均显著增高(P<0.05),而与SHR-SED组相比,SHR-EX组(-10.7±1.3 pA/pF,n=29)的CaV1.2通道电流幅值显著降低(P<0.05,图6A)。这提示,高血压时,CaV1.2通道电流幅值增加,而有氧运动可有效地降低其增加幅度,同时增加WKY-EX组CaV1.2通道电流。这与本实验室前期的研究结果一致(陈渝等,2015)。Gö6976可诱使肠系膜动脉平滑肌细胞CaV1.2通道电流密度显著降低(图6B)。将加Gö6976后的各组CaV1.2通道电流与基础电流相比,计算其电流幅值降低程度并以%control表示。其中,WKYSED 组(20.4±3.7%control,n=14)与 WKY-EX 组(29.2±3.1%control,n=16)间无显著性差异(P>0.05);与 WKYSED组相比,SHR-SED组(41.0±3.4%control,n=17)CaV1.2通道电流幅值降低幅度显著增大(P<0.05);与SHR-SED组相比,SHR-EX组(32.3±3.0%control,n=15)CaV1.2通道电流幅值降低幅度显著减小(P<0.05)。n表示细胞个数,每组均来源于6只实验动物。结果提示,Gö6976可调节CaV1.2通道功能,抑制CaV1.2通道电流;高血压可增加SHR肠系膜动脉平滑肌细胞CaV1.2通道对Gö6976的敏感性,而有氧运动可以有效地降低SHR对Gö6976的药物敏感性。
2.4 有氧运动对肠系膜动脉PKCα的表达及其与CaV1.2 α1C共定位的影响
高血压时,CaV1.2通道α1C亚基表达增多,有氧运动后,与SHR-SED组相比,SHR-EX组CaV1.2通道α1C亚基表达显著降低,这与实验室前期研究结果相一致(张严焱等,2018)。如图7A所示,PKCα亚基在各组血管平滑肌细胞的胞质和细胞膜上均有表达,且与WKY-SED组相比,SHR-SED组血管平滑肌细胞上的PKCα亚基信号表达显著增强(P<0.05),而有氧运动可显著降低高血压大鼠PKCα亚基信号的表达,同时还增强了PKCα亚基信号在WKY上的表达。对PKCα亚基与α1C亚基进行共定位发现,高血压时,PKCα与α1C的共定位信号显著增强,即高血压时,肠系膜动脉平滑肌细胞膜上的PKCα与CaV1.2耦联增多。12周有氧运动后,与SHR-SED组相比,SHR-EX组PKCα与α1C的共定位信号显著减弱,即肠系膜动脉平滑肌细胞膜上的PKCα与CaV1.2耦联减少,而与WKYSED组相比,WKY-EX组PKCα与α1C的共定位信号显著增强(图7B)。以上结果表明,高血压时,PKCα/CaV1.2信号通路表达上调,而有氧运动可有效抑制其表达的上调。

图7 有氧运动对肠系膜动脉PKCα的表达及其与CaV1.2α1C共定位的影响Figure 7.Effects of Aerobic Exercise on PKCα Expression of Mesenteric Artery and its Effect on Colocalization of CaV1.2α1C
3 讨论
本实验研究结果表明,PKCα在高血压肠系膜动脉张力调节中具有重要作用,这种调节作用与CaV1.2通道功能密切相关,抑制PKCα可诱使CaV1.2通道电流幅值减少;高血压时,肠系膜动脉平滑肌PKCα/CaV1.2表达上调,使血管张力增加;而有氧运动可有效抑制其信号通路上调,从而改善血管舒缩功能。
长期高血压时,血管内的压力不断增加,阻力动脉为适应其血管内压力的改变而发生生物学和结构性的变化。这种变化的具体病理生理机制较为复杂,主要包括血管功能重构、血管内皮功能紊乱、血管平滑肌增大等(Liu et al.,2018;Touyz,2010)。而规律的体力活动被认为是预防和治疗高血压的基石(NHBPEP,2003)。在本研究中,SHR-SED组收缩压显著高于WKY-SED组,而12周有氧运动后,SHR-EX组收缩压较SHR-SED组显著降低,即长期规律的有氧运动可有效降低SHR收缩压,改善血管功能。但目前国内外关于有氧运动降低血压的具体机制尚不完全清楚,根据现有研究文献,主要可归纳为以下几个方面:1)通过对中枢神经功能进行调节来改善血压;2)调节体内与血压相关的激素(儿茶酚胺类、5-羟色胺等)分泌水平;3)调节血管内皮舒张因子的生成;4)调节血管结构的适应性;5)调节血管平滑肌上离子通道的功能重构。
一般认为,原发性高血压形成的基础主要是钙离子通道的功能变化而引起的VSMC的胞内游离的Ca2+浓度([Ca2+]i)升高。CaV1.2通道广泛表达于VSMC膜上,它是细胞外Ca2+进入细胞内的主要途径。研究表明,血管平滑肌细胞膜上的CaV1.2通道表达上调是高血压的一个重要的标志性特征(陈渝 等,2015;张严焱 等,2018),CaV1.2通道表达上调后,其通道开放数量增加,细胞外Ca2+内流增多,血管张力增加,血压升高,且血压升高的程度与CaV1.2通道表达量呈正相关(Navedo et al.,2010;Wellman et al.,2003)。有氧运动可有效抑制高血压诱导的CaV1.2通道的功能重构。在本研究中,CaV1.2通道激动剂BayK8644可诱导血管收缩,使血管张力增加,而CaV1.2通道抑制剂Nifedipine可诱导血管呈浓度依赖性舒张,且高血压时血管对BayK8644、Nifedipine的药物敏感性增强,而有氧运动可有效地抑制SHR的BayK8644、Nifedipine敏感性增强反应,即有氧运动可通过调节肠系膜动脉CaV1.2通道功能改善血管舒张功能、改善高血压,这与前人研究结果一致(陈渝等,2015)。但有氧运动调控高血压肠系膜动脉CaV1.2通道功能的具体作用机制尚不完全清楚。α1C是CaV1.2通道的孔道亚基,具有4个跨膜区构成的成孔亚单位,Ca2+通过此通道进入细胞形成电流。高血压时,CaV1.2通道功能上调主要表现为α1C亚基表达显著增高。前期研究表明,长期规律的有氧运动可有效降低高血压大鼠收缩压,引起β1亚基启动子区发生甲基化,调控miR-328在转录后对CaV1.2通道α1C亚基的表达进行靶向抑制,进而调节高血压肠系膜动脉CaV1.2通道功能,从而改善血管舒缩功能(张严焱等,2018)。除表观遗传修饰外,研究发现,PKC也可对CaV1.2通道功能进行调节(Schuhmann et al.,1994;Tseng et al.,1991),有氧运动可能经PKC途径调节CaV1.2通道功能,从而改善高血压。
PKC是一类丝氨酸/苏氨酸蛋白激酶家族,非活化的PKC主要存在于胞质中,经磷酸化激活后向细胞膜、细胞核、内质网等细胞器发生易位(Ringvold et al.,2016)。活化的PKC可磷酸化不同底物,包括离子通道、泵和核蛋白等。根据亚型结构的不同可将PKC分为3大类:Ca2+和二酰甘油(DAG)依赖性的经典型 PKC(cPKCs:α,βI,βII)、新型PKC(nPKCs:δ,ɛ,η,θ)和DAG依赖性的非经典型PKC(aPKCs:ζ,ι/λ)。其中,cPKCs由4个保守区域(C1~C4)和5个变量区域(V1~V5)构成,主要由Ca2+、DAG激活(Newton,1995;Salamanca et al.,2005)。C1区域包含DAG和佛波醇酯的识别位点,而C2区域富含酸性残留物和包含Ca2+的结合位点。有学者通过测定PKC mRNA表达、蛋白质水平和活性,以及通过研究PKC抑制剂的作用、PKC敲除小鼠和转基因大鼠中血管反应性的变化,发现了PKC在血管收缩中的重要作用(Ringvold et al.,2016)。PKC可以通过多种机制影响血管平滑肌收缩,包括调节离子通道、离子泵、[Ca2+]i等。PKC易位至细胞表面还可以触发一系列蛋白激酶,其最终与收缩肌丝相互作用并引起血管平滑肌收缩。研究发现,佛波醇酯可诱导血管收缩,同时还伴随着平滑肌细胞中的Ca2+内流增多,其机制可能为膜上的CaV1.2通道功能活动增强,[Ca2+]i升高(Bonev et al.,1997)。PKC的磷酸化可参与控制细胞内钙的流入和排出,PKC可增强各种平滑肌细胞中的CaV1.2电流,如肺动脉、脑动脉等(Perzvizcaino et al.,2010)。在本实验中,离体微血管环张力测定结果显示,PKC激动剂PDBu可诱导血管张力增加,且呈一定的浓度依赖性。有研究表明,PKC对CaV1.2通道具有双重调 节 作 用(Lacerda et al.,1988;Schuhmann et al.,1994),这可能与PKC在不同组织中亚型的表达情况有关(Gulia et al.,2013)。PKC亚型在不同的血管细胞类型中具有不同的作用,对VSMC的作用显著。其中,PKCα亚基具有Ca2+依赖性,是血管平滑肌收缩的重要调节器。PKCα通过使肌球蛋白轻链磷酸化、Ca2+通道激活参与平滑肌收缩(Ren et al.,2010)。研究表明,PKCα在肺动脉高血压的发病过程中表达上调,PKCα的活化可能参与肺血管重构(Tan et al.,2005)。在正常生理状态下,PKCα可锚定VSMC,进而调节局部的CaV1.2通道功能活动。PKCα可直接磷酸化CaV1.2通道,以产生持久的钙星(Gollasch et al.,2000)。PKCα与CaV1.2通道功能可能存在一定的关系。为此,我们展开了进一步的研究,发现与直接加入PDBu相比,各组大鼠肠系膜动脉在Gö6976孵育后,PDBu诱发的收缩降低,加入Nifedipine后,各组血管张力前后变化较小,提示PKCα亚基在血管张力调节中具有非常重要的作用,且这一调节作用与CaV1.2通道功能密切相关。免疫荧光结果显示,高血压时,PKCα与CaV1.2α 1C共定位信号显著增强,PKCα/CaV1.2信号通路表达上调,而有氧运动可有效抑制其表达的上调,即有氧运动可经PKCα/CaV1.2信号通路调节高血压肠系膜动脉功能。但值得注意的是,12周有氧运动后,与WKY-SED组相比,WKY-EX组PKCα与CaV1.2α1C共定位信号显著增强,这与SHR-EX中的表现相反。针对这一现象,我们猜测可能是由于SHR和WKY的不同生理和病理状态,使得有氧运动对其二者的作用机制和影响不同。
除CaV1.2通道外,PKCα对其他离子通道功能也具有一定的调节作用。K+通道蛋白的PKCα依赖性磷酸化可降低KV7通道活动(Brueggemann et al.,2014)。在兔的冠状动脉 VSMCs,人内皮素-1(ET-1)和血管紧张素 II(Ang II)通过激活PKCɛ抑制KV电流,通过激活PKCα抑制KIR通道活动(Park et al.,2006)。研究发现,在心肌上,CaV1.2通道具有明确的PKC磷酸位点——Thr27/31(Keef et al.,2001;Lacerda et al.,1988)。但目前在血管平滑肌上,PKCα调节CaV1.2通道功能的具体作用机制仍不清楚,有待进一步的研究。
规律的有氧运动作为一种非药物治疗手段,可通过调控高血压相关离子通道功能活动等机制,在改善高血压、血管舒张功能等方面发挥重要作用。本研究通过离体微血管环张力测定、膜片钳、免疫荧光等技术,从肠系膜动脉收缩特性、CaV1.2通道电流变化、PKCα、CaV1.2通道α1C亚基表达、分布及二者共定位等方面,证明了有氧运动可通过PKCα/CaV1.2信号通路有效地改善高血压肠系膜动脉功能。这为理解有氧运动改善高血压肠系膜动脉CaV1.2通道功能的机制以及高血压药物治疗新靶点的寻找提供了重要证据。
4 结论
有氧运动可有效降低高血压大鼠的体重、血压和心率,抑制高血压诱导的PKCα表达上调,从而调节CaV1.2通道功能,改善高血压,即有氧运动可通过抑制PKCα/CaV1.2信号通路表达上调来改善高血压大鼠的肠系膜动脉舒缩功能。

